環境濃度水平的鎳對不同生命階段秀麗線蟲(Caenorhabditis elegans)體長與運動的刺激效應
陳曉雪,于振洋,尹大強
同濟大學環境科學與工程學院 長江水環境教育部重點實驗室,上海 200092
環境濃度水平的鎳對不同生命階段秀麗線蟲(Caenorhabditiselegans)體長與運動的刺激效應
陳曉雪,于振洋,尹大強*
同濟大學環境科學與工程學院 長江水環境教育部重點實驗室,上海 200092
毒物興奮效應(hormesis)受到廣泛關注。本文以秀麗線蟲(Caenorhabditis elegans)的L1(自蟲卵開始培養10 h)、L3階段(36 h)和年輕成蟲階段(72 h)為起始暴露階段,進行環境濃度(3.18E-3、3.18E-2、3.18E-1和3.18 μmol·L-1)水平的72 h 鎳暴露試驗,以體長與行為學指標為終點研究了不同生命階段對毒物興奮效應的影響。在所有暴露濃度下,鎳對L1線蟲的體長均表現出顯著的刺激效應,3個較高濃度下(3.18E-2、3.18E-1和3.18 μmol·L-1)的刺激效應相似,均表現為比空白多23.6%(P<0.05)的水平;L3線蟲的體長在低濃度受到刺激,在高濃度受到抑制,表現為毒物興奮效應;年輕成蟲在所設4個濃度下均沒有顯著響應。在所有暴露濃度下,鎳對L1線蟲的身體彎曲運動無顯著效應;鎳對L3線蟲的身體彎曲頻率表現為刺激效應,并且該刺激效應隨暴露濃度增加,先增加后減小,在3.18E-2 μmol·L-1表現出最大刺激效應,比空白多59.0%(P<0.05);鎳對年輕成蟲的身體彎曲頻率表現為比空白多17.7%~30.1%(P<0.05)的刺激效應,該刺激效應在不同濃度下不具有顯著性差異。鎳對L1線蟲的倒退運動表現出顯著的、隨暴露濃度增加而增加的刺激效應,在3.18 μmol·L-1表現出最大刺激效應,比空白多187.0%(P<0.05);鎳對L3線蟲的倒退運動在3.18 μmol·L-1下表現為比空白多22.7%(P<0.05)的刺激效應;鎳對年輕成蟲的倒退運動在較高的3個濃度下(3.18E-2、3.18E-1和3.18 μmol·L-1)表現為比空白多46.7%~86.7%(P<0.05)的刺激效應。研究揭示環境濃度水平的鎳暴露對不同生命階段秀麗線蟲的體長與運動具有不同程度的刺激效應。
鎳;秀麗線蟲;生命階段;體長;運動;刺激效應
近年來,在低濃度暴露的毒性效應研究中,毒物興奮效應受到越來越多的關注。毒物興奮效應(hormesis)是指有害物質在高劑量時對生物體表現抑制作用,而在低劑量時卻表現為刺激作用(一般表現為比空白增高30%~60%的水平)的兩階段性效應[1]。毒物興奮效應,現在已經被認為是廣泛存在、可重現的生物學效應。同時,毒物興奮效應模型是一類不同于傳統的漸近線或線性模型的新模型,這對現有的生態風險評價提出挑戰,并將在未來風險評價中的標準設定等方面發揮更為重要的作用[2]。同時,毒物興奮效應,尤其是其對生物學響應的刺激效應,具有通過改變生物適應性,進而影響生態系統穩定性的潛力[3],毒物興奮效應也受到生物學、生態學以及進化學的廣泛關注[4-5]。
大量研究表明,處于不同生命階段的生物體對有害物質具有不同的敏感性,導致同一種物質的生物效應差異顯著。以重金屬鉛和汞為例,Xing等[6]研究了2種金屬對L1階段秀麗線蟲神經元缺失的影響,發現低濃度鉛的神經毒性比汞高;而Du等[7]則發現同樣濃度下汞對L4階段的線蟲的神經毒性高于鉛。再如Yu等[8]以L3階段的線蟲為受試生物,并以身體彎曲頻率為指標,發現鎘會造成線蟲的彎曲頻率明顯下降;另有文獻則報道鎘對L4階段的線蟲身體彎曲頻率影響不明顯[9]。還有學者將青鳉魚的卵暴露于雙酚A 4~8 d后,發現雙酚A導致魚卵嚴重畸形[10];而Zha等[11]發現雙酚A不會使青鳉魚幼魚產生畸形。那么,毒物興奮效應是否會因為受試生物生命階段的不同而不同,尚需要直接的研究予以證實。
本文選擇秀麗線蟲(Caenorhabditis elegans)作為受試生物。秀麗線蟲易于實驗室培養,對環境變化(溫度、化學物質等)敏感,并且其不同生命階段容易獲得,因而廣泛應用于毒性研究以及新型藥品的探索中[8,12-13]。體長與運動是采用秀麗線蟲進行毒性效應檢測的常用指標。體長,體現的是線蟲整體健康水平,廣泛應用于重金屬的毒性表征[8,14]。同時,秀麗線蟲的運動,可體現線蟲神經與肌肉的整體效應,廣泛應用于包括重金屬、藥品等多種物質的毒性效應評價中[8,12-13,15]。
本文采用鎳作為受試物質。鎳是植物和某些動物的必需微量元素[16],也是人類膳食的自然組成[17]。但是,過量的鎳能夠對生命有機體產生傷害。人類活動導致鎳通過大氣、水以及排泄物等多種方式排入環境中,甚至能夠在有機體,尤其是植物中富集[18]。目前對鎳的環境毒性研究以急性暴露的效應為主。鎳對唐魚(Tanichthys albonubes)的96 h半數致死濃度(LC50)為1.58E+2 μmol·L-1,屬于中毒物質[19]。鎳對秀麗線蟲48 h暴露的LC50為4.36E+2 μmol·L-1[20];在10.0 μmol·L-1鎳中暴露12 h能夠顯著誘導秀麗線蟲生殖細胞的凋亡[21]。此外,暴露于加標淡水沉積物(鎳濃度≥3.05E+3 μmol·kg-1)會對無脊椎動物(例如Hyalella azteca等)的生長、繁殖與生存產生顯著的負面影響[22];Vangheluwe等[23]在此基礎上,推薦鎳在沉積物質量標準(reasonable worst case-sediment quality guidelines)中的限值為1.60E+3 μmol·kg-1。但是這些研究所采用的濃度范圍,均遠遠高于環境以及食品中鎳的濃度。例如,鎳在香禾糯、大米中的含量為6.98、10.7 μmol·kg-1[24]。因此這些研究結果并不能夠用于判斷實際暴露條件下鎳對有機體的生物學效應。
近期的研究表明,鎳在環境介質(例如太湖的沉積物)中的存在濃度為μmol·kg-1的水平[25]。本文在此濃度下,設定多組鎳濃度水平(3.18E-3、3.18E-2、3.18E-1和3.18 μmol·L-1),采用秀麗線蟲的L1、L3階段幼蟲與年輕成蟲(自蟲卵開始培養的時間分別為10、36、72 h)為起始暴露階段,進行72 h暴露試驗,以體長與行為學指標為終點研究了不同生命階段對毒物興奮效應的影響。本研究旨在揭示在環境濃度水平的鎳暴露下,不同生命階段秀麗線蟲的不同程度的毒物興奮效應。
1 材料與方法(Materials and methods)
1.1 主要儀器與試劑
儀器:蔡康XTL-3400C型體視顯微鏡(配視頻捕獲設備,上海蔡康光學儀器有限公司)。采用可溶性鎳鹽硝酸鎳(Ni(NO3)2·6H2O)作為暴露體系中鎳的來源,購自上海恒信化學試劑有限公司,純度>98.0%。采用鉀溶液(1 L蒸餾水中,3.00 g氯化鈉,2.36 g氯化鉀;在121 ℃、0.105 MPa滅菌20 min)進行溶解[26]。
1.2 秀麗線蟲的培養
本研究所采用的秀麗線蟲(C. elegans),由上海復旦大學發育生物學研究所惠贈。秀麗線蟲采用覆有尿嘧啶缺陷型大腸桿菌(E. coli OP50)的線蟲生長培養基(nematode growth media, NGM)[27],在22 ℃條件下進行培養;E. coli采用Luria-Bertani培養基在37 ℃恒溫搖床中120 r·min-1進行培養[28]。
1.3 秀麗線蟲的同步化及不同生命階段的獲得
同步化:秀麗線蟲正常培養一段時間后,采用新配制的堿裂解液(Clorox)殺死成蟲,獲得對堿裂解液具有抵抗力的蟲卵[29],將同步化后得到的卵液接種到覆有大腸桿菌OP50的NGM培養基上,22 ℃恒溫培養箱中分別培養10、36、72 h后,得到相對應L1、L3階段幼蟲及年輕成蟲階段的線蟲[30]。
1.4 暴露試驗
采用24孔板進行不同生命階段線蟲的鎳暴露試驗,設定4個鎳暴露濃度組(3.18E-3、3.18E-2、3.18E-1和3.18 μmol·L-1)和1個空白組;每組占用4孔作為平行。染毒組的每孔中,含有500 μL毒液(含不同濃度梯度的鎳)、300 μL含有食物的鉀溶液以及200 μL不同生命階段的秀麗線蟲;空白組的每孔中,加入500 μL鉀溶液、300 μL含有食物的鉀溶液以及200 μL相應生命階段的秀麗線蟲。線蟲經過72 h暴露后,將24孔板中的線蟲轉移到沒有大腸桿菌OP50覆蓋的NGM培養基上,進行相關指標的檢測,得到鎳對線蟲的毒性效應。
1.5 指標的測定
1.5.1 體長的測定
采用體式顯微鏡配備的圖像捕捉設備對暴露后的秀麗線蟲進行拍照并保存,然后使用上海蔡康光學儀器有限公司發行的二維測量軟件(DS-3000)進行秀麗線蟲體長的測定。具體測定步驟為:沿秀麗線蟲身體中線從頭部至尾部、再從尾部至頭部劃折線,折線長度的一半即為秀麗線蟲的體長[31]。
1.5.2 行為指標的測定
采用體式顯微鏡配備的視頻捕捉設備對暴露后的秀麗線蟲的運動進行錄像并保存,然后遵循Wang等[9]的研究方法,進行身體彎曲與倒退運動的檢測。身體彎曲(body bending)定義為:如果設定秀麗線蟲的運動方向為x軸方向,則其咽后部球形部分在y軸方向上的運動方向的一次改變,即為一次身體彎曲。倒退運動(reverse movement):任何從前向后的運動的改變就計數為一次逆向運動;Omega運動也作為逆向運動的一種。Omega運動:秀麗線蟲的身體通過頭部向尾部的彎曲、形成類似希臘字母Omega(Ω)的形狀而完成180°轉彎,從而使得其運動方向反向的轉向。
1.6 數據處理方法
采用軟件Microsoft Office Excel和Origin Pro 7.5軟件對數據進行處理,包括正態性檢驗、平均值計算、顯著性差異分析等內容。本研究所采用的數據表達方式在未經特殊說明的情況下均采用“相對于空白組秀麗線蟲相同指標的百分比(相對空白百分比/%)”的形式表達,圖中數據均采用平均值±標準差的方式表達[13]。
2 結果與討論(Results and discussion)
2.1 環境濃度水平的鎳對不同生命階段秀麗線蟲體長的效應
環境濃度水平的鎳對不同生命階段秀麗線蟲體長的效應如圖1所示。在暴露濃度下,鎳沒有顯著抑制L1線蟲的體長,相反,表現出顯著的刺激效應,鎳在3.18E-2 μmol·L-1濃度下表現出對線蟲體長的最大刺激效應,比空白多23.6%(P<0.05)。鎳對L3線蟲的體長表現出低濃度刺激、高濃度抑制的效應,鎳在3.18E-2 μmol·L-1濃度下產生的最大刺激效應比空白多10.9%(P<0.05),在3.18 μmol·L-1濃度下產生的最大抑制效應比空白小15.5%(P<0.05)。鎳在所選濃度范圍內對年輕成蟲體長沒有產生顯著影響。

圖1 環境濃度水平的鎳暴露對不同 生命階段秀麗線蟲體長的效應Fig. 1 Effects of nickel at environmental concentration on body length of nematodes (Caenorhabditis elegans) at different life stages
從結果中可以看出,鎳的刺激效應在L1秀麗線蟲中表現最明顯,L3階段次之,在年輕成蟲中沒有表現;與此同時,高濃度鎳對L3秀麗線蟲具有抑制效應,而對L1和年輕成蟲沒有表現出抑制效應,這說明鎳對L1秀麗線蟲表現為顯著的毒物興奮效應,而對L3線蟲表現為顯著的毒性效應。在Wang等[32]用硫酸鎳進行世代毒性的研究中,鎳在2.5 μmol·L-1濃度下也顯著刺激了秀麗線蟲體長的增加。盡管該研究中未對所采用秀麗線蟲的生命階段進行界定,但是其研究結果與本文中鎳在3.18 μmol·L-1條件下刺激L1秀麗線蟲體長增加的結果相似。然而,不同生命階段對毒物興奮效應的影響機制還不清楚,需要進一步探索。
2.2 環境濃度水平的鎳對不同生命階段秀麗線蟲運動的效應
環境濃度水平的鎳對不同生命階段秀麗線蟲身體彎曲頻率的效應如圖2所示。在暴露濃度下,鎳對L1線蟲的身體彎曲沒有顯著影響,鎳對L3線蟲身體彎曲表現為刺激效應,而且這種刺激效應隨著鎳濃度的增加,先增加后減小,在3.18E-02 μmol·L-1條件下表現為比空白多59.0%(P<0.05)的最大刺激水平。鎳對年輕成蟲的身體彎曲表現為一定的刺激效應,該刺激效應在不同濃度之間不具有顯著性的差異,維持在比空白多17.7%~30.1%(P<0.05)的水平。
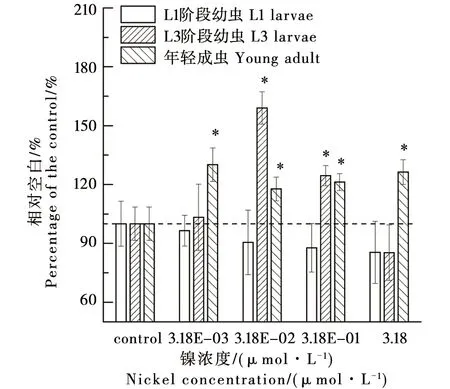
圖2 環境濃度水平的鎳對不同生命階段 秀麗線蟲身體彎曲頻率的效應Fig. 2 Effects of nickel at environmental concentration on body bending frequency of nematodes (Caenorhabditis elegans) at different life stages
環境濃度水平的鎳對不同生命階段秀麗線蟲倒退運動的效應如圖3所示。在暴露濃度下,鎳對L1線蟲的倒退運動產生了顯著的刺激效應,而且該刺激效應隨著暴露濃度的增加而增加,鎳在3.18 μmol·L-1暴露條件下表現出的最大刺激效應比空白多187.0%(P<0.05)。鎳在對較低的3個鎳濃度(3.18E-03、3.18E-02、3.18E-01 μmol·L-1)條件下對L3線蟲的倒退運動無顯著影響,但是在最大暴露濃度(3.18 μmol·L-1)下產生了為比空白多22.7%(P<0.05)的刺激效應。較高的3個鎳濃度(3.18E-02、3.18E-01、3.18 μmol·L-1)對年輕成蟲的倒退運動表現為一定的刺激效應,但是該刺激效應在3個濃度間不具有顯著性的差異,表現為比空白多46.7%~86.7%(P<0.05)的水平。在每一個暴露濃度中,不同生命階段秀麗線蟲倒退運動的順序為:L1 > 年輕成蟲 ≥ L3。
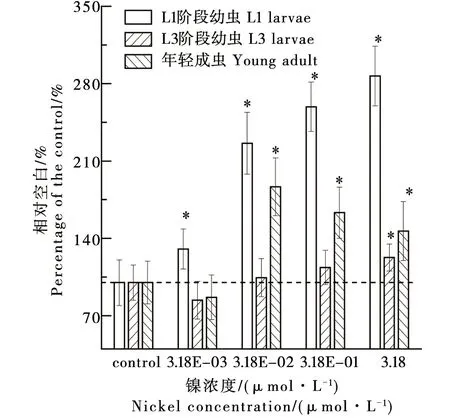
圖3 環境濃度水平的鎳對不同生命 階段秀麗線蟲倒退運動的效應Fig. 3 Effects of nickel at environmental concentration on reverse movement of nematodes (Caenorhabditis elegans) at different life stages
秀麗線蟲的運動軌跡表現為正弦曲線的形狀,該運動模式通過其體內神經突觸對背、腹部體壁肌肉的控制完成[33-34],并且這種運動模式能夠被多種因素改變,例如突變[35],飲食、產卵與交配等自然行為以及來自于環境的刺激等。因此,本研究中發現鎳對行為學指標的抑制效應可能源自于鎳對秀麗線蟲神經系統的影響,而且這種效應與生命階段緊密相關。Xing等[6]采用不同生命階段的秀麗線蟲研究鉛和汞的神經毒性時,已經發現了神經毒性與生命階段的相關性,受試物質對L1~L3線蟲的神經抑制效應高于L4與年輕成蟲。該研究并沒有發現刺激效應,可能原因不僅與不同物質的毒性機制有關,而且可能與諸多不同暴露條件的設定有關,例如Xing等[6]采用2.5~20 μmol·L-1的濃度范圍、在無食物條件下進行了6 h的暴露,而本文采用的最高濃度為3.18 μmol·L-1、在有食物條件下進行了72 h的暴露。
鎳在3.18E-3 μmol·L-1(0.187 mg·L-1)濃度下對不同生命階段線蟲體長和運動產生了不同程度的毒物興奮效應,尤其值得注意的是其中的刺激效應。毒物興奮效應的特殊性使其備受爭議。一方面,毒物興奮效應在細菌、植物、動物甚至人類中具有很高的保守性,這些發現使得這種特殊的效應在疾病的臨床治療、農業/養殖業的快速發展等領域獲得重要應用[2]。另一方面,毒物興奮效應具有通過改變生物適應性,進而影響生態系統穩定性的潛力[3]。因而,需要在綜合考慮受試物質、受試生物及其生命階段、暴露時間(甚至暴露世代)等多種因素的基礎上,對毒物興奮效應的產生機理展開更為深入、全面、合理的研究[36]。
[1] Calabrese E J. Hormesis: Why it is important to toxicology and toxicologists [J]. Environmental Toxicology and Chemistry, 2008, 27(7): 1451-1474
[2] Calabrese E J. Hormesis is central to toxicology, pharmacology and risk assessment [J]. Human & Experimental Toxicology, 2010, 29(4): 249-261
[3] Costantini D, Metcalfe N B, Monaghan P. Ecological pr℃esses in a hormetic framework [J]. Ecology Letters, 2010, 13(11): 1435-1447
[4] Mattson M P, Calabrese E J. Hormesis, A revolution in Biology, Toxicology and Medicine [M]. Totowa: Humana Press Inc., 2010: 57-68
[5] Zhang J, Liu S S, Yu Z Y, et al. Time-dependent hormetic effects of 1-alkyl-3-methylimidazolium chloride and their mixtures on Vibrio qinghaiensisi sp. -Q67: Luminescence, redox reactants and antioxidases [J]. Chemosphere, 2013, 91(4): 462-467
[6] Xing X J, Rui Q, Du M, et al. Exposure to lead and mercury in young larvae induces more severe deficits in neuronal survival and synaptic function than in adult nematodes [J]. Archives of Environmental Contamination Toxicology, 2009, 56(4): 732-741
[7] Du M, Wang D Y. The neurotoxic effects of heavy metal exposure on GABAergic nervous system in nematode Caenorhabditis elegans [J]. Environmental Toxicology and Pharmacology, 2009, 27(3): 314-320
[8] Yu Z Y, Chen X X, Zhang J, et al. Transgenerational effects of heavy metals on L3 larva of Caenorhabditis elegans with greater behavior and growth inhibitions in the progeny [J]. Ecotoxicology and Environmental Safety, 2013, 88(1): 178-184
[9] Wang D, Xing X. Assessment of l℃omotion behavioral defects induced by acute toxicity from heavy metal exposure in nematode Caenorhabditis elegans [J]. Journal of Environmental Sciences, 2008, 20(9): 1132-1137
[10] Pastva S D, Villalobos S A, Kannan K, et al. Morphological effects of bisphenol-A on the early life stages of medaka (Oryzias latipes) [J]. Chemosphere, 2001, 45(4-5): 535-541
[11] Zha J, Wang Z. Acute and early life stage toxicity of industrial effluent on Japanese medaka (Oryzias latipes) [J]. The Science of the Total Environment, 2006, 357(1-3): 112-119
[12] Leung M C K, Williams P L, Benedetto A, et al. Caenorhabditis elegans: An emerging model in biomedical and environmental toxicology [J]. Toxicological Sciences, 2008, 106(1): 5-28
[13] Aitlhadj L, Stürzenbaum S R. The toxicological assessment of two anti-obesity drugs in C. elegans [J]. Toxicology Research, 2013, 2(1): 145-150
[14] Boyd W A, Cole R D, Anderson G L, et al. The effects of metals and food availability on the behavior of Caenorhabditis elegans [J]. Environmental Toxicology and Chemistry, 2003, 22(12): 3049-3055
[15] Gray J M, Hill J J, Bargmann C I. A circuit for navigation in Caenorhabditis elegans [J]. Pr℃eedings of the National Academy of Sciences of the United States of America, 2005, 102(9): 3184-3191
[16] Sigel A, Sigel H, Sigel R K O. Nickel and Its Surprising Impact in Nature: Metal Ions in Life Sciences [M]. Hoboken: John Wiley & Sons Ltd., 2007: 35-40
[17] 柴東方, 蔣天智, 譚甫成, 等. 原生態從江香禾糯中鋅和鎳的含量及其生理功能研究[J]. 安徽農業科學, 2010, 38(31): 17367-17368
Chai D F, Jiang T Z, Tan P C, et al. Determination on Zn and Ni content in Kam Sweet rice of Congjiang and study on its physiological function [J]. Journal of Anhui Agriculture Science, 2010, 38(31): 17367-17368 (in Chinese)
[18] Cempel M, Nikel G. Nickel: A review of its sources and environmental toxicology [J]. Polish Journal of Environmental Studies, 2006, 15(3): 375-382
[19] 林愛薇, 管文帥, 方展強. 汞、鉻和Ni對唐魚的急性毒性及安全濃度評價[J]. 安徽農業科學, 2009, 37(2): 627-629
Lin A W, Guan W S, Fang Z Q. Acute toxicity of mercury, chrome and nickel to Tanichthys albonubes and their safety assessment [J]. Journal of Anhui Agriculture Science, 2009, 37(2): 627-629 (in Chinese)
[20] Chu K W, Chow K L. Synergistic toxicity of multiple heavy metals is revealed by a biological assay using a nematode and its transgenic derivative [J]. Aquatic Toxicology, 2002, 61(1-2): 53-64
[21] Cai K Z, Ren C, Yu Z L. Nickel-induced apoptosis and relevant signal transduction pathways in Caenorhabditis elegans [J]. Toxicology and Industrial Health, 2010, 26(4): 249-256
[22] Besser J M, Brumbaugh W G, Ingersoll C G, et al. Chronic toxicity of nickel-spiked freshwater sediments: Variation in toxicity among eight invertebrate taxa and eight sediment [J]. Environmental Toxicology and Chemistry, 2013, 32(11): 2495-2506
[23] Vangheluwe M L U, Verdonck F A M, Besser J M, et al. Improving sediment quality guidelines for nickel: Development and application of predictive bioavailability models to assess chronic toxicity of nickel in freshwater sediments [J]. Environmental Toxicology and Chemistry, 2013, 32(11): 2507-2519
[24] 趙麗杰, 趙麗萍, 李良, 等. 微波消解-火焰原子吸收光譜法測定食品中痕量鎳[J]. 食品科學, 2012, 33(24): 260-262
Zhao L J, Zhao L J, Li L, et al. Determination of trace nickel in foods by microwave digestion followed by FAAS [J]. Food Science, 2012, 33(24): 260-262 (in Chinese)
[25] Fu J, Hu X, Tao X C, et al. Risk and toxicity assessments of heavy metals in sediments and fishes from the Yangtze River and Taihu Lake, China [J]. Chemosphere, 2013, 93(9): 1887-1895
[26] Williams P L, Dusenbery D B. Aquatic toxicity testing using the nematode, Caenorhabditis elegans [J]. Environmental Toxicology and Chemistry, 1990, 9(10): 1285-1290
[27] Brenner S. The genetics of Caenorhabditis elegans [J]. Genetics, 1974, 77(1): 71-94
[28] 肖琳, 楊柳燕, 尹大強, 等. 環境微生物實驗技術[M]. 北京: 中國環境科學出版社, 2004: 259
[29] Emmons S W, Klass M R, Hirsch D. An analysis of the constancy of DNA sequences during development and evolution of the nematode Caenorhabditis elegans [J]. Pr℃eedings of the National Academy of Sciences of the United States of America, 1979, 76(3): 1333-1337
[30] Van Gilst M R, Hadjivassiliou H, Yamamoto K R. A Caenorhabditis elegans nutrient response system partially dependent on nuclear receptor NHR-49 [J]. Pr℃eedings of the National Academy of Sciences of the United States of America, 2005, 102(38): 13496-13501
[31] Yu Z Y, Jiang L, Yin D Q. Behavior toxicity to Caenorhabditis elegans transferred to the progeny after exposure to sulfamethoxazole at environmentally relevant concentration [J]. Journal of Environmental Sciences, 2011, 23(2): 294-300
[32] Wang D, Wang Y. Nickel sulfate induces numerous defects in Caenorhabditis elegans that can also be transferred to progeny [J]. Environmental Pollution, 2008, 151(3): 585-592
[33] White J G, Southgate E, Thomson J N, et al. The structure of the ventral nerve cord of Caenorhabditis elegans [J]. Philosophical Transactions of the Royal S℃iety of London, Series B, Biological Sciences, 1976, 275(938): 327-348
[34] Wolinsk E, Way J. The behavioral genetics of Caenorhabditis elegans [J]. Behavior Genetics, 1990, 20(2): 169-189
[35] Syntichaki P, Tavernarakis N. Genetic models of mechanotransduction: The nematode Caenorhabditis elegans [J]. Physiological Reviews, 2004, 84(4): 1097-1153
[36] Calabrese E J, Blain R. The occurrence of hormetic dose responses in the toxicological literature, the hormesis database: An overview [J]. Toxicology and Applied Pharmacology, 2005, 202(3): 289-301
◆
StimulationsofNickelatEnvironmentalConcentrationsonLocomotionandGrowthofCaenorhabditiselegansatDifferentLifeStages
Chen Xiaoxue, Yu Zhenyang, Yin Daqiang*
Key Laboratory of Yangtze River Water Environment of Ministry of Education, College of Environmental Science and Engineering, Tongji University, Shanghai 200092, China
18 September 2013accepted5 December 2013
Hormesis is receiving wide attentions. L1 (cultured for 10 h since synchronized eggs), L3 larvae (36 h) and young adult (72 h) of Caenorhabditis elegans were exposed to 3.18E-3, 3.18E-2, 3.18E-1 and 3.18 μmol·L-1of nickel for 72 h to study the hormetic responses of nematodes at different life stages using growth and behavior as endpoints. The body length of L1 nematodes after exposure was significantly stimulated, and the stimulation levels were 23.6% higher than the control (P<0.05), which were similar at the three higher concentrations (3.18E-2, 3.18E-1 and 3.18 μmol·L-1). The body length of L3 nematodes was stimulated at low concentration and inhibited at high concentration, indicating hormetic effects. The body length of young adults was not significantly influenced after exposure to the four concentrations of nickel. The body bending of L1 nematodes was not affected by nickel exposure. The body bending of L3 nematodes was stimulated, and the stimulated levels firstly increased to the maximum of 59.0% higher than the control (P<0.05) at 3.18E-2 μmol·L-1and then deceased with increasing concentration. The body bending of young adult nematodes was stimulated at the levels of 17.7%-30.1% higher than the control (P<0.05), and the stimulation levels had no significant differences among the four exposure concentrations. The reversal movement of L1 nematodes showed significant and concentration-dependent stimulations by nickel exposure, with a maximum of 187.0% higher than the control (P<0.05) at 3.18 μmol·L-1. The reversal movement of L3 nematodes was stimulated at the level of 22.7% higher than the control (P<0.05) at 3.18 μmol·L-1. The reversal movement of young adults increased by 46.7%-86.7% than the control (P<0.05) at the three higher concentrations (3.18E-2, 3.18E-1 and 3.18 μmol·L-1). The body length and l℃omotion movement in nematodes at different life stages showed different degrees of stimulations at environmental concentrations of nickel.
nickel; Caenorhabditis elegans; life stage; body length; l℃omotion; stimulation
國家自然科學基金(21307095),中國博士后科學基金(2013M540390)
陳曉雪(1987-),女,學士,研究方向為毒理學,E-mail: cxxxil@163.com;
*通訊作者(Corresponding author),E-mail: yindq@tongji.edu.cn
10.7524/AJE.1673-5897.20130918001
陳曉雪,于振洋,尹大強. 環境濃度水平的鎳對不同生命階段秀麗線蟲(Caenorhabditis elegans)體長與運動的刺激效應[J]. 生態毒理學報, 2014, 9(2): 299-305
Chen X X, Yu Z Y, Yin D Q. Stimulations of nickel at environmental concentrations on locomotion and growth of Caenorhabditis elegans at different life stages [J]. Asian Journal of Ecotoxicology, 2014, 9(2): 299-305 (in Chinese)
2013-09-18錄用日期2013-12-05
1673-5897(2014)2-299-07
X171.5
A
尹大強(1962—),男,博士,教授,主要從事污染物生態效應與毒性機理、化學品生態與健康風險的研究。

