鄰苯二甲酸二(2-乙基己)酯(DEHP)和鄰苯二甲酸單乙基己基酯(MEHP)長期暴露對海洋青鳉(Oryzias melastigma)內分泌干擾效應的評價
葉婷,康美,黃乾生,董四君
中國科學院城市環(huán)境研究所 中國科學院城市環(huán)境與健康重點實驗室,廈門361021
鄰苯二甲酸二(2-乙基己)酯(DEHP)和鄰苯二甲酸單乙基己基酯(MEHP)長期暴露對海洋青鳉(Oryzias melastigma)內分泌干擾效應的評價
葉婷,康美,黃乾生#,董四君*
中國科學院城市環(huán)境研究所 中國科學院城市環(huán)境與健康重點實驗室,廈門361021
為探討鄰苯二甲酸二(2-乙基己)酯(DEHP)和鄰苯二甲酸單乙基己基酯(MEHP)長期暴露對海水生物的內分泌干擾效應及機制,將孵化后1周的海洋青鳉(Oryzias melastigma)分別暴露于DEHP(0.1 mg·L-1和0.5 mg·L-1)和MEHP(0.1 mg·L-1和0.5 mg·L-1)6個月。結果顯示:DEHP顯著增加了雌性和雄性海洋青鳉的肝指數(shù),而MEHP只在高劑量時顯著增加雄性青鳉的肝指數(shù)。對于雌性青鳉,DEHP暴露后肝臟雌激素相關基因ERα、ERβ、ERγ、VTG1、VTG2、ChgH和ChgL的表達水平顯著上調,而對于雄性青鳉,DEHP暴露后,只有肝臟ERβ的表達水平顯著上調。相比之下,MEHP暴露對雌性和雄性青鳉肝VTG和Chg基因表達無顯著影響。DEHP激活了雌性和雄性青鳉的肝過氧化物增殖激活受體PPARα和PPARγ,而MEHP只在低劑量時上調了雄性青鳉PPARγ的表達。在雌性和雄性青鳉體內,VTG和Chg的表達與ERα和ERγ的表達顯著相關,并且ER與PPAR也顯著相關。研究表明,DEHP長期暴露可通過激活肝性激素受體調控肝雌激素響應基因(VTG和Chg)和過氧化物增殖激活受體(PPARα和PPARγ)的表達而對海洋青鳉產生內分泌干擾效應,并且顯示出性別特異性。MEHP對海洋青鳉的內分泌干擾效應弱于DEHP。
海洋青鳉(Oryzias melastigma);鄰苯二甲酸二(2-乙基己)酯(DEHP);鄰苯二甲酸單乙基己基酯(MEHP);雌激素受體(ER);卵黃蛋白原(VTG);卵膜蛋白原(Chg);過氧化物增殖激活受體(PPAR)
鄰苯二甲酸二(2-乙基己)酯(di(2-ethylhexyl) phthalate, DEHP)是一種新興的內分泌干擾化合物,常添加于聚氯乙烯材料增加可塑性,普遍應用于食品包裝材料、建筑裝飾材料、兒童玩具和醫(yī)療器械等產品中,DEHP也作為起云劑添加于各種果汁、果凍和飲料等食品中[1]。DEHP與塑料材料是以普通的分子間作用力結合,容易從塑料材料中釋放進入環(huán)境[2]。鄰苯二甲酸鹽的濃度在表層海水、海水沉積物和海水生物中分別高達300 μg·L-1、3 μg·g-1和4.07 ng·g-1[3]。高脂溶性使DEHP大量蓄積在魚體組織從而引起毒性效應[4]。很多哺乳動物研究表明DEHP具有生殖毒性效應,如導致胚胎畸形、睪丸萎縮和精子畸形等[1]。DEHP影響了一些淡水生物的生殖發(fā)育,如抑制雌性日本青鱂魚(Oryzias latipes)卵巢的發(fā)育[5],降低雌性斑馬魚(Danio rerio)的產卵量[6],降低雄性斑馬魚受精率[7]等。斑馬魚肝細胞研究顯示DEHP具有雌激素活性,并表現(xiàn)出性別差異[8]。哺乳動物研究結果顯示鄰苯二甲酸單乙基己基酯(mono(2-ethylhexyl)phthalate, MEHP)作為DEHP主要代謝產物,可通過干擾固醇類激素生物合成從而引起生殖毒性[9]。很多哺乳動物研究顯示DEHP的代謝產物MEHP的毒性效應強于DEHP,并且DEHP產生的毒性效應主要是由其代謝產物引起的[1]。然而由于哺乳動物與水體脊椎動物的生理特性有很大差異,且海水環(huán)境和淡水環(huán)境差別較大,若要明確海水環(huán)境中DEHP和MEHP對海水生物毒性效應,需應用一種典型的海洋生物進行評估,目前DEHP和MEHP對海水生物的毒性毒理研究還很少。海洋青鳉(Oryzias melastigma)世代周期短,性別容易區(qū)分,對污染物干預敏感等優(yōu)勢使海洋青鳉越來越廣泛用于海洋生態(tài)毒理學研究[10]。
本研究評價了DEHP和MEHP長期暴露對海洋青鳉肝指數(shù)的影響,采用熒光定量PCR技術檢測內分泌干擾相關基因的mRNA水平,如肝臟性激素受體ERα、ERβ、ERγ和ARα,VTG亞型(VTG1和VTG2),Chg亞型(ChgH和ChgL),以及過氧化物增殖激活受體PPAR亞型(PPARα和PPARγ),并分析性固醇激素受體基因與VTG、Chg和PPAR相關基因之間的關系,以探討DEHP及其代謝產物MEHP引起海洋青鳉內分泌干擾的分子基礎,為海洋污染風險評估提供理論依據(jù)。
1 材料與方法(Materials and methods)
1.1 儀器與試劑
儀器:UNIVERSAL 320R臺式(常溫/低溫)離心機(德國Hettich Zentrifugen公司);ND-1000超微量紫外可見分光光度計(美國Gene Companey Limited公司);Mastercycler? personal PCR儀(德國EPPENDORF公司),Lightcycler 480實時熒光定量PCR儀(瑞士Roche公司)。
試劑:DEHP,優(yōu)級純,購于美國Supelco公司,溶于二甲基亞砜(DMSO,優(yōu)級純,美國Sigma-Aldrich公司),濃度為1 g·mL-1,將母液用DMSO稀釋至0.01 g·mL-1備用;MEHP,優(yōu)級純,購于美國AccuStandard公司。將MEHP用DMSO配成0.01 g·mL-1母液備用;RNA提取試劑盒(美國Omega生物技術公司);反轉錄試劑盒(PrimeScriptTMRT-PCR Kit,寶生物工程(大連)有限公司);SYBR Premix Ex TaqTM試劑盒(寶生物工程(大連)有限公司)。
1.2 海洋青鳉暴露實驗
將孵化1周后的健康幼魚隨機分為5組:溶劑(DMSO)對照組,2個DEHP暴露組(0.1 mg·L-1和0.5 mg·L-1),2個MEHP暴露組(0.1 mg·L-1和0.5 mg·L-1),所選暴露濃度參考文獻[11],每組設3個重復,每個重復約含50條幼魚,暴露海水中DMSO終濃度小于1‰(體積分數(shù))。養(yǎng)殖海水體積第1個月每個重復為3 L,第2月至第3月為6 L,第4月至第6月為10 L。1周換3次水,養(yǎng)殖海水為人工海水,鹽度30‰,溫度(28±1)℃;光/暗周期為14 h∶10 h;用新孵化的豐年蝦喂食,每天喂食2次。暴露過程中,記錄海洋青鳉的死亡情況,及時撈出死魚。暴露6個月后,每個重復隨機取雌雄魚各5條分別于冰水中麻醉10秒,擦干,測量體長并稱量體重,取肝稱重,計算肝指數(shù),肝指數(shù)=肝重/(體重-肝重),將5條同性別魚的肝合并為1個肝樣品凍存于-80℃,用于后續(xù)RNA提取。
1.3 RT-PCR分析肝臟基因表達變化
采用RNA提取試劑盒提取RNA,提取后采用分光光度法鑒定RNA質量,測定RNA濃度,采用反轉錄試劑盒進行反轉錄,獲得cDNA。用SYBR Premix Ex TaqTM試劑盒在羅氏480儀器上進行熒光定量PCR反應。用于熒光定量PCR的引物序列見表1,其中雄激素受體α(ARα)的引物是根據(jù)筆者前期研究中對Illumina RNA測序獲得的序列而設計[12]。采用18S rRNA作為內參基因,用2-ΔΔCT方法來定量基因表達的相對變化倍數(shù)[13]。
1.4 數(shù)據(jù)分析
所有基因表達的實驗數(shù)據(jù)采用平均值±標準誤差表示。采用SPSS16.0軟件進行單因素方差分析(One-Way AVONA)和Turkey’s檢驗。用斯皮爾曼秩相關分析方法分析肝臟性固醇激素受體基因與其他基因表達水平之間的相關關系。置信水平p<0.05時差異顯著,置信水平p<0.01時差異極顯著.
2 結果(Results)
2.1 DEHP和MEHP對海洋青鳉生長狀況及肝指數(shù)的影響
在暴露過程中,DEHP和MEHP對海洋青鳉的體長、體重和存活情況無顯著影響。如圖1所示,與溶劑對照組相比,DEHP暴露顯著增加了雌性和雄性青鳉的肝指數(shù)。只有高劑量MEHP處理顯著增加雄性青鳉肝指數(shù)。可見DEHP對肝指數(shù)的影響強于MEHP。

表1 用于實時熒光定量PCR分析的引物序列Table 1 Primers used in the real-time quantitative RT-PCR analysis
注:a引物信息參考文獻[14];b引物信息參考文獻[15]。
Note: a, the primer information were according to reference [14]; b, the primer information were according to reference [15].
2.2 DEHP和MEHP對海洋青鳉肝臟基因表達的影響
DEHP和MEHP對海洋青鳉肝臟性固醇激素受體相關基因表達的影響具有性別特異性。如表2所示,對于雌性青鳉,相對溶劑對照組,DEHP暴露顯著上調了ERα基因表達水平(p<0.05),低劑量DEHP顯著上調了ERβ和ERγ基因表達水平(p<0.01),而MEHP只在低劑量時顯著上調了ERβ基因表達水平(p<0.05),低劑量MEHP和高劑量DEHP顯著下調了雄激素受體ARα的表達(p<0.05)。然而對于雄性青鳉,相對溶劑對照組,只有低劑量DEHP和MEHP暴露顯著上調了ERβ基因表達水平(p<0.05),DEHP和MEHP對ERα、ERγ和ARα基因表達無顯著性影響(p>0.05)。
如表2所示,DEHP和MEHP對海洋青鳉肝臟雌激素相關基因VTG1、VTG2、ChgH和ChgL表達的影響也顯示出性別特異性。對于雌性青鳉,相對溶劑對照組,DEHP暴露顯著上調了VTG1、VTG2、ChgH和ChgL的基因表達水平(P<0.05),而MEHP對這些基因的表達無顯著影響(p>0.05)。對于雄性青鳉,相對溶劑對照組,MEHP暴露顯著下調了ChgL表達水平(p<0.05),DEHP和MEHP對VTG1、VTG2和ChgH的基因表達無顯著性影響。
如表2所示,DEHP和MEHP對海洋青鳉過氧化物增殖激活受體PPARα和PPARγ基因表達的影響也顯示了性別特異性。DEHP暴露上調了雌性和雄性青鳉PPARα基因的表達(p<0.05),而MEHP對PPARα基因的表達無顯著影響(p>0.05)。低劑量的DEHP顯著上調了雌性青鳉PPARγ基因表達(p<0.05)。對于雄性青鳉,DEHP暴露和低劑量MEHP顯著上調了PPARγ基因表達(p<0.05)。
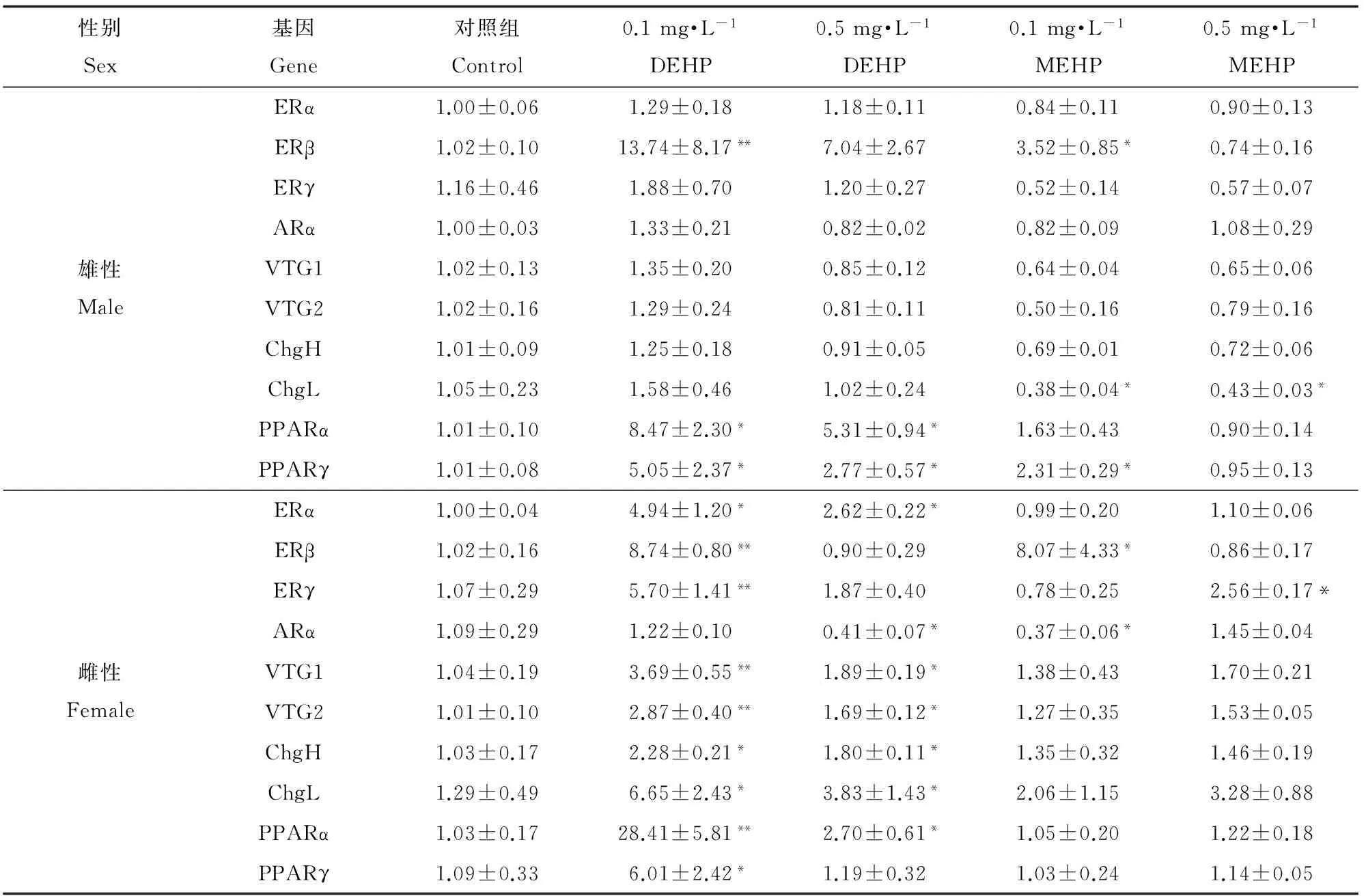
表2 DEHP和MEHP對海洋青鳉肝組織內分泌相關基因表達水平的影響Table 2 Effects of DEHP and MEHP on the relative expression levels of endocrine-related genes in hepatic tissue of O. melastigma
注:與對照組相比,* p<0.05、** p<0.01。
Note: * p<0.05, ** p<0.01, compared with the control.
2.3 肝臟性固醇激素受體與VTG、Chg及PPAR基因表達之間的關系
雌性和雄性青鳉肝臟性固醇激素受體和其他基因之間存在相互關系。如表3所示,對于雌性青鳉,肝雌激素受體ERα與ERγ存在顯著的正相關關系(p<0.05),并且ERα與VTG1、VTG2和ChgH顯著正相關(p<0.05),ERγ與VTG1、VTG2、ChgH和ChgL極顯著正相關(p<0.01),ERα和ERγ與PPARα和PPARγ顯著正相關,且ERβ和ARα與VTG和Chg之間不存在顯著相關關系。對于雄性青鳉,ERα與ERβ、ERγ、VTG1、VTG2、ChgH和ChgL顯著相關(p<0.05),ERγ與VTG1、VTG2、ChgH和ChgL極顯著相關(p<0.01),ERα和ERγ與PPARα顯著正相關。與雌性青鳉不同的是,ERβ與PPARα和PPARγ顯著正相關,并且ARα與VTG2之間存在顯著相關關系。
3 討論(Discussion)
3.1 DEHP和MEHP對海洋青鳉肝指數(shù)的影響
肝臟是魚體卵黃蛋白原VTG和卵膜蛋白原Chg合成的主要場所,VTG和Chg是卵巢發(fā)育的重要蛋白,研究顯示肝指數(shù)(HSI)隨著VTG的增加而增加[16]。所以肝臟是一個與內分泌調節(jié)相關的重要器官,肝指數(shù)普遍用作指示內分泌干擾效應的指標。本研究結果顯示,DEHP增加了雌性和雄性海洋青鳉的肝指數(shù)。一些研究結果顯示,DEHP等雌激素化合物主要增加了雄魚的肝指數(shù),對雌魚肝指數(shù)無顯著影響[17-19]。這可能是因為海水環(huán)境影響了污染物的物理化學性質,且所選魚種的生理特性也有差異。研究顯示鹽度會增強污染物在生物體內的蓄積能力,從而影響污染物對生物體的毒性效應[20]。所以筆者推測與淡水生物相比,DEHP在海洋青鳉體內的蓄積可能增強了,進而增強了DEHP對肝臟的影響。但也不能排除水生生物的物種差異的原因,具體機制還有待進一步探究。本研究結果還顯示,與DEHP相比,MEHP對肝指數(shù)的影響較弱,MEHP只有在高劑量時才會增加雄性青鳉的肝指數(shù),而對雌魚的肝指數(shù)無顯著影響。而且研究還發(fā)現(xiàn)MEHP只上調了雌雄青鳉ERβ和雄性青鳉PPARγ表達,下調了雌性青鳉ARα和雄性青鳉ChgL表達。這均說明MEHP對海洋青鳉產生的內分泌干擾效應較弱。MEHP是DEHP的主要代謝產物,故筆者推斷DEHP對海洋青鳉的內分泌干擾效應可能主要來自DEHP本身,其代謝產物MEHP有較弱的內分泌干擾作用。但是這些結論的證實還需要進行更深入的研究。
3.2 DEHP和MEHP對海洋青鳉肝雌激素響應基因的影響
卵生脊椎動物卵母細胞的生長需要吸收卵黃前體蛋白,主要是在卵子發(fā)生的卵黃生成階段產生的卵黃蛋白原(VTG)和低密度脂蛋白,在雌魚體內,這些蛋白在下丘腦-垂體-性腺-肝臟軸調控下主要在肝臟中合成。環(huán)境內分泌干擾化合物能干預性激素如雌二醇和睪酮的合成,雌二醇隨血液流向肝臟,激活并結合雌激素受體ER形成二聚化的配體受體復合物,該復合物識別并結合VTG和Chg基因的雌激素響應元素(estrogen responsive element, ERE),從而調控VTG和Chg的轉錄[21]。在脊椎動物中有3個不同的雌激素受體亞型,硬骨魚中為ERα、ERβ和ERγ。本研究結果顯示,DEHP長期暴露上調了雌性青鳉肝臟ERα、ERβ和ERγ的表達,也同時上調了肝VTG1、VTG2、ChgH和ChgL的表達,所以推測DEHP暴露可能增加了類固醇激素如雌二醇的生物合成,雌二醇結合肝雌激素受體,上調雌激素受體的表達,增加雌激素受體配體復合物的形成,從而增加與VTG和Chg雌激素響應元素的結合,以致增加VTG和Chg的轉錄。還有可能是由于DEHP有雌激素效應,可以結合雌激素受體而引發(fā)下游一系列的變化。雌性青鳉肝性固醇激素受體、VTG和Chg表達的上調會導致肝臟合成更多的卵黃蛋白原和卵膜蛋白原,這可能是導致肝指數(shù)增加的原因。根據(jù)肝臟性固醇激素受體基因與其他基因表達水平相關分析結果可知,在雌性和雄性青鳉肝臟中ERβ與VTG和Chg基因之間不存在顯著相關關系,并且DEHP上調了雄性青鳉魚肝臟ERβ的表達,對雄性青鳉魚其余的性固醇激素受體、VTG和Chg的表達均無顯著影響,這說明ERβ不是調控VTG和Chg表達的主要性固醇激素受體。DEHP對這些基因表達的影響顯示出性別特異性,對雌性青鳉肝臟的影響較強。根據(jù)基因表達結果可知,MEHP對雌性青鳉肝ERα、VTG和Chg的表達無顯著影響,相比之下DEHP作用較強,這可能是由于DEHP對海洋青鳉的毒性效應強于MEHP,也可能是DEHP代謝成MEHP過程中的一些其他代謝產物如二乙基己醇、二乙基己荃和二乙基己酸等引起的,有報道顯示這些代謝產物的毒性強于DEHP[22]。這不同于哺乳動物的研究結果,DEHP對哺乳動物的毒性效應主要是由其代謝產物引起的,代謝產物MEHP的毒性效應強于DEHP[23-24]。有研究報道雄性棘魚長期暴露于較高濃度的雌激素化合物中,雄激素受體的表達顯著下調,該化合物具有抗雄激素能力[25],高劑量DEHP和低劑量MEHP顯著下調了雌性青鳉ARα的表達,所以筆者推測DEHP和MEHP在雌性青鳉體內顯示了抗雄激素能力。而DEHP和MEHP對雄性青鳉ARα的表達無顯著影響,這顯示出性別特異性的作用效應。
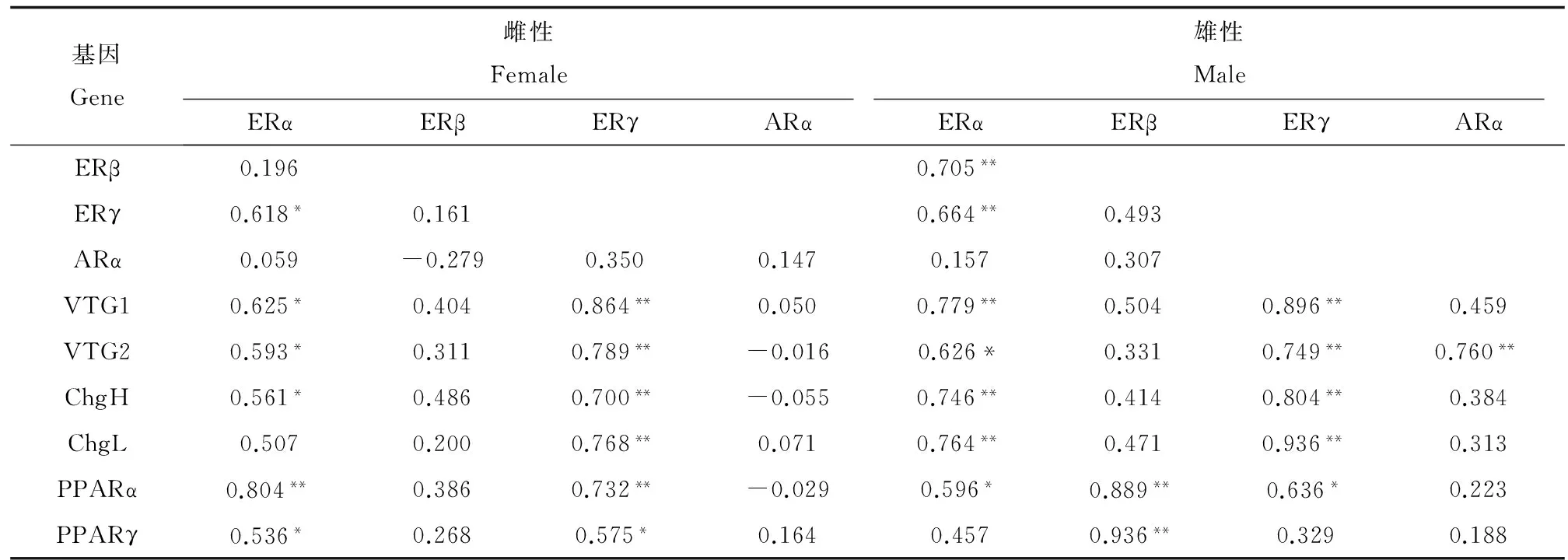
表3 肝臟性固醇激素受體基因與其他基因表達水平斯皮爾曼等級相關系數(shù)Table 3 Spearman rank correlation coefficients between hepatic expression levels of steroid hormone receptors and other genes
注:與對照組相比,* p<0.05、** p<0.01。
Note: * p<0.05, ** p<0.01, compared with the control.
3.3 DEHP和MEHP對海洋青鳉肝臟過氧化物增殖激活受體的影響
鄰苯二甲酸酯類化合物屬于過氧化物酶體增殖激活物,過氧化物酶體增殖激活物引起的一些內分泌干擾效應可能與過氧化物增殖激活受體相關[1]。PPARα的激活是鄰苯二甲酸酯類化合物引起包括肝腫脹、誘導過氧化物酶體增殖激活和滑面內質網增殖等肝臟毒性反應的必要條件[26]。本研究結果顯示,DEHP激活了雌性和雄性青鳉的肝PPARα,推測DEHP可結合并激活PPARα而引起肝臟毒性效應。然而MEHP對青鳉的肝PPARα轉錄活性無顯著影響,所以我們推測在激活青鳉肝PPARα時,DEHP的作用強于MEHP。PPARγ在脂肪細胞分化和脂質儲存過程中起到重要作用,PPARγ的激活可增強脂質吸收,增加脂肪酸合成,促進脂質儲存并抑制脂肪分解[27],DEHP和MEHP在低劑量時可激活肝PPARγ,顯示了低劑量誘導效應,所以可推測DEHP和MEHP影響了海洋青鳉的能量代謝,從而引起了內分泌干擾效應。胚胎瘤細胞系研究顯示MEHP可激活PPAR的3個亞型(PPARα、PPARβ和PPARγ),但主要激活PPARα,DEHP代謝成MEHP過程中產生的代謝產物如二乙基己酸也是PPARα、PPARβ和PPARγ的激活劑[26],但其激活作用較弱。對于人體的研究顯示,鄰苯二甲酸酯類化合物不會引起過氧化物增殖激活反應,可能的原因是肝PPARα在這些物種中表達水平較低[28]。可見,DEHP和MEHP在不同物種體內可激活不同的PPAR受體,顯示了物種差異性。3.4 性固醇激素受體與VTG、Chg及PPAR的相關性
對性固醇激素受體、VTG和Chg的表達進行了秩相關分析,結果顯示,在雌性青鳉肝臟中,ERα和ERγ顯著相關,在雄性青鳉肝臟中,ERα與ERβ和ERγ顯著相關。一些硬骨魚研究顯示ERγ和ERβ緊密相關[29]。在雌性和雄性青鳉體內,VTG和Chg與ERα和ERγ的表達顯著相關,與ERβ的表達無顯著相關關系,說明肝VTG和Chg的轉錄主要受到肝ERα和ERγ的調節(jié)。而在淡水青鳉中,肝VTG和Chg主要受肝ERα調節(jié),與ERβ、ERγ和ARα不存在相關關系[30]。一項關于金魚的研究顯示3個ER亞型(ERα、ERβ和ERγ)對于雌二醇誘導VTG合成都很重要[31]。這說明ERα、ERβ和ERγ在不同種類的魚體內對肝VTG和Chg的誘導起到不同的作用。在雄性青鳉體內,VTG2的表達還與ARα有顯著的正相關關系,這可能是由于雄激素也涉及了VTG的合成,金魚和虹鱒魚研究顯示雄激素如睪酮誘導了VTG的轉錄[32]。本研究發(fā)現(xiàn),ER通路與PPAR通路之間存在相關關系,在雌性青鳉肝臟中,肝ERα和ERγ顯著正相關于肝PPARα和PPARγ,而在雄性青鳉肝臟中,肝ERα和ERγ顯著正相關于肝PPARα,肝ERβ顯著正相關于肝PPARα和PPARγ。乳腺癌細胞研究結果顯示,PPAR通路與ER通路是相互關聯(lián)的,PPAR/RXR異質二聚體可以結合雌激素響應元素而不受ER的影響,另一方面雌激素ERα干預了過氧化物增殖響應元素(PPRE)介導的轉錄活性,ERα和PPARγ能潛在增強雌激素響應元素和過氧化物增殖響應元素介導的反應[33],所以ER和PPAR通路共同調控了海洋青鳉的內分泌干擾作用。
綜上所述,DEHP長期暴露會對海洋青鳉產生內分泌干擾作用,通過激活肝性激素受體調控肝雌激素響應基因(VTG和Chg)和過氧化物增殖激活受體(PPARα和PPARγ)的表達,并且顯示出性別特異性。MEHP對海洋青鳉的內分泌干擾效應較弱,DEHP對海洋青鳉的影響強于MEHP。
[1] Magdouli S, Daghrir R, Brar S K, et al. Diethylhexylphtalate in the aquatic and terrestrial environment: A critical review [J]. Journal of Environmental Management, 2013, 127: 36-49
[2] Sioen I, Fierens T, Van Holderbeke M, et al. Phthalates dietary exposure and food sources for Belgian preschool children and adults [J]. Environment International, 2012, 48: 102-108
[3] Liu Y, Guan Y, Yang Z, et al. Toxicity of seven phthalate esters to embryonic development of the abalone Haliotis diversicolor supertexta [J]. Ecotoxicology, 2009, 18(3): 293-303
[4] Huang P C, Tien C J, Sun Y M, et al. Occurrence of phthalates in sediment and biota: Relationship to aquatic factors and the biota-sediment accumulation factor [J]. Chemosphere, 2008, 73(4): 539-544
[5] Kim E J, Kim J W, Lee S K. Inhibition of oocyte development in Japanese medaka (Oryzias latipes) exposed to di-2-ethylhexyl phthalate [J]. Environment International, 2002, 28(5): 359-365
[6] Carnevali O, Tosti L, Speciale C, et al. DEHP impairs zebrafish reproduction by affecting critical factors in oogenesis [J]. PloS One, 2010, 5(4): e10201
[7] Uren-Webster T M, Lewis C, Filby A L, et al. Mechanisms of toxicity of di (2-ethylhexyl) phthalate on the reproductive health of male zebrafish [J]. Aquatic Toxicology, 2010, 99(3): 360-369
[8] Maradonna F, Evangelisti M, Gioacchini G, et al. Assay of Vtg, ERs and PPARs as endpoint for the rapid in vitro screening of the harmful effect of di-(2-ethylhexyl)-phthalate (DEHP) and phthalic acid (PA) in zebrafish primary hepatocyte cultures [J]. Toxicology in Vitro, 2013, 27(1): 84-91
[9] Chauvigné F, Plummer S, Lesné L, et al. Mono-(2-ethylhexyl) phthalate directly alters the expression of Leydig cell genes and CYP17 lyase activity in cultured rat fetal testis [J]. PloS one, 2011, 6(11): e27172
[10] 伍辛瀧, 黃乾生, 方超, 等. 新興海洋生態(tài)毒理學模式生物——海洋青鳉(Oryzias melastigma) [J]. 生態(tài)毒理學報, 2012, 7(4): 345-353
Wu X L, Huang Q S, Fang C, et al. Oryzias melastigma: A new promising model organism for marine ecotoxicology [J]. Asian Journal of Ecotoxicology, 2012, 7(4): 345-353 (in Chinese)
[11] Staples C A, Adams W J, Parkerton T F, et al. Aquatic toxicity of eighteen phthalate esters [J]. Environmental Toxicology and Chemistry, 1997, 16(5): 875-891
[12] Huang Q, Dong S, Fang C, et al. Deep sequencing-based transcriptome profiling analysis of Oryzias melastigma exposed to PFOS [J]. Aquatic Toxicology, 2012, 120-121: 54-58
[13] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod [J]. Methods, 2001, 25(4): 402-408
[14] Fang C, Wu X L, Huang Q S, et al. PFOS elicits transcriptional responses of the ER, AHR and PPAR pathways in Oryzias melastigma in a stage-specific manner [J]. Aquatic Toxicology, 2012, 106-107: 9-19
[15] Chen X, Li V W T, Yu R M K, et al. Choriogenin mRNA as a sensitive molecular biomarker for estrogenic chemicals in developing brackish medaka (Oryzias melastigma) [J]. Ecotoxicology and Environmental Safety, 2008, 71(1): 200-208
[16] Flippin J L, Huggett D, Foran C M. Changes in the timing of reproduction following chronic exposure to ibuprofen in Japanese medaka, Oryzias latipes [J]. Aquatic Toxicology, 2007, 81(1): 73-78
[17] Wang X, Yang Y, Zhang L, et al. Endocrine disruption by di-(2-ethylhexyl)-phthalate in Chinese rare minnow (Gobiocypris rarus) [J]. Environmental Toxicology and Chemistry, 2013, 32(8): 1846-1854
[18] Wang Y, Zhou Q, Wang C, et al. Estrogen‐like response of perfluorooctyl iodide in male medaka (Oryzias latipes) based on hepatic vitellogenin induction [J]. Environmental Toxicology, 2011, 28(10): 571-578
[19] Kang I J, Yokota H, Oshima Y, et al. Effects of 4-nonylphenol on reproduction of Japanese medaka, Oryzias latipes [J]. Environmental Toxicology and Chemistry, 2003, 22(10): 2438-2445
[20] 黃乾生, 陳亞檞, 方超, 等. 鹽度影響全氟辛烷磺酸對海水青鳉(Oryzias melastigma)的毒性[J]. 科學通報, 2013, 58(2): 151-157
[21] Arukwe A, Goks?yr A. Eggshell and egg yolk proteins in fish: Hepatic proteins for the next generation: Oogenetic, population, and evolutionary implications of endocrine disruption [J]. Comparative Hepatology, 2003, 2(1): 4. doi:10.1186/1476-5926-2-4
[22] Horn O, Nalli S, Cooper D, et al. Plasticizer metabolites in the environment [J]. Water Research, 2004, 38(17): 3693-3698
[23] Shiota K, Mima S. Assessment of the teratogenicity of di (2-ethylhexyl) phthalate and mono (2-ethylhexyl) phthalate in mice [J]. Archives of Toxicology, 1985, 56(4): 263-266
[24] Daniel J W. Toxicity and metabolism of phthalate esters [J]. Clinical Toxicology, 1978, 13(2): 257-268
[25] Katsiadaki I, Williams T D, Ball J S, et al. Hepatic transcriptomic and metabolomic responses in the Stickleback (Gasterosteus aculeatus) exposed to ethinyl-estradiol [J]. Aquatic Toxicology, 2010, 97(3): 174-187
[26] Lapinskas P J, Brown S, Leesnitzer L M, et al. Role of PPARα in mediating the effects of phthalates and metabolites in the liver [J]. Toxicology, 2005, 207(1): 149-163
[27] Puglisi M J, Hasty A H, Saraswathi V. The role of adipose tissue in mediating the beneficial effects of dietary fish oil [J]. The Journal of Nutritional Biochemistry, 2011, 22(2): 101-108
[28] Palmer C N, Hsu M H, Griffin K J, et al. Peroxisome proliferator activated receptor-α expression in human liver [J]. Molecular Pharmacology, 1998, 53(1): 14-22
[29] Ko C-I, Chesnel A, Mazerbourg S, et al. Female-enriched expression of ERα during gonad differentiation of the urodele amphibian Pleurodeles waltl [J]. General and Comparative Endocrinology, 2008, 156(2): 234-245
[30] Zhang X, Hecker M, Park J-W, et al. Real-time PCR array to study effects of chemicals on the hypothalamic pituitary gonadal axis of the Japanese medaka [J]. Aquatic Toxicology, 2008, 88(3): 173-182
[31] Nelson E R, Habibi H R. Functional significance of nuclear estrogen receptor subtypes in the liver of goldfish [J]. Endocrinology, 2010, 151(4): 1668-1676
[32] Babin P J, Carnevali O, Lubzens E, et al. Molecular Aspects of Oocyte Vitellogenesis in Fish [M]. Babin P J, Cerd J, Lubzens E. The Fish Oocyte. Nieuwerkerk: Springer, 2007: 39-76
[33] Bonofiglio D, Gabriele S, Aquila S, et al. Estrogen receptor alpha binds to peroxisome proliferator-activated receptor response element and negatively interferes with peroxisome proliferator-activated receptor gamma signaling in breast cancer cells [J]. Clinical Cancer Research, 2005, 11(17): 6139-6147
◆
Endocrine-DisruptingEffectsofDEHPandMEHPonOryziasmelastigmaunderLong-termExposure
Ye Ting, Kang Mei, Huang Qiansheng#, Dong Sijun*
Key Lab of Urban Environment and Health, Institute of Urban Environment, Chinese Academy of Sciences, Xiamen 361021, China
22 July 2013accepted27 September 2013PublisheddateinCNKIdatabases26 November 2013
To study the endocrine-disrupting effects and mechanisms of long-term exposure to di(2-ethylhexyl) phthalate (DEHP) and mono (2-ethylhexyl) phthalate (MEHP) on marine aquatic organisms, Oryzias melastigma (one week post hatching) were exposed to DEHP (0.1 mg L-1and 0.5 mg L-1) and MEHP (0.1 mg L-1and 0.5 mg L-1) respectively for 6 months. The results showed that the hepatosomatic index (HSI) of female and male medaka increased after exposure to DEHP. In contrast, the HSI of male fish increased significantly only after exposure to higher dose of MEHP (0.5 mg L-1). The mRNA levels of hepatic estrogen related genes including estrogen receptor (α, β, γ), vitellogenin (VTG1, VTG2), choriogenin (ChgL, ChgH) were significantly up-regulated in female medaka after exposure to DEHP. In male fish, only the expression of hepatic ERβ was significantly up-regulated after exposure to DEHP. In contrast, exposure to MEHP had no significant influence on the expression of VTG and Chg genes both for female and male. DEHP activated hepatic PPARα and PPARγ in both sexes, while only lower dose of MEHP (0.1 mg·L-1) augmented the expression of hepatic PPARγ in male. The expression of the VTG and Chg was significantly correlated to expression of the ERα and ERγ in both female and male liver. Moreover, significant correlations were observed between the expression of ER and PPAR. Thus, it is proposed that endocrine-disrupting effects on marine medaka could be regulated through hepatic estrogenic responsive genes (VTG and Chg) and peroxisome proliferator-activated receptor (PPARα and PPARγ) after long-term exposure to DEHP, and the effect is sex-specific. MEHP showed weaker endocrine disrupting activity on marine medaka in comparison with that of DEHP.
Oryzias melastigma; di(2-ethylhexyl) phthalate (DEHP); mono(2-ethylhexyl)phthalate (MEHP); estrogen receptor (ER); vitellogenin (VTG); choriogenin (Chg); peroxisome proliferator-activated receptor (PPAR)
國家自然科學基金(21277137,21107107,21207127);福建省自然科學基金(2011J05117)
葉婷(1988-),女,學士,主要研究方向為環(huán)境分子毒理學,E-mail:tye@iue.ac.cn;
*通訊作者:(Corresponding author),E-mail:sjdong@iue.ac.cn;
#共同通訊作者(Co-corresponding author),E-mail:qshuang@iue.ac.cn
10.7524/AJE.1673-5897.20130722001 優(yōu)先出版網址:www. cnki. net/kcms/detail/11. 5470. x. 20131126. 2123. 001. html
葉婷,康美,董四君, 等. 鄰苯二甲酸二(2-乙基)己酯(DEHP)和鄰苯二甲酸單乙基己基酯(MEHP)長期暴露對海洋青鳉(Oryzias melastigma)內分泌干擾效應的評價[J]. 生態(tài)毒理學報, 2014, 9(2): 253-260
Ye T, Kang M, Dong S J, et al. Endocrine-disrupting effects of DEHP and MEHP on Oryzias melastigma under long-term exposure [J]. Asian Journal of Ecotoxicology, 2014, 9(2): 253-260 (in Chinese)
2013-07-22錄用日期2013-09-27 < class="emphasis_bold">網絡出版日期
日期:2013-11-26
1673-5897(2014)2-253-08
X171.5
A
董四君(1966—),男,博士,研究員,研究方向為環(huán)境分子毒理、環(huán)境防衛(wèi)醫(yī)學和天然活性物質在健康領域的應用。
黃乾生(1982—),男,博士,副研究員,研究方向為環(huán)境分子毒理學。

