多系統萎縮68例臨床特征分析
程 鋒,張博愛
(鄭州大學第一附屬醫院神經內科 河南鄭州 450052)
多系統萎縮(multiple system atrophy,MSA)是一組病因不詳,成年期發病,進行性的多個系統受累的神經變性疾病,臨床表型主要有自主神經功能障礙、帕金森綜合征、小腦性共濟失調和錐體系統功能障礙等。MSA目前診斷主要分為兩個亞型:以帕金森綜合征為突出表現稱為MSA-P亞型及以小腦性共濟失調為突出表現稱為MSA-C亞型。而自主神經功能障礙在各亞型均有表現。鑒于該病臨床癥狀較復雜,現對鄭州大學第一附屬醫院神經內科收治的68例擬診MSA患者的臨床特點進行回顧性分析,并結合文獻復習,提高對該病臨床診斷的認識。
1 對象和方法
1.1 對象 收集鄭州大學第一附屬醫院神經內科2010年1月至2013年6月收治的68例患者,發病年齡為45~70歲,平均年齡(58.3±8.5)歲。發病至確診時間1 ~10.0 a,平均(4.9 ±3.8)a。本組患者均為成年人(>30歲)、緩慢進展、散發的病例。
1.2 方法 經詳細詢問病史、系統體格檢查及行頭顱MRI檢查、臥立位血壓測定等輔助檢查。依據2008年Gilman等[1]提出的MSA診斷標準,可將該病臨床表現分為MSA-C和 MSA-P兩個亞型。以符合“擬診MSA”的標準收集病例資料,記錄并分析各病例的臨床特點及輔助檢查等資料。
2 結果
2.1 臨床特征 本組研究中68例MSA患者中MSAP亞型23例(33.8%),MSA-C 亞型 45例(66.2%)。其中57例自主神經功能障礙存在于MSA-P亞型及MSA-C亞型中,分別占有 18例(78.3%)、39例(86.7%)。MSA-P亞型及MSA-C亞型主要臨床癥狀及主要體征見表1、表2。
2.2 頭顱磁共振成像(MRI)檢查 本研究中68例患者均行MRI檢查,其中90%以上MSA患者MRI存在異常改變。現收集MSA-P亞型23例,MSA-C亞型45例,以T2信號改變的典型特征匯總見表3。
本研究MSA患者MRI的T2信號改變除了發現MSA典型特征:殼核背外側條帶樣低信號、外側緣裂隙樣高信號、小腦萎縮、小腦中腳高信號、腦橋基底部“十字征”,還發現延髓腹側面萎縮,側腦室、第三腦室、第四腦室、橋延池、枕大池等不同程度擴大,這些改變多在MSA晚期發現。其中2例發現大腦皮質萎縮,表現為癡呆樣癥狀,3例表現為雙側額頂葉白質脫髓鞘,基底節區缺血灶。
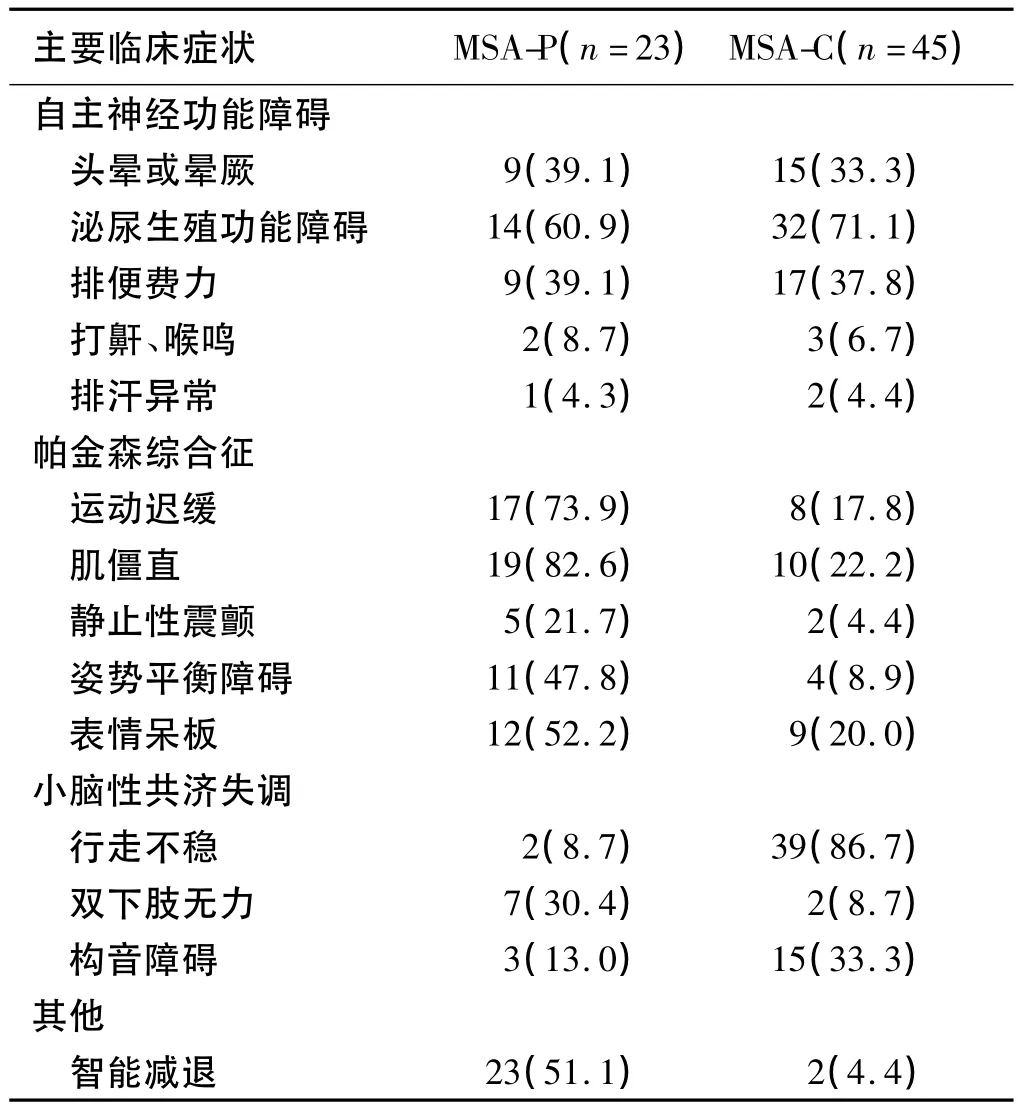
表1 MSA-C亞型與MSA-P亞型的主要臨床癥狀[n,(%)]
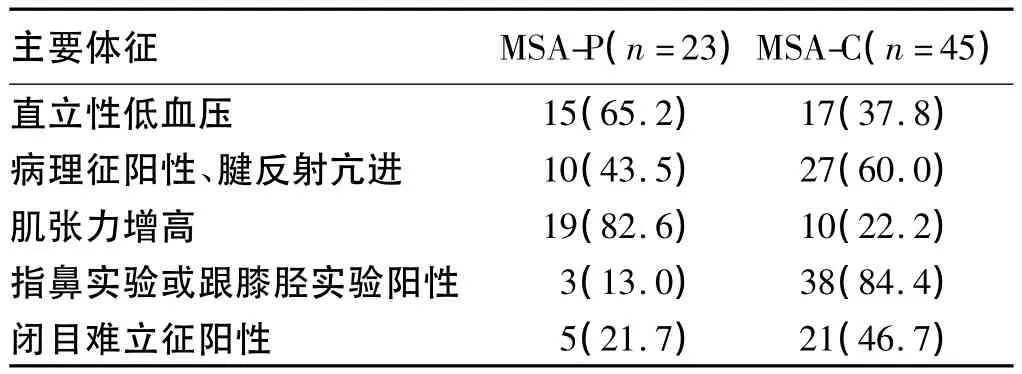
表2 MSA-C和MSA-P兩亞型的主要體征[n,(%)]

表3 MSA-P亞型與MSA-C亞型MRI的T2信號改變典型特征[n,(%)]
3 討論
MSA為一種發病原因尚不明確的進行性神經多系統變性疾病,其確診必要條件是靠病理組織學在神經膠質細胞漿內發現嗜酸性包涵體,其包涵體核心成分為α-突觸蛋白,其他病理改變還有發現小腦蒲肯野細胞脫失和殼核膠質細胞增生、神經元減少等。患者主要出現錐體外系統、小腦系統、自主神經系統、錐體系統損害等癥狀,部分患者還會出現認知功能障礙等。
3.1 臨床表現 根據2008年Gilman等修訂的MSA診斷標準,認為MSA為散發的、進展性、大于30歲的成人發病的神經變性疾病,其臨床特征主要包括:①自主神經功能障礙:本研究中自主神經功能障礙57例(83.8%),其中46例(67.6%)表現泌尿生殖功能障礙。文獻研究報道MSA患者出現自主神經功能障礙癥狀中泌尿功能異常發生率較高,占55% ~96%[2]。MSA患者自主神經功能障礙常發生在錐體外系或小腦受累癥狀之前或者伴行,這有利于早期MSA與單純自主神經功能障礙(PAF)的鑒別。吸氣性喘鳴、手足涼、新發或進展性打鼾等癥狀是MSA紅旗征[3]的組成部分,對于早期出現這些癥狀可能進展為MSA的患者,應予以重視。②帕金森綜合征:本研究中MSA-P亞型患者23例(33.8%)。本研究中未發現帕金森病典型的“搓丸”樣震顫,且MSA-P亞型大部分患者長期治療中對左旋多巴反應差,部分短期治療有效。MSA患者并無進行性核上性麻痹(PSP)的垂直性核上性凝視麻痹及明顯的垂直掃視緩慢癥狀,臨床上可行水平和垂直性眼動分析鑒別二者。③小腦性共濟失調:在本研究中MSA-C亞型占66.1%,其中行走不穩最常見,占總數60.3%。該臨床表現多從雙下肢開始,體格檢查可發現下肢受累較重的小腦病損體征,但當合并錐體外系和錐體束癥狀時常干擾對小腦體征的發現。該亞型中小腦受累癥狀需與多種遺傳性和非遺傳性小腦共濟失調相鑒別,Geser等[4]提出該亞型若在4 a內出現自主神經功能障礙或帕金森綜合征,易與其他特發性小腦共濟失調鑒別。④其他癥狀:本研究中2例出現智能減退,符合Kim等[5]報道的MSA患者癡呆,主要表現為注意力、視空間功能、語言功能下降,影像學上發現患者腦皮質厚度減少。
3.2 輔助檢查 根據MSA診斷標準可知確診MSA需病理學上證實,鑒于當前國內各種原因限制尚不能完成,普遍以MRI為主要輔助手段,并借以其他輔助手段以達到診斷目的。本研究中MSA患者行MRI檢查主要出現T2WI殼核萎縮、外側緣裂隙樣高信號、小腦中腳高信號、小腦萎縮及腦橋基底部“十字征”。隨著臨床研究進展,新的MRI技術也涌現出來。根據文獻報道,MR平面測量、結構體積測量、磁化傳遞成像(MTI)、彌散加權成像(DWI)、擴散張量成像(DTI)、磁敏感加權成像(SWI)、磁共振波譜(MRS)已廣泛應用到對MSA的鑒別與診斷,并得到研究驗證[6]。Mat等[7]研究發現在3.0TMRI的T1加權成像中運用比率(SLC-SPT)/SPT,其中SLC代表藍斑的信號強度,SPT代表腦橋背側部的信號強度,MSA患者藍斑信號強度比率明顯低于PD,且藍斑的信號強度比率可以作為一個生物標記用來評估MSA的病程進展程度。
3.3 治療及預后 目前MSA尚無特效治療方法,該病進展快,平均病程為8~9 a,多數預后不良,現治療主要針對延緩病情進展,多采用保護及營養神經、對癥支持治療、康復鍛煉等綜合治療方法。近期文獻研究報道伴發呼吸睡眠暫停綜合征的MSA患者,可使用佐匹克隆或褪黑激素作為替代氯硝西泮減少治療風險[8]。有研究者提出運用中醫辨證與辨病相結合方法治療MSA,但只能改善部分癥狀,長期的療效仍需進一步探索研究[9]。目前干細胞移植技術已應用于治療MSA患者,但治療效果仍處于臨床觀察階段。近期文獻研究報道應用免疫球蛋白治療MSA患者獲得一定的效果,但樣本量少,我們仍需要大量研究給予驗證[10]。
本研究采用回顧性研究分析,收集的病例資料的完整性及準確性可能存在局限性,但仍能反映當前MSA患者的臨床特征。通過對以往及近期的文獻查閱,發現對MSA患者的診斷,不管是診斷標準還是診斷技術、輔助工具都在不斷的更新。這些新技術和新標準為我們對MSA的認識和診斷提供依據。由于該病累及多個系統,臨床表現復雜多樣,對其治療效果都不理想,因此對其早期臨床表現準確診斷,并早治療能夠延緩該病進展。近期涌現一批利用干細胞移植技術及免疫球蛋白等技術治療MSA患者,并取得一定的療效。若這些技術獲得大量的臨床研究驗證,將不失為臨床治療MSA的一次突破。
[1]Gilman S,Wenning G K,Low P A.Second consensus statement on the diagnosis of multiple system atrophy[J].Neurology,2008,71(9):670-676.
[2]王珧,張穎冬.多系統萎縮的自主神經功能表現研究進展[J].國際神經病學神經外科學雜志,2012,39(4):339-343.
[3]Hensperger M,Geser F,Seppi K,et al.Red flags for multiple system atrophy[J].Mov Disord,2008,23(8):1093-1099.
[4]Geser F,wenning G K,Seppi K,et al.Progression of multiple system atrophy(MSA):aprospectivenalural history by the European MSA study Group(EMSA SG)[J].Mov Disord,2006,21(2):179-186.
[5]Kim H J,Jeon B S,Kim Y E.Clinical and imaging characteristics of dementia in multiple system atrophy[J].Parkinsonism Relat Disord,2013,19(6):617-621.
[6]向小爽,孫占芳,鄺嵐瓊.多系統萎縮影像學研究進展[J].中華臨床醫師雜志,2012,6(7):87-89.
[7]Matsuura K,Maeda M,Yata K.Neuromelanin magnetic resonance imaging in parkinson’s disease and multiple system atrophy[J].Eur Neurol,2013,70(2):70-77.
[8]Ferini-Strambi L,Marelli S.Sleep dysfunction in multiple system atrophy[J].Curr Treat Options Neurol,2012,14(5):464-473.
[9]顧衛紅.多系統萎縮的診斷與治療[J].中國現代神經疾病雜志,2012,12(3):257-260.
[10]Novak P,Williams A,Ravin P.Treatment of multiple system atrophy using intravenous immunoglobulin[J].BMC Neurol,2012,12(1):131-137.

