基于吲哚半花菁結構的比值式p H熒光探針
曾 科,周彬彬,龍一國
(1.中南大學化學化工學院,湖南長沙 410083;2.湖南省食品質量監督檢驗研究院,湖南長沙 410000)
具有類花菁染料結構的化合物具有優越的光譜性能[1-3],當前已被廣泛應用于生物標記[4-5]、熒光成像[6-8]、靶向治療等[9]諸多領域。同時,由于該類分子的光譜性能對周圍環境的變化異常敏感,也常被用于研究溶劑極性性質[10-11]。基于花菁類染料對周圍化學環境敏感這一特點[12],目前,采用該結構并將其應用于溶液pH值檢測的工作少有報道[13]。顯然,合理設計花菁染料并研究其pH響應過程對該類分子的環境敏感行為研究具有重要意義。
本文設計合成了一種吲哚類半花菁探針,研究了該探針隨pH值變化而產生的光譜性質改變以及其分子結構的影響,并研究了其細胞毒性,希望能為該類染料在生物領域進一步應用提供參考。
1 實驗部分
1.1 試劑與儀器
二甲基亞砜、苯肼、3-甲基-2-丁酮、對羥基苯甲醛均為分析純。
F4600熒光分光光度計;UV-2450紫外-可見分光光度計;Bio-TeK ELx800型酶聯免疫檢測儀。
1.2 實驗方法
探針的合成路線如下:
1-乙基-2-[2-(4-羥基苯基)-乙烯基]-3,3-二甲基吲哚氫碘化物(CyP)

1.2.1 A的合成 將5 mL苯肼和15 mL 3-甲基-2-丁酮加至100 mL圓底燒瓶中,再加入冰醋酸25 mL,加熱,120℃回流反應5 h。將反應溶液倒入約100 g碎冰中,靜置于-20℃冰箱中2 h,取出,倒入分液漏斗,用二氯甲烷萃取,用飽和的氯化鈉溶液洗滌,用無水硫酸鈉干燥,旋蒸除去有機溶劑,用少量二氯甲烷溶解固體產物,用柱層析提純,以石油醚/乙酸乙酯(v/v)=6∶1的混合溶劑作為淋洗液,45℃旋轉蒸發除去淋洗液,得到中間產物A,產率80%。
1.2.2 B的合成 將4 g中間產物A和9 g碘乙烷溶于約60 mL無水乙腈中,加熱回流過夜。將反應溶液冷卻至室溫,有固體析出,旋蒸除去乙腈,固體用乙酸乙酯淋洗,除去未反應的雜質,得到白色固體B。
1.2.3 CyP的合成 將0.2 g的中間產物 B和0.55 mmol對羥基苯甲醛溶于約20 mL無水乙醇中,氮氣保護下加熱回流12 h。旋蒸除去乙醇,用少量二氯甲烷溶解得到固體產物,用柱層析提純,以二氯甲烷/甲醇(v/v)=10∶1的混合溶劑作為淋洗液,得到探針 CyP。1H NMR(500 MHz,DMSO)δ10.88(1H,s),8.42(1H,d,J=16.1),8.16(2 H,d,J=8.8),7.89 ~7.85(2H,m),7.64 ~7.56(2H,m),7.48(1H,d,J=16.1),6.97(2H,d,J=8.8),4.66(2H,q,J=7.2),1.78(6H,s),1.43(3H,s)。
1.3 工作溶液的配制
稱取適量的探針CyP,溶于二甲亞砜(DMSO)中,配制成濃度為25 mmol/L的儲存液。將適量儲存液加入到濃度為10 mmol/L的不同pH值的緩沖溶液(pH為3~6,檸檬酸-檸檬酸鈉緩沖溶液;pH為6~9,磷酸二氫鈉-磷酸氫二鈉緩沖溶液;pH為9~10.5,碳酸氫鈉-碳酸氫鈉緩沖溶液)中,得到DMSO含量5%(v/v),CyP探針濃度為10μmol/L的工作溶液,用于紫外-可見吸收光譜和熒光發射光譜的測定。
1.4 干擾金屬陽離子的溶液配制
在10 mmol/L,pH=5.6 的檸檬酸-檸檬酸鈉緩沖溶液中,分別配制金屬離子濃度為20 mmol/L(NaCl,KCl)和 50 μmol/L(MgCl2,CaCl2,Zn(NO3)2,CuCl2,AgNO3,BaCl3,SnCl2)的測試溶液,用于離子干擾實驗的熒光光譜測定。
1.5 細胞毒性實驗
采用四唑鹽比色法 (MTT法),對CyP探針的體外細胞毒性進行研究。
(1)收集對數生長期的HeLa細胞株,用0.25%胰蛋白酶進行消化,取每孔100μL接種于96孔培養板上,調整細胞懸浮液濃度至5×103cells/孔。置于37℃、5%CO2培養箱中過夜。
(2)含CyP的培養液的配制:用含有胎牛血清的DMEM培養液配制一系列不同濃度的含CyP的培養液。待細胞貼壁后,吸棄舊的培養液,向每孔100μL含CyP的培養液,每個濃度設5個復孔,同時設置只加培養液的調零孔和只加細胞懸浮液、不加CyP的對照孔。CyP設有6個濃度梯度,分別為0.1,0.5,5,10,50,150 μmol/L。繼續培養 48 h,并在倒置顯微鏡下觀察細胞形態。達到指定的培養時間后,每孔加入含有MTT且濃度為5 mg/mL的培養液200μL,再向每個孔中加入100μL的DMSO,溶解紫色結晶。用Bio-TeK ELx800型的酶聯免疫檢測儀測定各孔的吸光度OD,選490 nm為測定波長,以635 nm作為參考波長,重復測3次。以不加CyP的細胞作為對照組,計算不同CyP濃度組的細胞生長存活率。
2 結果與討論
2.1 探針溶液紫外-可見吸收光譜分析
探針溶液紫外-可見吸收光譜分析,見圖1。
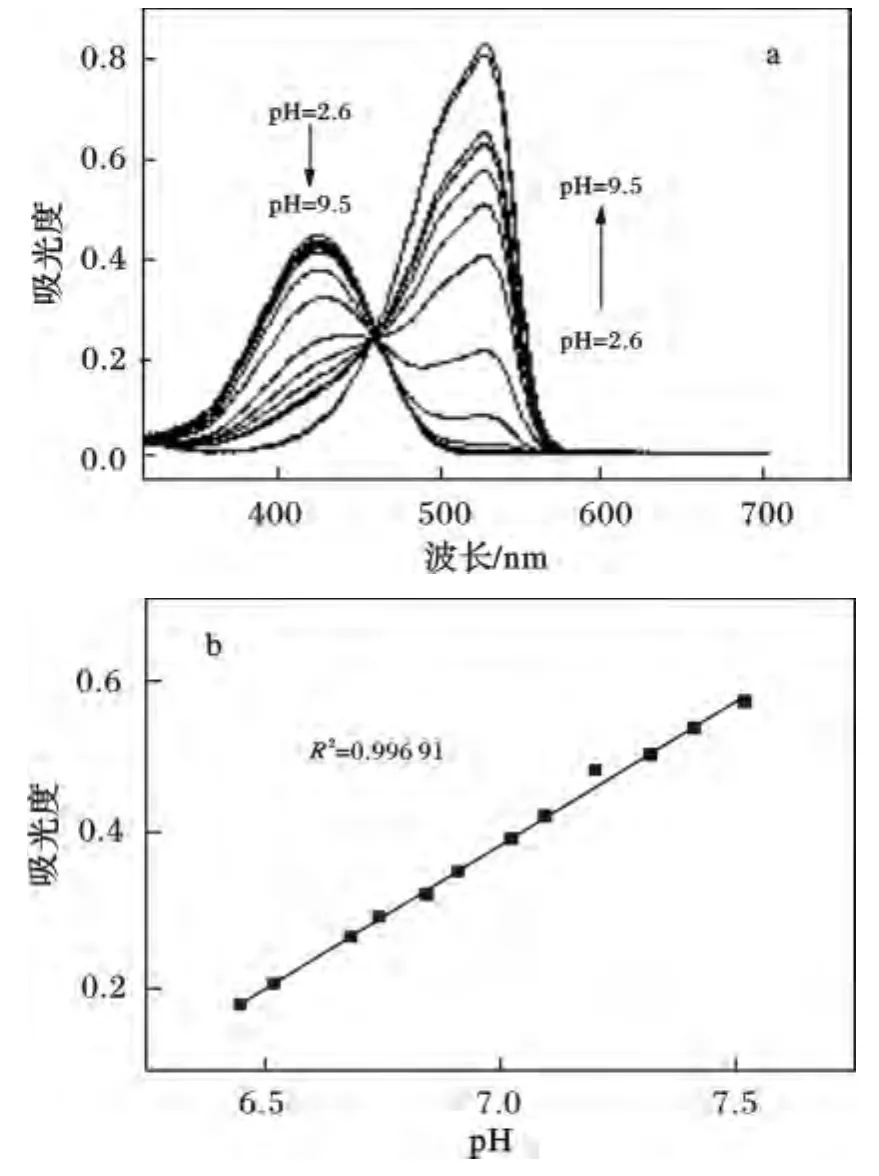
圖1 在DMSO/緩沖溶液(DMSO 5%,v/v)中,探針的紫外吸收光譜Fig.1 UV-Vis absorption spectra with pH increase from 2.6 to 9.5
由圖1可知,在較低pH情況下(pH <5),探針溶液的紫外吸收光譜僅在422 nm處有吸收峰,當pH逐漸增大(pH >5),該處吸收峰的強度逐漸降低,同時在525 nm處出現新的吸收峰,隨著pH增大,525 nm處吸收峰值逐漸增大,當 pH=9.5時,525 nm處吸收峰達到最大值。同時,探針溶液在457 nm處有等吸收點,意味著探針在酸堿環境下,存在著兩種狀態的平衡。整個變化過程紫外光譜出現了明顯的紅移(約100 nm),所以當pH由5上升至8時,溶液的顏色由亮黃色轉變為橙色,最終變為紅色,且變化非常明顯。這意味著該探針同時具有裸眼檢測的潛在應用價值。
2.2 探針熒光光譜的分析及其p K a值計算
當波長為430 nm激發光激發時,探針在pH4.8~8.4范圍內的熒光發射光譜見圖2。

圖2 在DMSO/緩沖溶液(DMSO 5%,v/v)中,探針的熒光發射光譜(λex=430 nm)Fig.2 Fluorescence emission spectra with pH increase from 4.8 to 8.4(λex=430 nm)
由圖2可知,隨著pH升高,513 nm處熒光發射峰強度逐漸下降,至pH=8.4時完全消失,同時在550~560 nm處熒光發射峰逐漸上升。取兩熒光峰513 nm處的熒光強度與553 nm處的熒光強度的比值(I513nm/I553nm),考察其與pH的關系,發現在pH 5.4~7.2 范圍內,I513nm/I553nm的值與 pH 值有良好的線性關系(見圖 2,R2=0.990 23),說明在 pH 5.4~7.2范圍內可以通過513 nm與553 nm熒光強度的比值檢測溶液的pH。
波長為520 nm激發光激發時,熒光發射光譜見圖3,當pH <4.3時,探針溶液無明顯的熒光發射峰,當pH >4.3時,在560 nm處出現明顯的熒光發射峰,隨著pH增大,發射峰強度明顯增大,至pH=8時達到最大值。根據亨德森-哈塞爾巴爾赫方程,通過對不同pH值下560 nm處發射峰強度的計算,得出該探針溶液的p Ka值約為6.25(見圖3C)。同時探針在pH 6.0~7.2范圍內560 nm處峰強度與pH值有較好的線性關系。
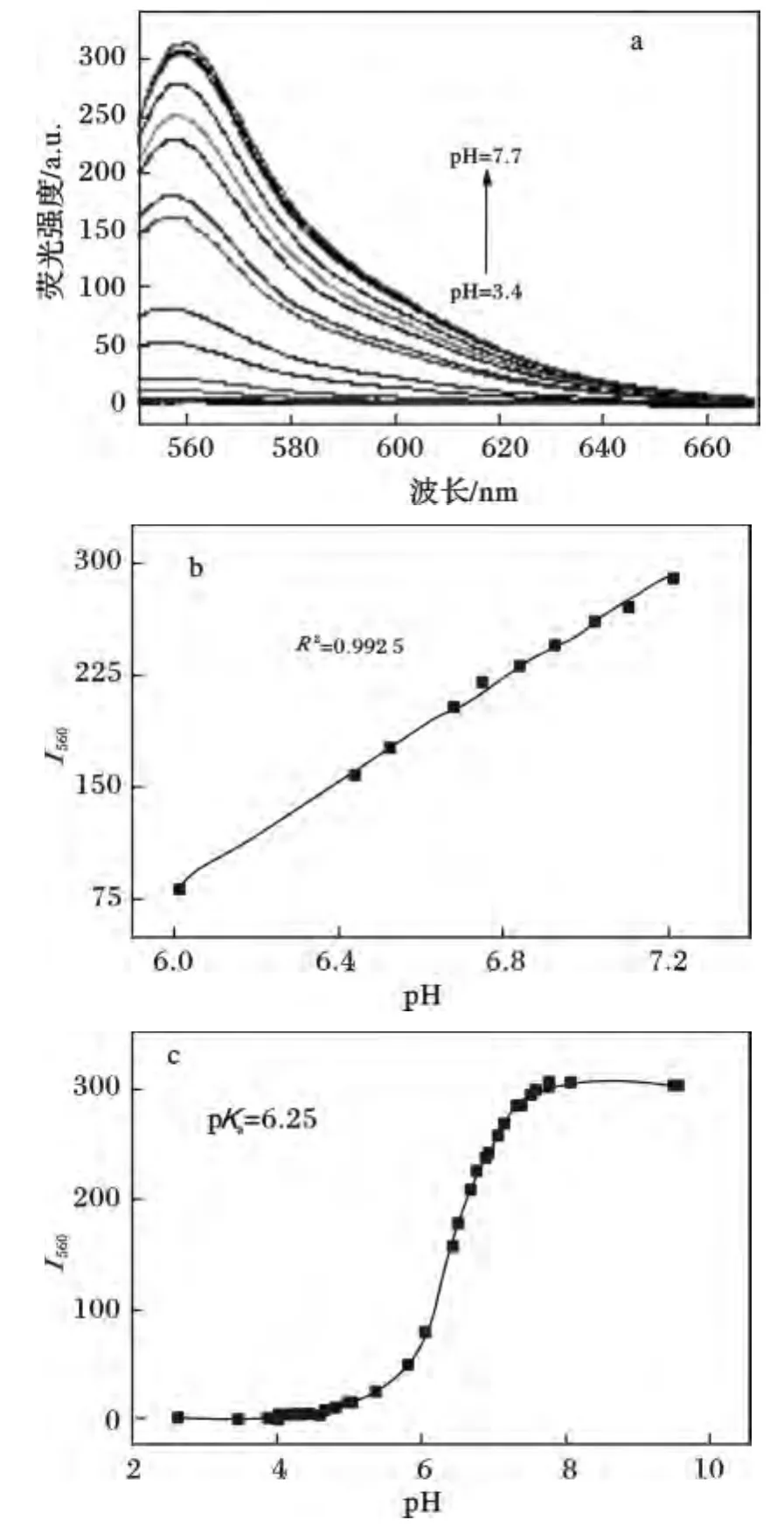
圖3 在DMSO/緩沖溶液(DMSO 5%,v/v)中,探針的熒光發射光譜(λex=520 nm)Fig.3 Fluorescence emission spectra with pH increase from 3.4 to 7.7(λex=520 nm)
2.3 探針的選擇性分析
選取常見金屬離子作為干擾物質進行檢測分析。待測陽離子種類及濃度為 Na+,K+(50 mmol/L),Mg2+、Ca2+、Zn2+、Cu2+、Ag+、Ba2+、Sn2+(50 μmol/L),緩沖液 pH=5.4,結果見圖4。

圖4 探針對常見陽離子的選擇性Fig.4 Selectivity of the probe for common cation
由圖4可知,在相同pH情況下,不同陽離子的加入,對探針I513nm/I553nm熒光強度的比值基本無影響,說明該探針可在不同的離子環境下對pH的變化進行檢測。
2.4 探針的細胞毒性分析
為了進一步驗證該探針具有在生物體內檢測pH值的可能,我們首先對探針的細胞毒性進行了研究,將不同濃度的探針與HeLa細胞培養48 h,結果見圖5。
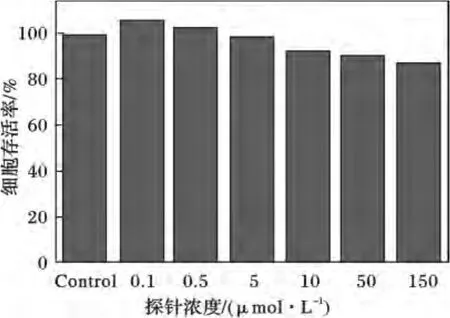
圖5 探針與HeLa細胞培養48 h的細胞存活率Fig.5 Cell viability of probe against HeLa cells at various probe concentration after 48 h
由圖5可知,隨著探針濃度的增加,HeLa細胞的存活率略微下降,當培養濃度遠大于工作濃度時(100μmol/L),細胞存活率仍大于80%,說明該探針具有較高的生物相容性,對細胞的毒副作用較小。因此,該探針具有較好的體內應用價值。
2.5 檢測機理討論
該探針的檢測機理見圖6,當pH <4.3時,探針分子中的酚羥基處于未解離狀態,此時分子骨架整體電子云極化度較小,呈現強度較弱的短波長熒光發射,當pH >4.3時,探針分子中的酚羥基氫發生解離,結構變為酚氧負離子,該結構具有很強的供電能力,與吲哚環上的正電荷構成D-π-A結構,此時分子骨架整體電子云極化度變大,產生ICT效應,使得分子熒光發射光譜向長波長移動,波長560 nm處出現明顯的熒光發射峰。隨著pH值升高,溶液中電離的分子比例加大,至pH=8時,全部電離,該處熒光發射峰強度達到最大值。同時,溶液的顏色由酸性條件下的亮黃色轉變為橙色,最終變為堿性條件下的紅色。
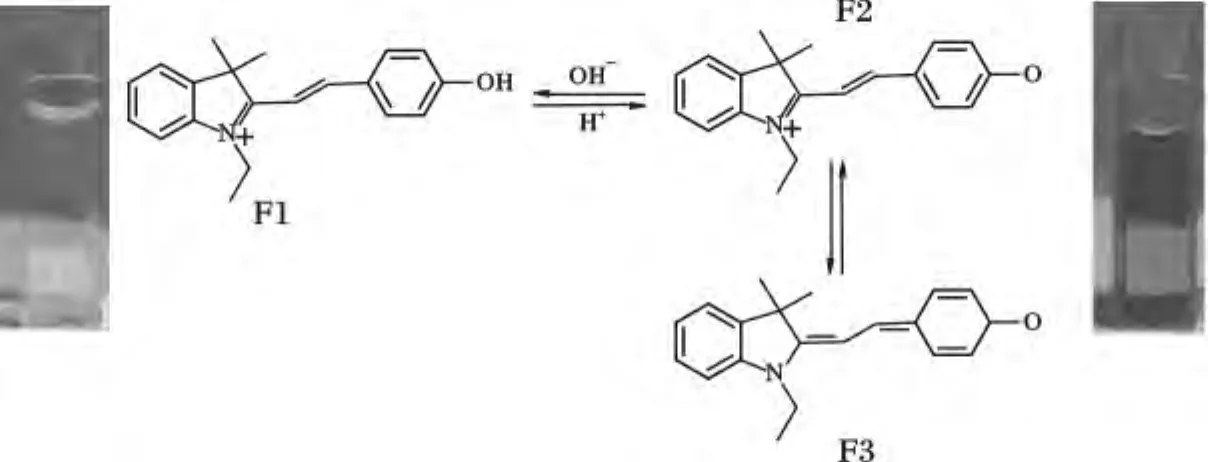
圖6 探針檢測機理及不同pH下的溶液顏色對比Fig.6 Detection mechanism of CyP and the color change at different pH
為進一步驗證反應的pH響應機制,采用密度泛函理論對實驗結果進行了初步模擬計算。對化合物在酸性條件下存在形式(F1型結構)及其堿性條件下存在形式(F2型結構)進行了優化,其優化的結構表明相比F1的羥基結構,F2的酚氧負離子結構更易于異構化為吸收及發射光譜波長較長的酮式結構F3。結構F1的HOMO和LUMO軌道能級均較結構F3低,且其能級差小于結構F3(見表1),這種趨勢與光譜波長的移動是一致的。從C—O鍵的鍵長方面比較,在結構F1中,C—O鍵長高于結構F3中的C—O鍵長,說明結構F3中電荷分布更為均勻,能級更低。
由此,我們認為在pH較高的條件下,結構F1容易失去質子變為酚氧負離子,同時,發生異構化,轉變為吸收及發射光譜波長較長的酮式結構F3(見圖7)。這一過程導致了不同pH條件下的光譜差異。

表1 F1,F3結構的密度泛函理論計算結果(HOMO,LUMO及C—O鍵長)Table 1 Result of DFT with HOMO,LUMO and C—O bond length
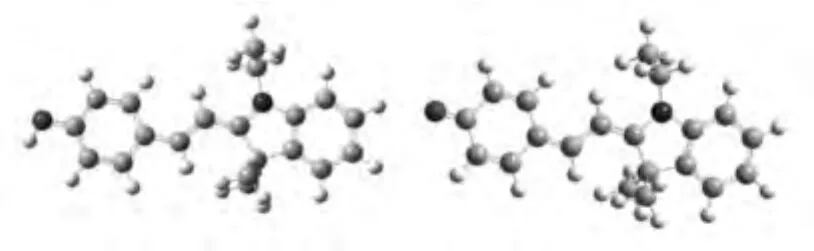
圖7 探針的密度泛函理論優化分子結構(左F1,右F3)Fig.7 DFT optimized structures of CyP F1(phenol configuration,left),F3(enol configuration,right)
3 結論
設計合成了一種用于檢測pH值的比值式熒光探針,研究了探針在溶液中隨pH值變化所產生的紫外-可見吸收光譜和熒光發射光譜變化,當激發波長為430 nm時,其發射峰強度的比值I513nm/I553nm的變化與pH值(pH 5.4~7.2)具有良好的線性關系,且探針溶液的顏色隨pH值變化有明顯改變,并對探針的響應機理進行了理論計算和探討。同時對探針的細胞毒性進行了研究,發現探針在工作濃度下具有較低細胞毒性的特性。因此該探針有進一步應用于體內檢測生物體內pH值的潛在應用價值。
[1] Greville Williams C.Researches on chinoline and its homologues[J].Transactions of the Royal Society of Edinburgh,1857,21(3):377-401.
[2] Zholt Kormosh,Yaroslav Bazel,Andriy Tolmachov.The state and chemical analytical properties of certain polymethine dyes in aqueous solutions[J].Acta Chimica Slovenica,2002,49:795-804.
[3] 陳秀英.新型3H吲哚熒光菁染料的合成與性能研究[D].大連:大連理工大學,2006:62-76.
[4] Stefka Kaloyanova,Ivo Crnolatac,Nedyalko Lesev,et al.Synthesis and study of nucleic acids interactions of novel monomethine cyanine dyes[J].Dyes and Pigments,2012,92(3):1184-1191.
[5] 費學寧,劉麗娟,張寶蓮,等.熒光染料探針分子對變異細胞的識別[J].化學進展,2006,18(6):801-807.
[6] Jorge O Escobedo,Oleksandr Rusin,Soojin Lim,et al.NIR dyes for bioimaging applications[J].Current Opinion in Chemical Biology,2010,14:64-70.
[7] 施峰,李宏洋,彭孝軍.生物分析用近紅外熒光染料研究進展[J].精細化工,2003,20(5):268-272.
[8] Lin Yuan,Lin Weiying,Zheng Kaibo,et al.Far-red to near infrared analyte-responsive fluorescent probes based on organic fluorophore platforms for fluorescence imaging[J].Chemical Society Reviews,2013,42:622-661.
[9] Maged Henary,Andrew Levitz.Synthesis and applications of unsymmetrical carbocyanine dyes[J].Dyes and Pigments,2013,99:1107-1116.
[10] Cunderlíková B,ikurová L.Solvent effects on photophysical properties of merocyanine 540[J].Chemical Physics,2001,263:415-422.
[11] John OMorley,Richard M Morley,Robert Docherty,et al.Fundamental studies on Brooker’s merocyanine[J].Journal of American Chemical Society,1997,119:10192-10202.
[12] Andérs-Bello A,Barreto-Palacios V,García-Segovia P,et al.Effect of pH on color and texture of food products[J].Food Engineering Reviews,2013,5:158-170.
[13] Zeng Lintao,Fan Ne,Zha Jiayu.A novel and photostable pH probe for selectively staining nucleus in living cells[J].Analyst,2013,138:7083-7086.

