《醫療器械生產質量管理規范》實施難點及對策
■ 馬利田
北京市順義區食品藥品監督管理局
《醫療器械生產質量管理規范》(簡稱《規范》)于2011年1月1日正式實施,這給醫療器械生產企業帶來了發展機遇,也帶來挑戰。醫療器械生產企業推行《規范》的難點有哪些?食品藥品監督管理部門如何引導、幫助企業貫徹實施《規范》的要求?前不久,筆者就此對北京市順義區11家無菌、植入企業進行了調查。其中,骨科植入企業2家,無菌企業9家,有產品注冊證的骨科植入企業1家,有產品注冊證的無菌企業4家。
1 人員參與度有待提高
調查發現,無《醫療器械產品注冊證》的企業,只是滿足許可需要,大多只有質量管理人員和技術人員(如附表),看似管理人員比例很高,但只是用于研發或試生產。《醫療器械生產質量管理規范》的實施是全員參與的過程,《規范》中有很多驗證和確認要求等工作,不可能僅靠質量管理人員和技術人員將工作全部完成,必須配備合理工作人員,與企業質量管理人員、技術人員共同參與,才能實現醫療器械質量全面管理。
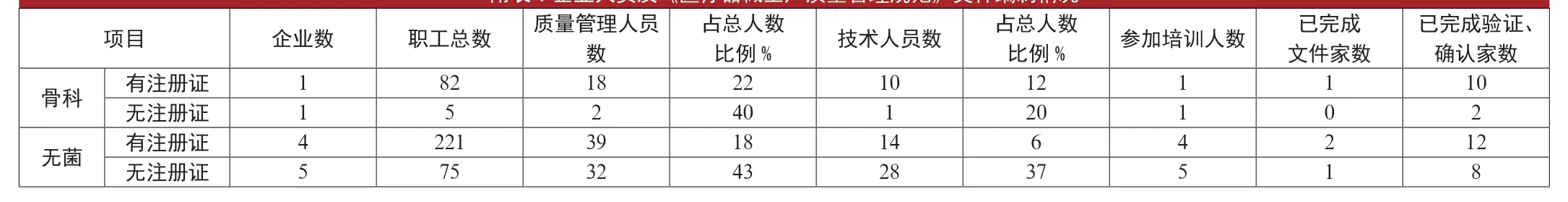
附表:企業人員及《醫療器械生產質量管理規范》文件編制情況
2 管理體系多不健全
骨科生產企業從開辦到產品注冊必需通過《外科植入物生產實施細則》,文件編制較為系統,具有較規范的體系管理文件,管理體系較為健全;有產品注冊證的無菌生產企業為拓寬產品市場,有2家企業已通過CE認證(第三方認證),有一定通過《規范》的基礎,但大多數無菌生產企業,管理體系不是很健全,體系文件不規范,通過《醫療器械生產質量管理規范》有很大難度。
3 大多已完成檢驗條件改造
順義區醫療器械生產企業起步較晚,生產、檢驗水平相對較低,很多企業為降低生產成本采取部分生產委托加工或委托檢驗,《規范》的實施對醫療器械生產能力、檢驗水平都是嚴峻的考驗。調查顯示,除按《規范》標準新審批的醫療器械生產企業外,老的醫療器械生產企業全部需要增加生產設備、檢驗設備,以滿足《醫療器械生產質量管理規范》的要求。骨科植入企業和無菌企業原檢驗條件較差,不能滿足《規范》的要求,大多需要進行無菌間、無菌實驗室、微生物室和陽性對照室改造,除4家外,其他企業已完成改造工作。
4 管理規范文件的編制及驗證和確認成難題
《規范》中文件的編制以及各種驗證和確認是一個系統工程,需要企業投入大量的精力才能完成。從附表可以看出,通過質量管理規范的企業和有產品注冊證的企業大多完成《醫療器械生產質量管理規范》文件的編制工作,無產品注冊證的企業只有少部分完成文件編制,更重要的驗證、確認工作完成的很少,即便是通過的企業,其驗證、確認工作開展得也不理想。調查顯示,多數企業不知道如何制定方案,如何開展驗證、確認,驗證、確認數據如何收集,如何編制驗證、確認報告,驗證和確認成了醫療器械生產企業通過質量管理規范的最大難題。
通過走訪,北京市順義區食品藥品監督管理局基本掌握了醫療器械生產企業在推進《規范》過程中遇到的難點問題。就此筆者認為,應針對不同的驗證、確認開展培訓,特別是方案制定方法、數據統計分析、報告格式和具備的要件等內容,使企業全面掌握驗證、確認系統方法,使驗證、確認工作不只是一種形式,使《規范》在企業管理中發揮應有的作用。

