我國新修訂GMP認證的現狀、困境及對策研究
顏建周,邵 蓉
(中國藥科大學醫藥產業發展研究中心,江蘇南京211198)
為解決1998年修訂的GMP在實施過程中遇到的諸多問題,歷經5年論證、兩次公開征求意見的《藥品生產質量管理規范(2010年修訂)》于2011年3月1日起正式開始施行。2010年GMP的修訂屬于對原有GMP的轉型升級,相比1998年修訂的GMP,新修訂GMP崇尚“軟硬件并重”的原則,參照歐盟標準制定,在吸收國際先進經驗并結合我國國情的基礎上,貫徹質量風險管理和藥品生產全過程管理的理念,更加注重科學性,強調指導性和可操作性,對我國醫藥行業的轉型發展具有重要意義。
新修訂GMP在認證高度上達到了WHO的GMP水準,大致相當于歐盟GMP標準。該標準的提升在增強我國醫藥產業的國際競爭力、提高醫藥“中國制造”的國際認可度等方面勢必會起到積極的作用,但與此同時較大的認證壓力也是當前擺在我國制藥企業和GMP認證檢查隊伍面前的現實問題。本文通過分析當前GMP認證的進展現狀、認證過程中所面臨的困境并結合我國國情提出相應的政策建議,試圖為我國GMP認證的順利實施提供理論參考和決策支持,真正實現我國藥品質量管理理念、技術、標準與國際的統一。
1 我國2010年新修訂GMP認證現狀分析
自2011年3月1日我國開始受理藥品生產企業新修訂GMP的認證申請起,新修訂GMP已經正式實施三年多,我國GMP認證工作已經取得了一定成效,但當前的認證壓力依然巨大,按時完成所有企業新一輪GMP改造的前景不容樂觀。
1.1 無菌藥品生產企業未能如期完成GMP認證改造 考慮到血液制品、疫苗、注射劑等無菌藥品的生產要求較高、風險較大,為保障相關產品生產過程的控制,在本輪GMP認證中我國要求所有藥品生產企業血液制品、疫苗、注射劑等無菌藥品的生產應在2013年12月31日前達到《藥品生產質量管理規范(2010年修訂)》要求。
然而新版GMP的一個突出特點是對于軟件建設和無菌藥品的生產要求明顯提高,無菌藥品生產企業的改造和認證壓力較大,認證進展較為緩慢。在截止日期將近的2013年7月通過新修訂GMP認證的藥品生產企業僅為342家(其中核發456張證書),占無菌藥品生產企業總數的25.9%①,通過比例僅為四分之一。在最終截止日2013年12月31日,也僅有796家無菌藥品生產企業全部或部分車間通過新修訂藥品GMP認證,占全國無菌藥品生產企業的60.3%②。這意味著仍然有近四成的無菌藥品生產企業未能如期完成2010年修訂GMP的改造工作,將面臨強制停產的局面。
1.2 全面通過2010年修訂GMP認證的壓力十分巨大 截止至2014年4月,我國實施新修訂GMP認證的時間已經超過36個月,占據總體認證時間57個月(2011年3月至2015年12月)的63.2%。當前,我國已經累計核發GMP認證證書2 883張,相比于19 086張按照1998年修訂藥品GMP認證證書的總量,按照目前認證速度,至2015年底,所有藥品生產企業高質量完成新版GMP認證的壓力十分巨大。
具體到各省,如表1所示,以我國藥品生產企業數量排名前十的省份為統計對象,目前為止,在納入統計的十個省份中,認證進度排名前列的山東省和江蘇省通過或部分通過GMP認證的企業比例為44.01%和42.15%,部分省份通過率不足20%,認證形勢較為嚴峻。
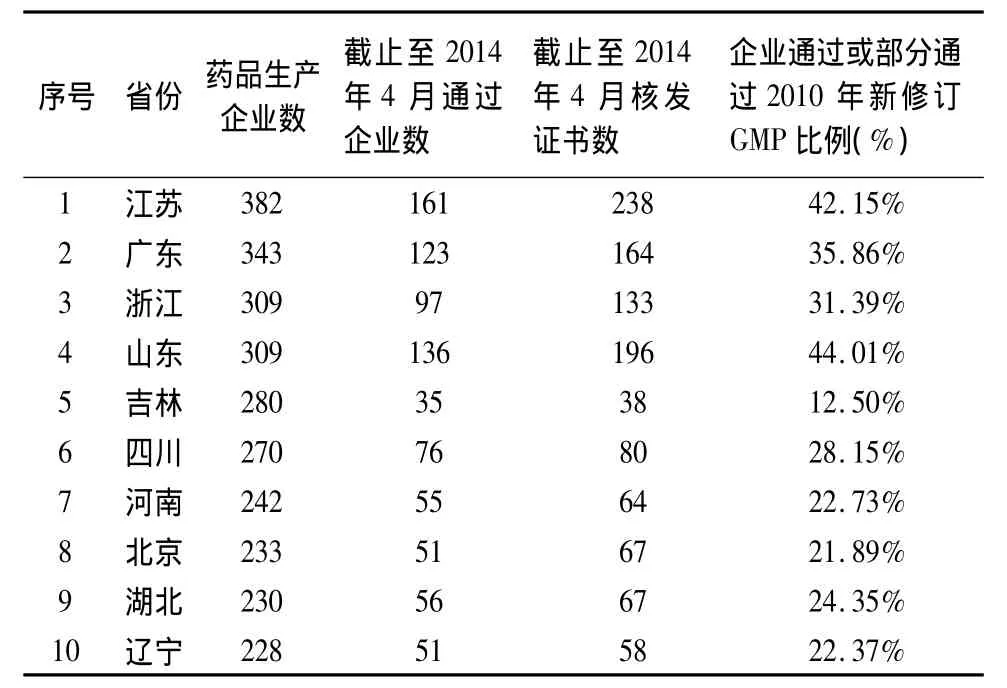
表1 我國藥品生產企業數量排名前10的省份新修訂GMP認證情況表
2 當前我國新修訂GMP認證過程中所面臨的困境分析
2.1 企業對GMP改造認識不到位,存在集中扎堆認證隱患 新修訂GMP吸收采納歐盟GMP的部分規定,與國際標準對接,是對企業生產水平的硬性提高,是提高產品質量,增強企業競爭力的有效途徑。而國內部分企業對新版GMP的認識不到位,認為新修訂GMP是一道障礙,企業只要“跨過去”即可。這種觀念導致部分企業目前對于GMP認證仍然存在“盼、望、等”的心態。
回顧歷史,我們不難發現在分階段強制實施1998年修訂GMP的過程中就曾經遇到企業對GMP認證持觀望態度的突出問題。雖然藥品監管部門規定自2004年7月1日起,凡未取得相應劑型和類別“藥品GMP證書”的藥品制劑和原料藥生產企業(或車間),一律停止其生產。但是截至2003年年底,在全國4 979家藥品生產企業中僅有2 355家企業通過了GMP認證,通過比例僅為47%。這種消極應對認證的心態極易造成認證截止日前的企業集中扎堆申請認證,給藥品監督管理部門的GMP認證工作帶來巨大的壓力,也勢必會影響到認證工作的進度和質量。
2.2 成本壓力是我國GMP轉型升級過程中無法回避的問題
2.2.1 硬件投入方面的成本 雖然本次GMP的轉型升級更多的是關注軟件方面的改進升級,并不會出現之前將GMP認證單純等同于硬件改造的現象,但是與軟件相配套的硬件設施的改進升級同樣是一筆不小的開銷。根據國家食品藥品監督管理局的預測,新修訂GMP的實施將淘汰全國至少500~1000家經營乏力的中小企業,合規企業在硬件投入就需300億至500億元,相當于每年投入60億至100億元,平均到每家藥品生產企業的投入為600萬元~1 000萬元。我國制藥企業中營業收入不足5 000萬元的中小企業占70%以上,大部分醫藥中小制造企業的銷售額都未滿1億元[1]。照此測算,本次按新修訂GMP改造的費用將相當于中小型藥品生產企業2至3年的經營利潤,而且認證后企業的生產運行成本也是一筆不容忽視的支出。
2.2.2 軟件管理方面的成本 在軟件管理方面,新修訂GMP對質量管理的標準大幅提升,勢必會帶來管理費用和人員培訓等方面成本的提高。在質量管理費用方面,根據不完全統計,新一輪改造升級后這方面的成本增加將超過600%~800%;在人力資源成本方面,現有人員的人力成本將提高30% ~100%,新標準導致企業新聘質量管理人員增加一倍,人力成本將在原有基礎上增加260%~400%[2]。對于那些已經承擔了較高改造費用的中小企業而言,如何應對GMP改造后激增的日常管理費用將是擺在企業管理層面前的另一個巨大挑戰。
2.3 融資渠道受限增加了企業順利通過GMP認證的難度 目前國內藥品生產企業融資渠道有自有資金和生產經營過程中的資金積累等內源融資渠道以及股權融資[首次上市募集資金(IPO)、配股和增發等]、銀行貸款、政府資助等外源融資渠道[3]。其中大部分企業以自有資金和銀行貸款為主要融資渠道。但是我國大部分藥品生產企業為中小型企業,規模有限,利潤低,企業自有資金儲備少,亦沒有達到上市的要求。與此同時,金融機構為規避信貸風險,給企業貸款提出更多的限制條件。雖然我國政府對醫藥產業的投入逐年加大,但仍然不能從源頭解決企業的資金短缺問題,這些客觀市場因素導致了藥品生產企業融資渠道的受限,無形中增加了進行GMP認證改造的難度。
2.4 GMP認證的配套實施機制仍有待健全
2.4.1 專職GMP檢查員隊伍建設亟需加強 與歐美等發達國家擁有專職的GMP檢查員隊伍相比,我國現有GMP檢查員大多為兼職檢查員,平時從事藥品行政監督或技術監督崗位工作,如食品藥品監督管理局、藥檢所等。部分GMP檢查員在實施認證前,針對GMP認證理論與實務研究的時間和精力投入有限,缺乏在藥品生產企業生產和質量管理經驗。這些制約因素影響了部分檢查員在認證檢查過程中對GMP認證情況的認定與評價。考慮到GMP檢查員除了需要掌握制藥工藝、設備、工程建設、微生物檢查、藥物分析、統計學等核心理論知識以外,還需熟悉企業的生產實踐,具有非常高的專業化、復合化屬性,為提高當前GMP認證工作效率和質量,搭建一支專業理論知識扎實、實踐檢查經驗豐富的專職GMP檢查員隊伍刻不容緩。
2.4.2 藥品生產企業的退出機制尚不健全 為鼓勵在新修訂GMP認證過程中藥品生產企業的兼并重組、資源整合,2012年12月國家食品藥品監督管理局、國家發展改革委、工業和信息化部、衛生部四部委聯合發布的《關于加快實施新修訂藥品生產質量管理規范促進醫藥產業升級有關問題的通知》規定,對于無力承擔新修訂GMP認證并主動放棄全廠或部分劑型生產改造的藥品生產企業,可按照要求,將其現有藥品技術在規定期限內轉讓給已通過新修訂藥品GMP認證的企業。該規定為藥品生產企業提供了較好的退出路徑,但在企業退出程序、退出企業人員再就業等具體操作層面缺乏對淘汰出局企業的妥善安置和規范,未能切實解決未通過GMP認證企業的跟蹤、轉型、并購等問題,導致大量企業仍然對是否主動退出市場存有大量后顧之憂,面臨進退維谷的尷尬局面。
3 典型省份推進新修訂GMP認證工作的先進經驗
面對在新修訂GMP認證過程中遇到的困境,我國各個省份為推進新修訂GMP的認證工作出臺了一系列改革制度。筆者梳理并總結了其中實施效果較好的典型省份在新修訂GMP認證工作中的先進經驗,試圖為提出推進我國新修訂GMP認證的政策建議提供實踐依據。
3.1 以山東省為代表的GMP認證激勵制度 為了充分發揮市場機制對企業開展新修訂GMP認證的激勵作用,突顯已通過新修訂GMP認證企業在藥品招標采購中的競爭優勢,提高相關企業的經濟效益。山東省在2013年9月公布的《山東省2013年國家基本藥物集中采購文件》中明確將通過新修訂GMP納入招標采購經濟技術標評標體系,占據經濟技術標評分中100分的15分,其重要性不言而喻。山東省在推進GMP認證工作中采取的這一激勵制度取得了良好的認證效果,在被納入統計的10大重點省份中山東省藥品生產企業的新修訂GMP認證比例高居榜首(表1),為其他省份認證工作的推進提供了很好的經驗借鑒。
3.2 以陜西省為代表的信貸支持政策 為了給藥品生產企業GMP改造創造一個良好的資金環境,確保省內藥品生產企業的產業升級不受資金短缺困擾,2013年陜西省藥監局與多家銀行簽署了戰略合作協議。根據經營情況、品種結構、誠信記錄等綜合指標遴選優秀藥品生產企業,并通過推薦銀行為藥品生產企業提供信用額度的方式,扶持陜西省醫藥產業發展升級。
3.3 以北京為代表的專職GMP檢查員隊伍建設為了優化GMP檢查員隊伍的人員組成,提高檢查員隊伍的綜合認證、檢查能力。北京在總結歐美等發達國家經驗的基礎上,由北京市藥品認證管理中心建立了一支經驗豐富、專業知識過硬的專職GMP檢查員隊伍,平均每個檢查員每年從事現場檢查約100天以上。專業化檢查員隊伍的設置在提高認證工作效率的同時,也降低了藥品生產企業的質量風險。
4 推進我國新修訂GMP認證的政策建議
新修訂GMP認證工作的順利推進需要企業和監管部門的共同努力,針對我國GMP認證的現狀及面臨困境,結合典型省份的先進經驗,筆者分別從企業、監管部門等層面提出以下幾點政策建議,力求為我國GMP認證工作的順利實施提供理論參考和決策支持。
4.1 積極轉變企業GMP認證觀念,以質量贏得市場 企業是藥品安全質量的第一責任人,是實施GMP的主體。當前我國已經為通過新修訂GMP認證的企業創造了良好的制度環境,企業可以順應時代的發展,將通過GMP認證變成提升自身競爭優勢、鞏固市場地位的良好契機。2013年國務院辦公廳《關于鞏固完善基本藥物制度和基層運行新機制的意見》中明確要求將新版GMP認證作為質量評價的重點;2012年12月國家食品藥品監督管理局等四部委聯合發布的《關于加快實施新修訂藥品生產質量管理規范促進醫藥產業升級有關問題的通知》也強調如果有通過新修訂藥品GMP認證生產企業的產品參與投標,其他未通過新修訂藥品GMP認證企業的同種產品,不再進入商務標評審階段。在這樣的制度環境下,山東、湖南、吉林和寧夏等省份已經明確將通過新修訂GMP認證作為質量打分中的加分項。隨著相關制度在全國的廣泛推廣,通過GMP認證為企業帶來的經濟效益將日趨顯著,企業也應當審時度勢,積極轉變被動認證為主動認證,以質量贏得市場。
4.2 開拓融資新渠道,保證資金來源 為了順利實施GMP認證并緩解由此引起的資金壓力,制藥企業應該開拓融資新渠道,嘗試新的融資方式,構建多層次的融資方案,保證企業資金鏈正常運轉。一方面,企業可以結合當地金融市場的發展情況,選擇銀行保理融資、面向銀行的倉單質押融資、私募融資、知識產權質押融資、國內產業基金、風險投資機構、并購等多種方式籌措資金。另一方面,政府可以通過設置企業創新科研基金、給予財稅政策優惠、適當減稅或者免稅、提高所得稅的起征點、減少應征額以及與金融機構簽署了戰略合作協議,鼓勵其為藥品生產企業發放貸款等方式積極鼓勵企業開展新修訂GMP的認證工作。
4.3 設置專職的GMP檢查員隊伍 針對當前我國現有的GMP檢查員遴選、培訓和獎懲機制均為兼職檢查員而設立的局面,建議國家食品藥品監督管理總局切實發布關于建立專職檢查員隊伍的文件規范,使各省專職檢查員隊伍的建設有章可循。在專職檢查員的遴選過程中,可借鑒歐盟和美國的經驗,只要滿足一名GMP檢查員所需的學歷、資質、培訓經驗和職業操守,都可考慮錄用。而在遴選原則上,不僅需考慮遴選者的藥品監督管理經驗,還可以要求人員在理解藥品管理法和GMP規范時,具備一定的藥品生產質量管理經驗,以更好實施現場檢查工作。實施檢查認證后,采取有效的獎懲機制,適當提高認證人員的津貼標準、提供GMP認證國際交流的機會等,而對未能很好履行檢查職責的人員進行追責。
4.4 健全藥品生產企業退出的善后安置機制 在引導藥品生產企業理性退出醫藥產業的同時,做好善后工作,加強對轉型、并購、改組、退出企業員工安置工作的關注度。鼓勵企業對員工技能進行評估,結合生產實踐對員工進行分類管理,妥善安排;完善社會保障制度,做好流動員工的社會保險的銜接工作,督促企業處理拖欠職工的各項債務,補繳欠繳的各項社會保險費用。在此基礎上,本著針對性強、收費低、社會需求量大的原則,組織安排不同內容、不同層次的職業教育培訓,加大從業性培訓和崗位適應性培訓的比重,鼓勵職工自主選擇就業方向,實現再就業。
注釋:
① 數據來源:國家食品藥品監督管理總局辦公廳關于無菌藥品通過新修訂藥品GMP認證情況的通報(食藥監辦藥化監〔2013〕54號),2013年8月12日。
② 數據來源:國家食品藥品監督管理總局GMP認證統計數據庫。
[1]丁胄,曹陽.醫藥行業并購環境及特點分析[J].2011,32(7):345-347.
[2]梁毅.新版GMP的主要變化與對制藥企業的影響[J].機電信息,2011(11):12 -15.
[3]李建.我國醫藥企業融資的重要渠道:產權市場[J].中國醫藥技術與管理.2007,1(2):75-58.

