調查我國與美歐藥物不良反應監測水平對比
■ 本刊記者 袁昊緒
藥品在獲得批準上市之前,均要經過包括實驗室研究、動物實驗、臨床試驗等一系列的上市前研究和廣泛的審查與批準程序。在這個過程中會發現一些不 良 反 應(Adverse Drug Reaction),但由于在研發過程中的各種原因,特別是臨床試驗病例局限性的限制,一個藥品上市后往往會被發現新的不良反應,如特定人群服用后出現其他身體損害,甚至藥物對適應癥沒有預期療效等情況,這些問題會對患者的生命健康造成嚴重威脅。因此,藥品上市后不良反應監測和再評價就顯得十分重要。我國在藥物不良反應監測與藥品上市后再評價機制較美國、加拿大、歐盟及英國的情況如何?本刊記者調查統計了2012年以來美國、加拿大、歐盟及英國與我國對出現嚴重不良反應藥物的處理情況。調查統計顯示,在藥物不良反應監測與上市后再評價方面我國與美國、加拿大、歐盟及英國差距很大。以治療高膽固醇血癥的他汀類藥物為例,歐盟、美國早在2011年12月14日和2012年2月28日就已經通知他汀類藥品生產廠家,要求其更改說明書內容。而我國于2012年12月14日才發布警戒訊息,與歐美發達國家相比整整晚了一年。而這一年的時間里,不知道多少患者因他汀類藥物的不良反應受到了健康威脅,甚至是傷害。
美歐發達國家的藥品審查注冊與不良反應監測
藥物被定義為可以通過影響身體結構或功能而被用來診斷、治療或預防疾病的產品。在美國,如果一種新藥由實驗室最初測試到被FDA批準一般需要8~10年的時間,經歷早期測試、動物實驗、試驗用新藥申請(Investigational New Drug Application)、 臨 床 試 驗、新藥申請(New Drug Application)和新藥上市后的監測六個階段。這其中比較重要的是試驗用新藥申請、臨床試驗和新藥申請。在實驗室與動物研究結果令人滿意的情況下,藥物制造商可以作為申請者向FDA提交“試驗用新藥申請”,該申請需要總結實驗室及動物試驗信息,并為獲得人類患者臨床數據提供一項方案。
如果FDA批準“試驗用新藥申請”,那么臨床試驗(由人類受試者參與的研究)就可以開始了。臨床試驗分為Ⅰ期、Ⅱ期和Ⅲ期。參與Ⅰ期臨床試驗的受試者通常不超過100人,重點是考察藥物的安全性,受試者一般為健康志愿者;參與Ⅱ期臨床試驗的受試者有數百人,重點是考察藥物最佳用藥劑量及治療特定疾病或病癥的能力,受試者一般為患有該種疾病或病癥的患者;Ⅲ期臨床試驗最為關鍵,要求受試者人數達到數千人,重點是考察藥物的安全性和有效性,通常將試驗藥物與安慰劑(如一種惰性糖片)或一種已經被批準對這種疾病有療效的藥物進行對比,以檢查更深入的問題,如試驗藥物對某些患者人群的不良反應和副作用。臨床試驗結束之后,藥物申請者可提交一份“新藥申請”,申請批準這款藥物在美國銷售。FDA對非常重要的“新藥申請”在6個月內進行審評,標準的審評時間是10個月。最后如果FDA決定批準這款藥物,制造商需要編寫該藥物的正式說明書,包括描述該藥物用來治療何種疾病或病癥,以及已知的副作用和服用警告。
新藥就算通過注冊,上市后也隨時會受到藥品安全監督委員會(DSOB)的不良反應監測。美國在其《聯邦食品、藥品與化妝品法案》中早已提出“上市后研究(postmarketing study,即臨床IV期研究)”,并在1997年實施的《FDA1997年現代化法案》(簡稱《現代化法案》)第I編第130(a)條新增了上市后研究的規定,要求已批準的藥物和生物制劑申辦者每年向FDA報告其上市后的研究進展。2001年2月27日開始實施現行的上市后研究法規(Postmarketing Studies for Approved Human Drug and Licensed Biological Products)。《FDA 修改法案2007》第901條“人用藥上市后研究與臨床試驗(postmarket study and clinical trial);風險評估和降低策略”對上市后研究與臨床試驗、風險評估與降低策略方面作出了詳細規定。在藥品上市前后,新藥試驗申辦者都可與FDA就是否進行上市后研究進行協商。
在美國,藥品不良反應報告收集主要依賴兩大體系,即企業的強制報告系統和MedWatch的自愿報告系統。FDA將報告信息形成一個公開的數據庫,設在其官方網站上,可供公眾搜索和查詢。FDA將有意義的不良反應定義為任何非預期、非故意、不希望有的或過度的藥物反應導致的以下情況:①須停藥(包括治療用和診斷用);②須改變藥物治療方案;③須調整劑量;④須入院治療;⑤延長住院時間;⑥須支持性治療;⑦診斷明顯復雜化;⑧對預后產生消極影響;⑨暫時性或永久性的傷害、致殘或致死。根據此定義,過敏反應(免疫系統對藥物產生異常敏感帶來的結果)和特異質反應(某些個體所特有的對藥物的異常敏感性)也包含其中。
FDA為了獲得藥品上市前試驗未能發現的罕見、潛在或長期的藥品不良反應,要求研發、生產企業在新藥上市后前3年的每個季度都要提交定期報告。藥品安全監督委員會在對這些報告和數據的分析整合基礎上發布藥品安全信息,提醒藥品生產企業、醫務工作者以及公眾注意。FDA對收集到的不良反應信息,通過再評價等方式后通常采取這些措施:①醫療警告,向醫生、藥師、經營單位發警告信,提醒注意該藥品不良反應并采取措施避免不良發應的發生;②說明書修改,FDA要求制藥商在藥品說明書上加入新的不良反應信息;③方框警示,在藥品包裝顯著位置用方框形式注明警告,提醒醫生不要忽視;④撤銷上市,對多次發生嚴重不良反應的藥品,FDA經過反復評估認為如果風險已經大于收益,就會要求藥品退出市場。
企業強制報告系統和MedWatch系統是兩個平行的系統。FDA如果發現醫生或患者通過MedWatch系統上報的不良反應在企業強制系統中未上報,就會去調查企業為什么沒有上報,要求企業給出具體而詳細的說明,美國制藥公司在如此壓力下自然對不良反應報告很積極,有意識地減少漏報、瞞報。因此,不良反應監測在美國成了企業和醫療機構自覺自愿的工作。美國對于不上報不良反應者的處罰力度相當大,將其歸為犯罪行為,對公司和個人都進行處罰,可以警告、罰款,嚴重的甚至可判處若干年監禁。2012年6月,強生公司就因隱瞞藥物風險被罰款11億美元。
美國FDA對于藥品監測是十分系統和嚴格的。例如2014年1月14日,FDA發布信息,建議停止處方和銷售含對乙酰氨基酚超過325mg的處方藥。因為過量使用對乙酰氨基酚,可引起肝毒性反應,甚至可導致肝衰竭和死亡。對乙酰氨基酚是一種緩解疼痛和退熱的藥物,除單方外,還多與其他藥物制成復方制劑。在美國,有數百種非處方藥(OTC)和處方藥中都含有這一成分。其中與鎮咳、減鼻充血、抗過敏藥物組成的復方制劑多為非處方藥,用于治療感冒引起的癥狀,如泰諾;與阿片類鎮痛藥或鎮靜催眠藥組成的復方制劑多為處方藥,用于緩解中度至重度疼痛,包括癌性疼痛、術后疼痛、偏頭痛等,如氨酚待因、氨酚羥考酮等。FDA上述措施只針對處方藥,不包括市場上用于治療感冒等疾病的非處方藥。采取此措施主要是基于對超量使用、誤用或重復用藥導致對乙酰氨基酚藥物過量,以及在服用含對乙酰氨基酚藥物時飲酒而產生的擔憂。限制最高藥物劑量可以幫助減少因對乙酰氨基酚過量導致的肝損害風險。美國FDA還同時強調,如必要,使用上述藥品時可一次服用2片(粒或其他劑量單位),總量650mg,每日不超過4g。
加拿大的藥品監測機制與美國FDA有許多的共通之處。例如2014年3月26日加拿大衛生部發布警示信息,使用嘌呤拮抗劑硫唑嘌呤或巰嘌呤可導致肝脾T-細胞淋巴瘤(HSTCL)的發生。硫唑嘌呤被批準用于治療成人類風濕性關節炎和輔助預防腎移植排斥,巰嘌呤被批準用于治療白血病。肝脾T-細胞淋巴瘤(HSTCL)是一種罕見的、侵襲性并常致命性癌癥。至2013年11月30日,加拿大衛生部共收到2例使用巰嘌呤時發生的HSTCL病例(其中1例死亡)和4例使用硫唑嘌呤時發生的HSTCL嚴重病例(其中3例死亡)。
作為歐洲藥品監督管理的最高機構,歐洲藥品管理局(EMA)的藥品監測也是最為嚴格的。例如2014年4月,EMA警戒風險評估委員會(PRAC)完成了對含多潘立酮藥物的一項評估工作,建議在全歐盟(EU)范圍內變更其使用適應癥,主要包括限制這些藥物僅用于緩解惡心和嘔吐癥狀、在兒童使用中限制劑量并根據體重謹慎調整劑量。自20世紀70年代以來,含多潘立酮的藥物已在歐盟的各成員國范圍內得到上市許可,并作為非處方藥或處方藥廣泛銷售。用于治療各種原因引起的惡心和嘔吐(在部分成員國中包括兒童),同時還可用于治療脹氣、不適和燒心等癥狀。PRAC建議含多潘立酮的藥物可繼續上市,并可在歐盟繼續用于治療惡心和嘔吐癥狀,但建議在成人和體重超過35kg的青少年中將劑量減小至10mg,每日最多3次口服給藥。還可以給這些患者30mg栓劑每日2次的藥物治療。在用于體重小于35kg的兒童和青少年時,應以每千克體重0.25mg的劑量口服給藥,每日最多3次。在采用液體劑型時應使用測量設備以便能根據體重精確給藥。正常情況下,含多潘立酮的藥物的使用不應超過1周,PRAC認為減少推薦劑量和降低使用療程是多潘立酮風險最小化的關鍵措施。
英國藥品和健康產品管理局(MHRA)在2014年4月發布的《藥物安全更新》(Drug Safety Update)中警示,在腫瘤壞死因子-α抑制劑(TNF-α)治療期間,結核病或潛伏性結核病重新激活的風險增加,并可能導致死亡。
我國藥物不良反應監測及上市后再評價差距明顯
與此對應,我國的藥物不良反應監測又做得如何?據記者不完全統計,我國自2012年以來,國家食品藥品監督管理局(2013年升格為總局)一共公布了11種西藥的限制、更新說明書,具體藥品見附表5。
從表中可以看出,我國的藥品不良反應監測和歐美相比還有明顯的差距,就此記者采訪了某業內資深人士。該資深人士表示,我國的用藥人群與用藥量巨大,是歐美等國相加的數倍,本應能及時發現更多的藥物不良反應,但為什么不能及時發現呢?這是因為,我國的藥品不良反應監測一直處于起步的狀態,這么多年沒有明顯變化,仍停留在消滅零報告和統計報告數的基礎層面上,而對每例藥物不良反應報告進行調查、研究還遠遠沒有成為藥物不良反應監測的主要工作,這也是我國為什么每年公布的對上市藥品的諸如警告、修改說明書、撤銷文號等措施那么少,并且即使采取了措施也不能排除是參考了歐美的處理決定而不是由自己的數據來決定的。
究其深層次原因,該資深人士認為,一是我國醫生用藥水平低。由于我國醫生在學習和工作中較少關注自身藥學知識的提高,固難以發現藥物不良反應。本刊2006年1月刊登的《暗訪京城50家醫院醫師用藥水平狀況》一文顯示,當記者拿著可以引起不良反應的三組“問題處方”:辛伐他汀與(羅)紅霉素、二甲雙胍與氫氯噻嗪、左氧氟沙星與硫酸亞鐵前往北京50家二、三級醫院暗訪開藥時,“問題處方”的開出率高達94%,并有83.3%的醫師在開出“問題處方”時無任何醫囑。
二是零售藥店的藥物不良反應監測幾乎為零。我國的零售藥店目前仍游離于醫療保障體系之外,即便有大量的患者在那里買藥,也不會留下任何可以跟蹤服藥后情況的聯系方式。再加上藥店的執業藥師的藥學水平整體不高,甚至很多藥店根本沒有執業藥師,何談藥物不良反應監測。
三是國人不良的“濫用藥”習慣。按說“濫用藥”會導致藥品的不良反應例數很多,但是由于公眾整體的醫學、藥學知識匱乏,吃藥就像吃零食一樣,不認為藥品會給身體帶來危害。
四是外國不良廠商裝聾作啞。因為我國的藥品不良監測水平較低,所以很多國際藥品生產廠家采取“合理”避法手段,只要我國食藥監部門沒有提出,他們就會故意隱瞞那些在國外已經被勒令更新說明書甚至退市的藥品,前幾年發生的“息斯敏事件”就是很好的例子。
五是我國廠商利益為大。在我國市場上銷售的化學藥,其原研者基本為歐美生產廠家,我國制藥企業絕大多數生產的是在該藥品的專利權過期后加工的仿制藥。這些制藥企業只會追求商品利益的最大化,不會投入經費去進行藥品的基礎研究,比如藥理、藥效和藥動學、工藝、輔料等等,更不會去研究藥物的不良反應發生機理。
六是對藥害事件懲罰措施與賠償機制不健全。藥品出現了嚴重不良反應,很多廠家私了了事。沒有懲罰措施及藥害賠償機制,生產廠家就不會重視對不良反應的收集與研究。
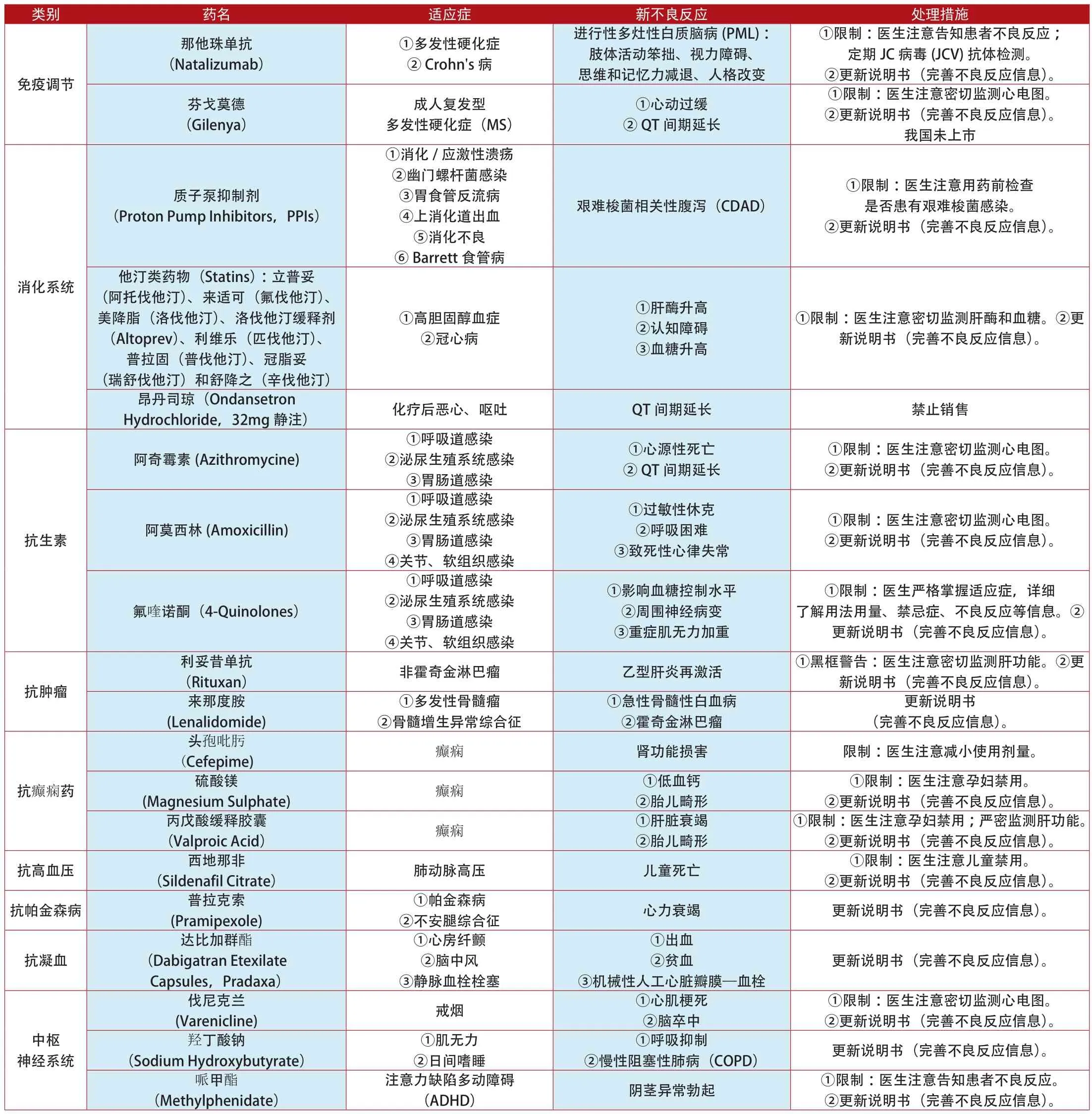
附表1:2012年1月~2014年7月美國更新說明書和禁止銷售的上市藥品
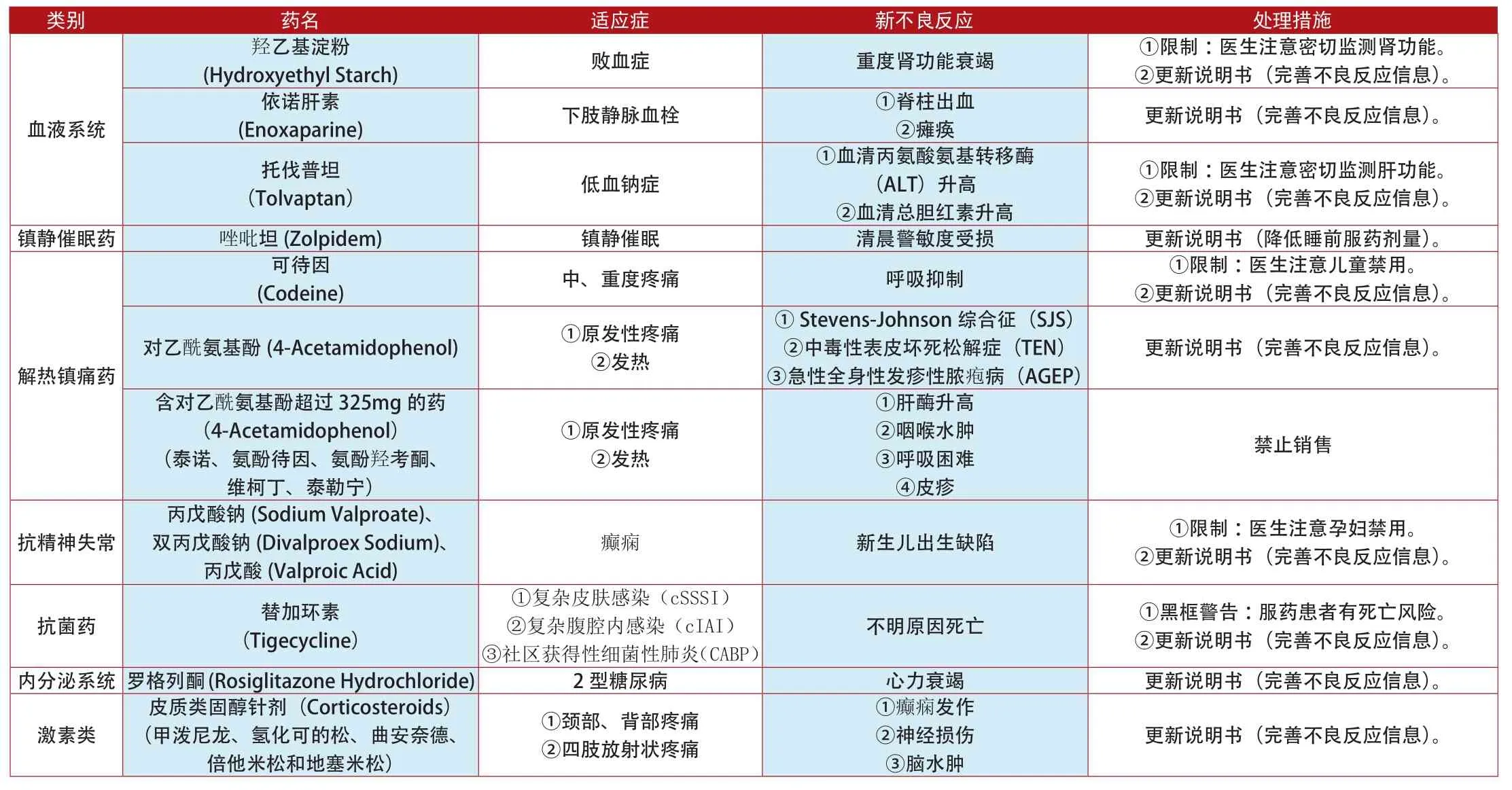
類別 藥名 適應癥 新不良反應 處理措施(Hydroxyethyl Starch) 敗血癥 重度腎功能衰竭 ①限制:醫生注意密切監測腎功能。②更新說明書(完善不良反應信息)。依諾肝素羥乙基淀粉血液系統(Enoxaparine) 下肢靜脈血栓 ①脊柱出血②癱瘓 更新說明書(完善不良反應信息)。①限制:醫生注意密切監測肝功能。②更新說明書(完善不良反應信息)。鎮靜催眠藥 唑吡坦(Zolpidem) 鎮靜催眠 清晨警敏度受損 更新說明書(降低睡前服藥劑量)。托伐普坦(Tolvaptan) 低血鈉癥①血清丙氨酸氨基轉移酶(ALT)升高②血清總膽紅素升高(Codeine) 中、重度疼痛 呼吸抑制 ①限制:醫生注意兒童禁用。②更新說明書(完善不良反應信息)。對乙酰氨基酚(4-Acetamidophenol) ①原發性疼痛②發熱可待因更新說明書(完善不良反應信息)。解熱鎮痛藥①Stevens-Johnson綜合征(SJS)②中毒性表皮壞死松解癥(TEN)③急性全身性發疹性膿皰病(AGEP)含對乙酰氨基酚超過325mg的藥(4-Acetamidophenol)(泰諾、氨酚待因、氨酚羥考酮、維柯丁、泰勒寧)①原發性疼痛②發熱①肝酶升高②咽喉水腫③呼吸困難④皮疹禁止銷售抗精神失常丙戊酸鈉(Sodium Valproate)、雙丙戊酸鈉(Divalproex Sodium)、丙戊酸(Valproic Acid)癲癇 新生兒出生缺陷 ①限制:醫生注意孕婦禁用。②更新說明書(完善不良反應信息)。不明原因死亡 ①黑框警告:服藥患者有死亡風險。②更新說明書(完善不良反應信息)。內分泌系統 羅格列酮(Rosiglitazone Hydrochloride) 2型糖尿病 心力衰竭 更新說明書(完善不良反應信息)。抗菌藥 替加環素(Tigecycline)①復雜皮膚感染(cSSSI)②復雜腹腔內感染(cIAI)③社區獲得性細菌性肺炎(CABP)激素類皮質類固醇針劑(Corticosteroids)(甲潑尼龍、氫化可的松、曲安奈德、倍他米松和地塞米松)①頸部、背部疼痛②四肢放射狀疼痛①癲癇發作②神經損傷③腦水腫更新說明書(完善不良反應信息)。
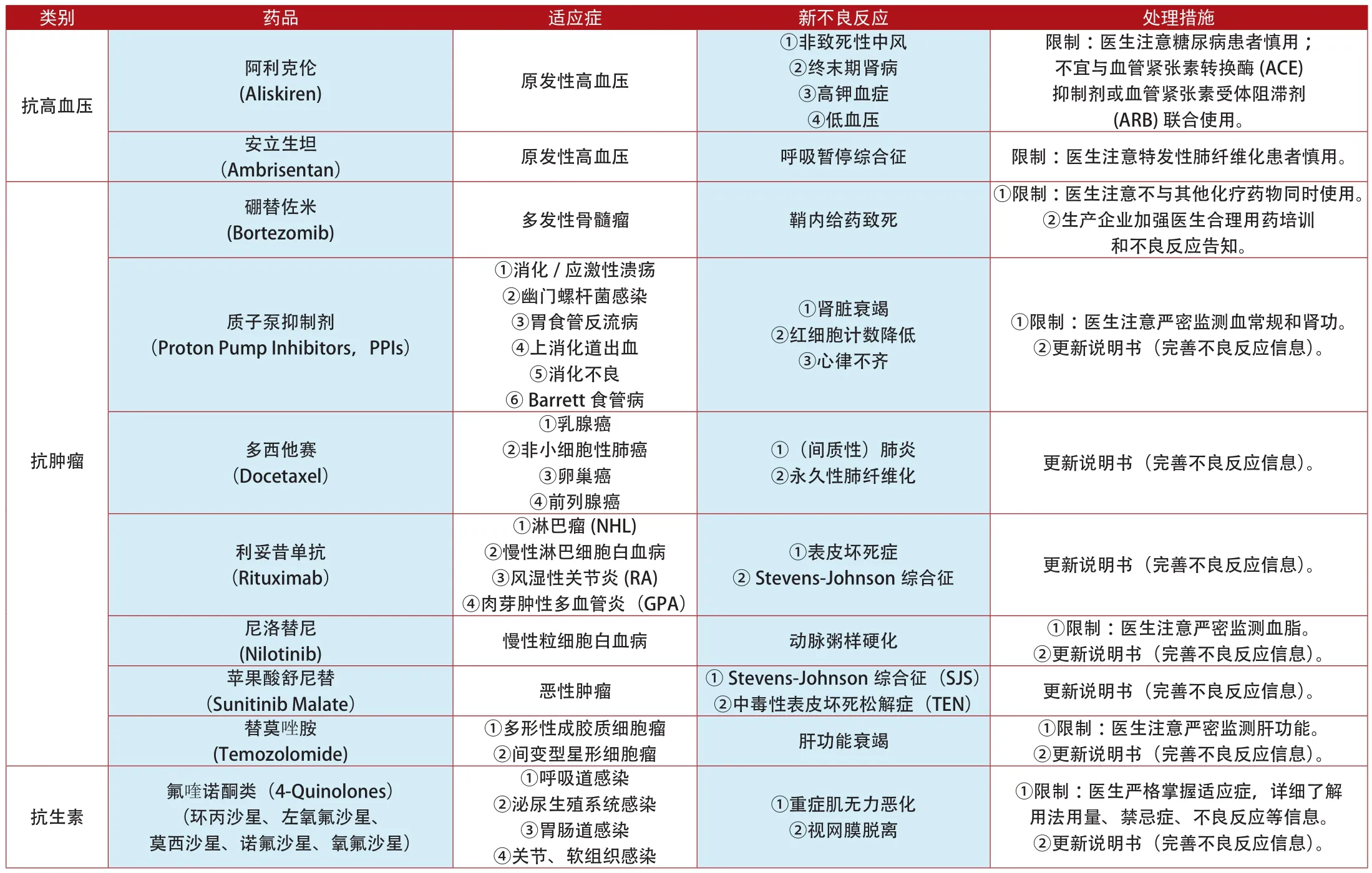
附表2:2012年1月~2014年7月加拿大更新說明書和禁止銷售的上市藥品
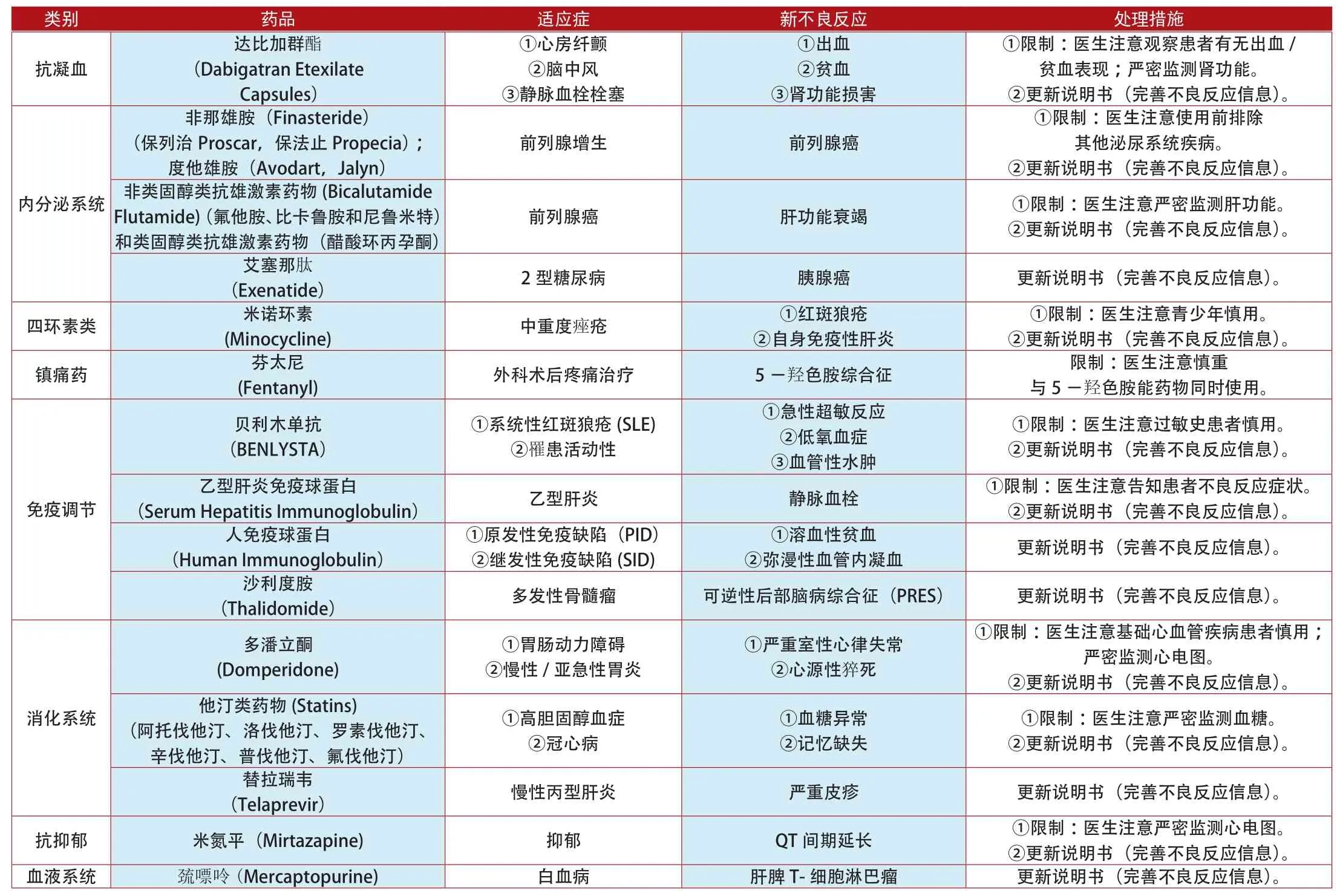
類別 藥品 適應癥 新不良反應 處理措施抗凝血達比加群酯(Dabigatran Etexilate Capsules)①心房纖顫②腦中風③靜脈血栓栓塞①出血②貧血③腎功能損害①限制:醫生注意觀察患者有無出血/貧血表現;嚴密監測腎功能。②更新說明書(完善不良反應信息)。非那雄胺(Finasteride)(保列治Proscar,保法止Propecia);度他雄胺(Avodart,Jalyn)前列腺增生 前列腺癌①限制:醫生注意使用前排除其他泌尿系統疾病。②更新說明書(完善不良反應信息)。內分泌系統前列腺癌 肝功能衰竭 ①限制:醫生注意嚴密監測肝功能。②更新說明書(完善不良反應信息)。艾塞那肽(Exenatide) 2型糖尿病 胰腺癌 更新說明書(完善不良反應信息)。四環素類 米諾環素非類固醇類抗雄激素藥物(Bicalutamide Flutamide)(氟他胺、比卡魯胺和尼魯米特)和類固醇類抗雄激素藥物(醋酸環丙孕酮)①限制:醫生注意青少年慎用。②更新說明書(完善不良反應信息)。鎮痛藥 芬太尼(Minocycline) 中重度痤瘡 ①紅斑狼瘡②自身免疫性肝炎(Fentanyl) 外科術后疼痛治療 5-羥色胺綜合征 限制:醫生注意慎重與5-羥色胺能藥物同時使用。貝利木單抗(BENLYSTA)①系統性紅斑狼瘡(SLE)②罹患活動性①急性超敏反應②低氧血癥③血管性水腫(Serum Hepatitis Immunoglobulin) 乙型肝炎 靜脈血栓 ①限制:醫生注意告知患者不良反應癥狀。②更新說明書(完善不良反應信息)。人免疫球蛋白(Human Immunoglobulin)①限制:醫生注意過敏史患者慎用。②更新說明書(完善不良反應信息)。乙型肝炎免疫球蛋白免疫調節①原發性免疫缺陷(PID)②繼發性免疫缺陷(SID)①溶血性貧血②彌漫性血管內凝血 更新說明書(完善不良反應信息)。沙利度胺(Thalidomide) 多發性骨髓瘤 可逆性后部腦病綜合征(PRES) 更新說明書(完善不良反應信息)。多潘立酮(Domperidone)①胃腸動力障礙②慢性/亞急性胃炎①嚴重室性心律失常②心源性猝死①限制:醫生注意基礎心血管疾病患者慎用;嚴密監測心電圖。②更新說明書(完善不良反應信息)。消化系統①限制:醫生注意嚴密監測血糖。②更新說明書(完善不良反應信息)。替拉瑞韋(Telaprevir) 慢性丙型肝炎 嚴重皮疹 更新說明書(完善不良反應信息)。抗抑郁 米氮平(Mirtazapine) 抑郁 QT間期延長 ①限制:醫生注意嚴密監測心電圖。②更新說明書(完善不良反應信息)。血液系統 巰嘌呤(Mercaptopurine) 白血病 肝脾T-細胞淋巴瘤 更新說明書(完善不良反應信息)。他汀類藥物(Statins)(阿托伐他汀、洛伐他汀、羅素伐他汀、辛伐他汀、普伐他汀、氟伐他汀)①高膽固醇血癥②冠心病①血糖異常②記憶缺失
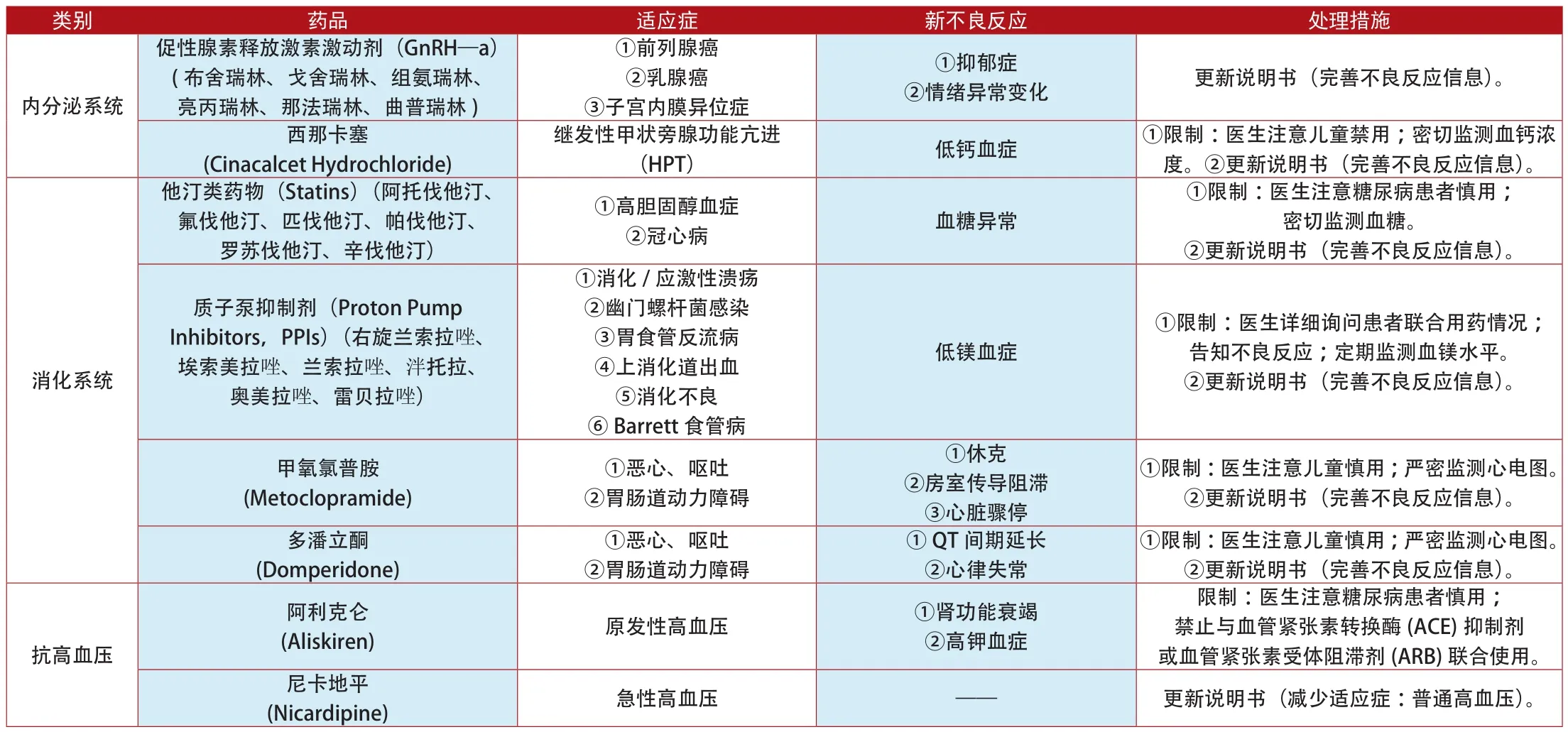
附表3:2012年1月~2014年7月歐盟更新說明書和禁止銷售的上市藥品
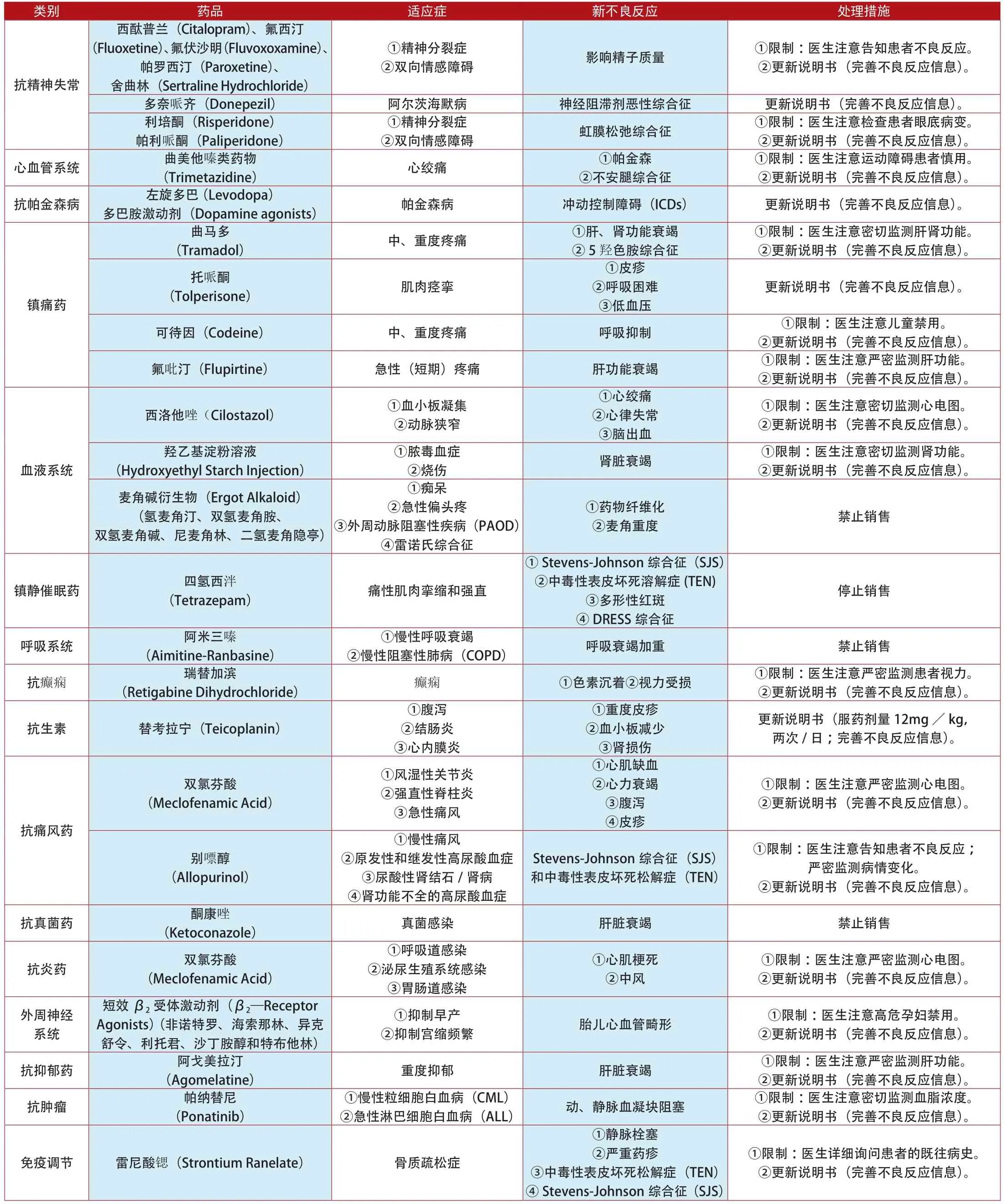
類別 藥品 適應癥 新不良反應 處理措施②雙向情感障礙 影響精子質量 ①限制:醫生注意告知患者不良反應。②更新說明書(完善不良反應信息)。西酞普蘭(Citalopram)、氟西汀(Fluoxetine)、氟伏沙明(Fluvoxoxamine)、帕羅西汀(Paroxetine)、舍曲林(Sertraline Hydrochloride)抗精神失常①精神分裂癥多奈哌齊(Donepezil) 阿爾茨海默病 神經阻滯劑惡性綜合征 更新說明書(完善不良反應信息)。利培酮(Risperidone)帕利哌酮(Paliperidone)①精神分裂癥②雙向情感障礙 虹膜松弛綜合征 ①限制:醫生注意檢查患者眼底病變。②更新說明書(完善不良反應信息)。心血管系統 曲美他嗪類藥物①限制:醫生注意運動障礙患者慎用。②更新說明書(完善不良反應信息)。抗帕金森病左旋多巴 (Levodopa)多巴胺激動劑(Dopamine agonists) 帕金森病 沖動控制障礙(ICDs) 更新說明書(完善不良反應信息)。(Trimetazidine) 心絞痛 ①帕金森②不安腿綜合征①限制:醫生注意密切監測肝腎功能。②更新說明書(完善不良反應信息)。托哌酮(Tolperisone) 肌肉痙攣(Tramadol) 中、重度疼痛 ①肝、腎功能衰竭②5羥色胺綜合征曲馬多更新說明書(完善不良反應信息)。鎮痛藥①皮疹②呼吸困難③低血壓可待因(Codeine) 中、重度疼痛 呼吸抑制 ①限制:醫生注意兒童禁用。②更新說明書(完善不良反應信息)。氟吡汀(Flupirtine) 急性(短期)疼痛 肝功能衰竭 ①限制:醫生注意嚴密監測肝功能。②更新說明書(完善不良反應信息)。①限制:醫生注意密切監測心電圖。②更新說明書(完善不良反應信息)。羥乙基淀粉溶液(Hydroxyethyl Starch Injection)西洛他唑(Cilostazol) ①血小板凝集②動脈狹窄①心絞痛②心律失常③腦出血①膿毒血癥血液系統 ②燒傷 腎臟衰竭 ①限制:醫生注意密切監測腎功能。②更新說明書(完善不良反應信息)。麥角堿衍生物(Ergot Alkaloid)(氫麥角汀、雙氫麥角胺、雙氫麥角堿、尼麥角林、二氫麥角隱亭)①癡呆②急性偏頭疼③外周動脈阻塞性疾病(PAOD)④雷諾氏綜合征①藥物纖維化②麥角重度 禁止銷售鎮靜催眠藥 四氫西泮(Tetrazepam) 痛性肌肉攣縮和強直①Stevens-Johnson綜合征(SJS)②中毒性表皮壞死溶解癥(TEN)③多形性紅斑④DRESS綜合征停止銷售呼吸系統 阿米三嗪(Aimitine-Ranbasine)①慢性呼吸衰竭②慢性阻塞性肺病(COPD) 呼吸衰竭加重 禁止銷售抗癲癇 瑞替加濱(Retigabine Dihydrochloride) 癲癇 ①色素沉著②視力受損 ①限制:醫生注意嚴密監測患者視力。②更新說明書(完善不良反應信息)。抗生素 替考拉寧(Teicoplanin)①腹瀉②結腸炎③心內膜炎①重度皮疹②血小板減少③腎損傷更新說明書(服藥劑量12mg/kg,兩次/日;完善不良反應信息)。雙氯芬酸(Meclofenamic Acid)①風濕性關節炎②強直性脊柱炎③急性痛風①限制:醫生注意嚴密監測心電圖。②更新說明書(完善不良反應信息)。抗痛風藥①心肌缺血②心力衰竭③腹瀉④皮疹①限制:醫生注意告知患者不良反應;嚴密監測病情變化。②更新說明書(完善不良反應信息)。抗真菌藥 酮康唑(Ketoconazole) 真菌感染 肝臟衰竭 禁止銷售別嘌醇(Allopurinol)①慢性痛風②原發性和繼發性高尿酸血癥③尿酸性腎結石/腎病④腎功能不全的高尿酸血癥Stevens-Johnson綜合征(SJS)和中毒性表皮壞死松解癥(TEN)抗炎藥 雙氯芬酸(Meclofenamic Acid)①呼吸道感染②泌尿生殖系統感染③胃腸道感染①心肌梗死②中風①限制:醫生注意嚴密監測心電圖。②更新說明書(完善不良反應信息)。外周神經系統②抑制宮縮頻繁 胎兒心血管畸形 ①限制:醫生注意高危孕婦禁用。②更新說明書(完善不良反應信息)。抗抑郁藥 阿戈美拉汀短效β2受體激動劑(β2—Receptor Agonists) (非諾特羅、海索那林、異克舒令、利托君、沙丁胺醇和特布他林)①抑制早產(Agomelatine) 重度抑郁 肝臟衰竭 ①限制:醫生注意嚴密監測肝功能。②更新說明書(完善不良反應信息)。抗腫瘤 帕納替尼(Ponatinib)②急性淋巴細胞白血病(ALL) 動、靜脈血凝塊阻塞 ①限制:醫生注意密切監測血脂濃度。②更新說明書(完善不良反應信息)。①慢性粒細胞白血病(CML)免疫調節 雷尼酸鍶(Strontium Ranelate) 骨質疏松癥①靜脈栓塞②嚴重藥疹③中毒性表皮壞死松解癥(TEN)④Stevens-Johnson綜合征(SJS)①限制:醫生詳細詢問患者的既往病史。②更新說明書(完善不良反應信息)。

類別 藥品 適應癥 新不良反應 處理措施降鈣素(Calcitonin)①限制:醫生注意骨質疏松癥禁用;密切監測血鈣溶度。②更新說明書(完善不良反應信息)。吡美莫司①骨質疏松癥②Paget病③高鈣血癥前列腺癌免疫調節(Strontium Ranelate) 重度骨質疏松 ①動脈血流阻塞②心肌缺血①限制:醫生注意密切監測心電圖。②更新說明書(完善不良反應信息)。雙醋瑞因(Diacerein) 退變性骨關節病 重度腹瀉 禁止銷售(Pimecrolimus) 特應性皮炎 惡性疾病 ①限制:醫生注意2歲內兒童禁用。②更新說明書(完善不良反應信息)。雷奈酸鍶
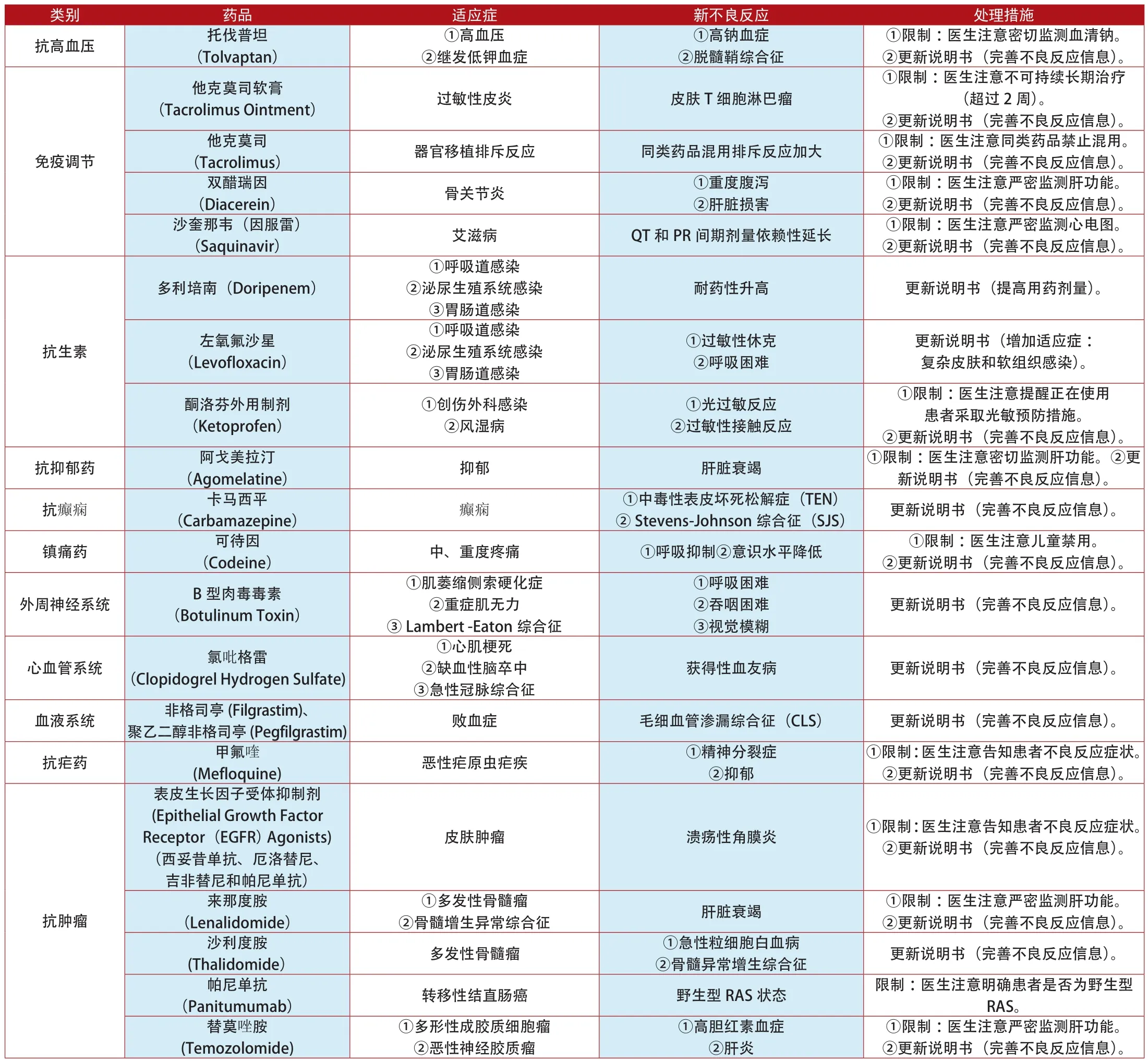
附表4:2012年1月~2014年7月英國更新說明書和禁止銷售的上市藥品
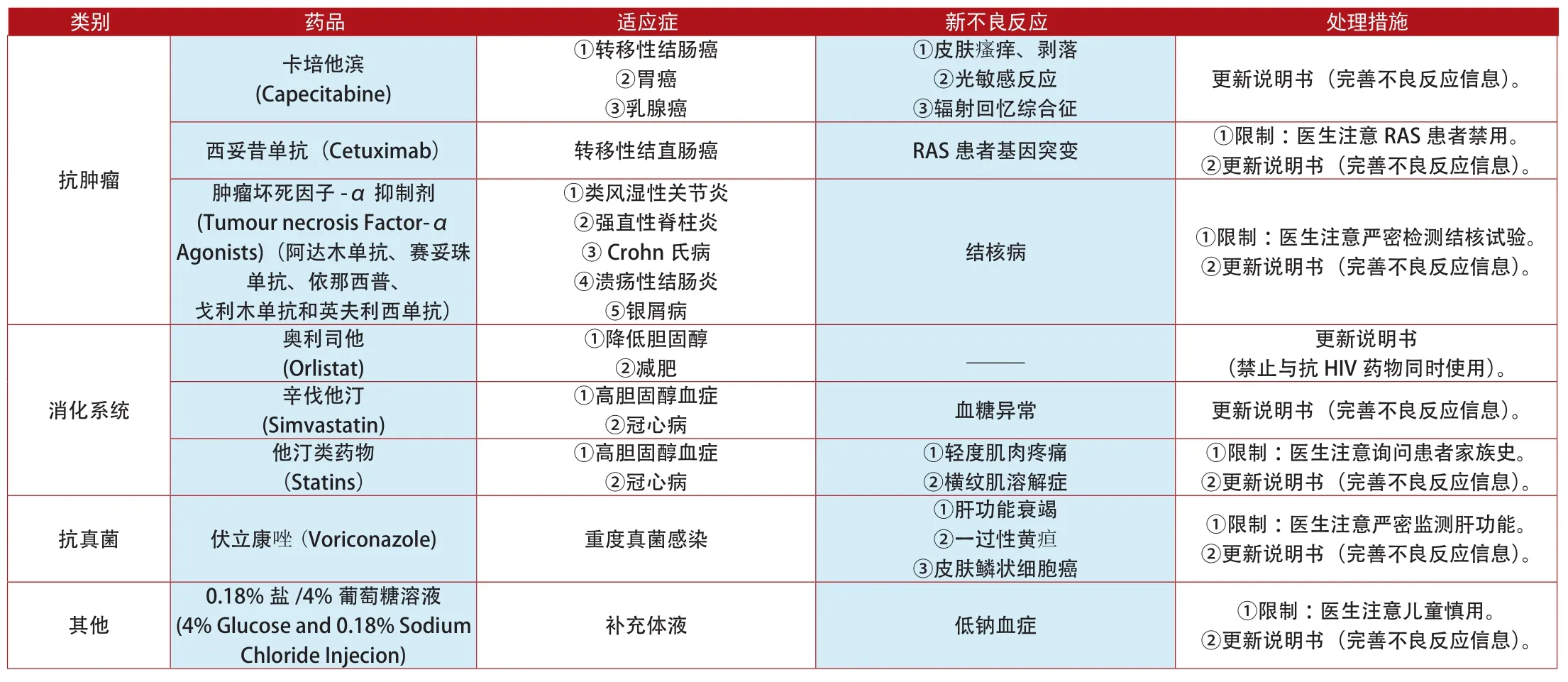
類別 藥品 適應癥 新不良反應 處理措施卡培他濱(Capecitabine)①轉移性結腸癌②胃癌③乳腺癌①皮膚瘙癢、剝落②光敏感反應③輻射回憶綜合征更新說明書(完善不良反應信息)。西妥昔單抗(Cetuximab) 轉移性結直腸癌 RAS患者基因突變 ①限制:醫生注意RAS患者禁用。②更新說明書(完善不良反應信息)。腫瘤壞死因子-α抑制劑(Tumour necrosis Factor-α Agonists)(阿達木單抗、賽妥珠單抗、依那西普、戈利木單抗和英夫利西單抗)抗腫瘤①類風濕性關節炎②強直性脊柱炎③Crohn氏病④潰瘍性結腸炎⑤銀屑病結核病 ①限制:醫生注意嚴密檢測結核試驗。②更新說明書(完善不良反應信息)。②減肥 _____ 更新說明書(禁止與抗HIV藥物同時使用)。辛伐他汀(Simvastatin)奧利司他(Orlistat)①降低膽固醇消化系統①高膽固醇血癥②冠心病 血糖異常 更新說明書(完善不良反應信息)。①限制:醫生注意詢問患者家族史。②更新說明書(完善不良反應信息)。抗真菌 伏立康唑(Voriconazole) 重度真菌感染他汀類藥物(Statins)①高膽固醇血癥②冠心病①輕度肌肉疼痛②橫紋肌溶解癥①肝功能衰竭②一過性黃疸③皮膚鱗狀細胞癌①限制:醫生注意嚴密監測肝功能。②更新說明書(完善不良反應信息)。其他0.18%鹽/4%葡萄糖溶液(4% Glucose and 0.18% Sodium Chloride Injecion)補充體液 低鈉血癥 ①限制:醫生注意兒童慎用。②更新說明書(完善不良反應信息)。
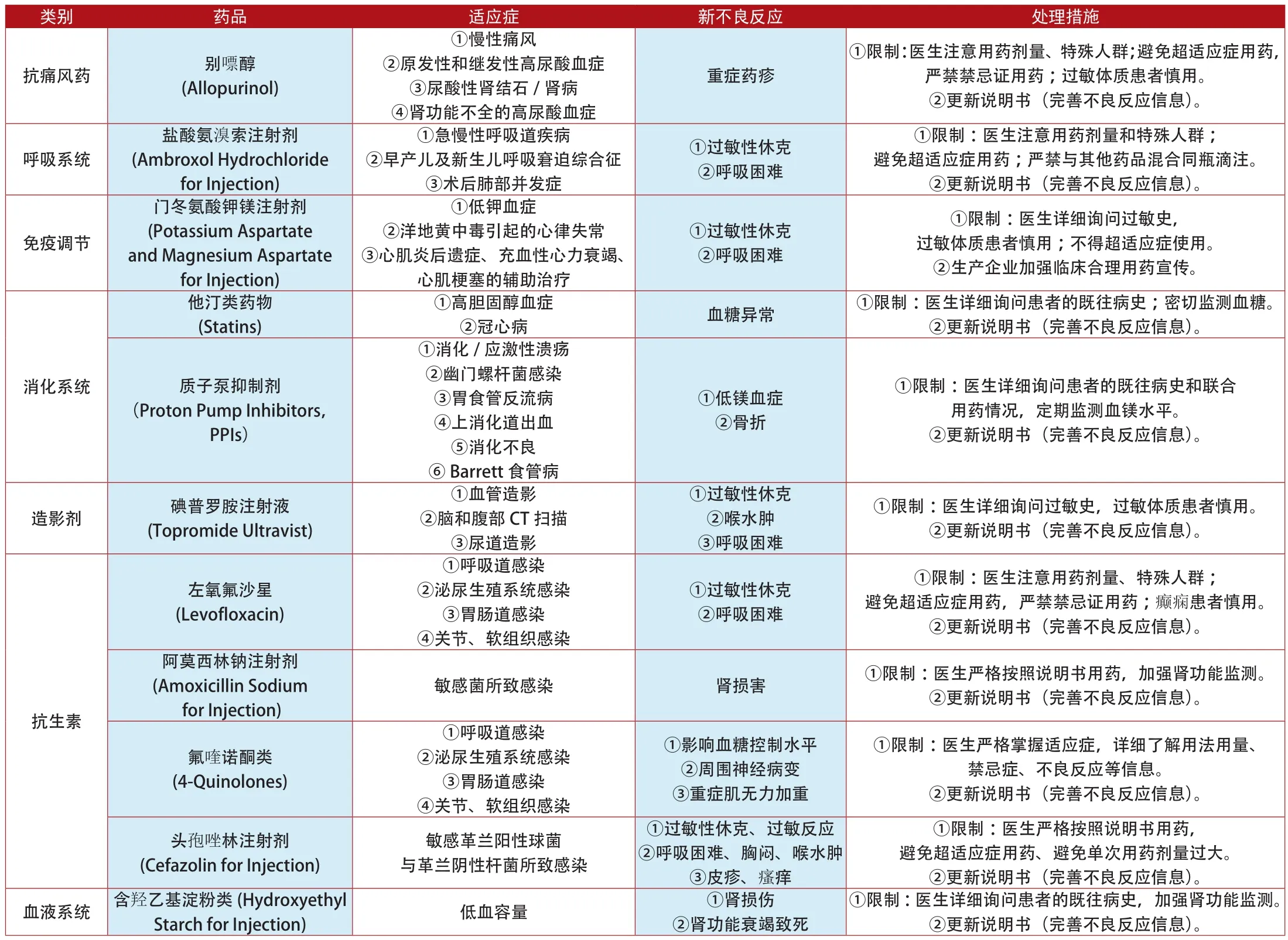
附表5:2012年1月~2014年7月我國更新說明書和禁止銷售的上市藥品

