UPLC法測定乳制品中的納他霉素
(國家農副產品監督檢驗中心(新疆),新疆烏魯木齊 830011)
納他霉素又稱游鏈霉素,是一種重要的多烯類大環內酯抗菌素。納他霉素在大多數食品的pH范圍內非常穩定,是一種天然、廣譜、高效安全的酵母菌及霉菌等絲狀真菌抑制劑,它不僅能夠抑制真菌,還能防止絲狀真菌中黃曲霉毒素的產生[1-3]。實驗發現0.5 mg/kg~10 mg/kg的納他霉素含量即可抑制絕大多數霉菌,其對霉菌的抑菌能力是普通化學防腐劑的30倍~50倍[4]。由于納他霉素具有無致突變、致癌、致畸和致敏作用,不誘導微生物產生抗性等優點,目前該產品已經在50多個國家得到廣泛使用[5]。1997年我國衛生部正式批準納他霉素作為食品防腐劑,但是在乳粉、酸奶、純牛奶等乳制品中不允許使用[6]。但經過調查,發現一些乳制品企業仍在其生產中使用納他霉素。
目前文獻報道中,納他霉素的分析方法主要有高效液相色譜法[7-11]、薄層層析法[12]、紫外風光光度法[13-15]、微生物法[16]等,高效液相色譜法已經列入國標方法[17]。但由于液相分析中基質干擾嚴重,產品中的納他霉素“假陽性”驗證工作也非常重要。本試驗在現有國家標準的基礎上建立了乳制品中納他霉素殘留量的檢測方法,該方法前處理簡單,回收率及靈敏度高,準確度和穩定性好,適用于監控乳制品廠家納他霉素的添加殘留量,從而保障食品安全;并在實驗基礎上,探討了幾種“假陽性”驗證方法,對檢測工作的準確性和質檢部門的權威性有一定的指導意義。
1 材料與方法
1.1 材料與試劑
甲醇(HPLC級):美國Fisher公司;冰乙酸(優級純):中國上海國藥公司;納他霉素標準品(純度>95%):德國Dr.Ehrenstorfer公司;水為超純水。
1.2 儀器與設備
Waters ACQULITY UPLC H-class高效液相色譜儀(配有紫外檢測器、高速冷凍離心機):德國SIGMA公司;超純水儀:開普勒公司;UV-2450紫外-可見分光光度計:日本島津公司;TSQ access Quantum高效液相色譜-質譜/質譜儀:Thermo Fisher Scientific公司;電子分析天平:梅特勒托利多公司。
1.3 標準溶液的配制、線性范圍及最低檢出限、回收率
精確稱取10 mg納他霉素,轉移到10 mL棕色容量瓶中,用甲醇定容到刻度,配制成質量濃度為1mg/mL的標準貯備液,避光,放入-20℃冰箱中備用。準確量取儲備液,用高純水稀釋定容,配制納他霉素的濃度梯度為 0.2,0.8,2.0,4.0,8.0 μg/mL 的標準溶液。 并測定出最低檢出限。選用在空白樣品中添加納他霉素,測定乳制品中的回收率。
1.4 色譜條件
色譜柱:Waters ACQUITY BEH C18,流動相:水∶甲醇=55 ∶45,流速:200 μL/min,柱溫:30 ℃,進樣體積:1 μL,檢測波長:303 nm。
1.5 前處理方法
稱取樣品5.00 g(精確到0.01 g)于50 mL塑料離心管中,加入15 mL甲醇,超聲提取30 min,加水定容至25 mL,搖勻,冰箱冷凍1 h。取樣液過孔徑0.22 μm濾膜,進行液相色譜分析。
1.6 測定及定性定量方法
在本文選定的色譜條件下,分別吸取1 μL樣品溶液及標準工作液上機分析。根據保留時間定性,外標法定量。標準溶液及陽性樣品色譜圖如圖1所示。
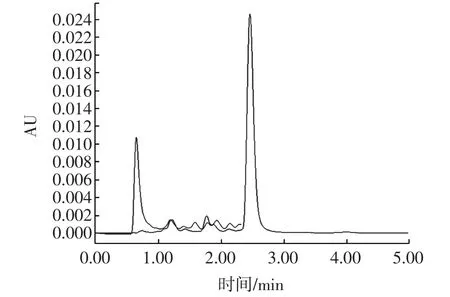
圖1 納他霉素標準溶液及陽性樣品色譜圖Fig.1 Spectra of natamycin standard solution and positive sample
2 結果與分析
2.1 檢測波長的確定
采用紫外-可見分光光度計在190 nm~900 nm波長范圍內進行掃描,最大吸收波長在303 nm處(如圖2所示),因此選擇303 nm作為檢測波長。
2.2 流動相的確定
本實驗考察了反相色譜常用的流動相:甲醇-水、乙腈-水、甲醇-0.1%甲酸水、乙腈-0.01%甲酸水。結果表明流動相中是否加酸對靈敏度及保留能力影響不大,同時由于乙腈毒性較大且價格昂貴,最終選擇了甲醇-水為流動相。對流動相的比例進行了優化,當水∶甲醇=55∶45時,納他霉素基本可以和基質完全分離,且靈敏度較高。
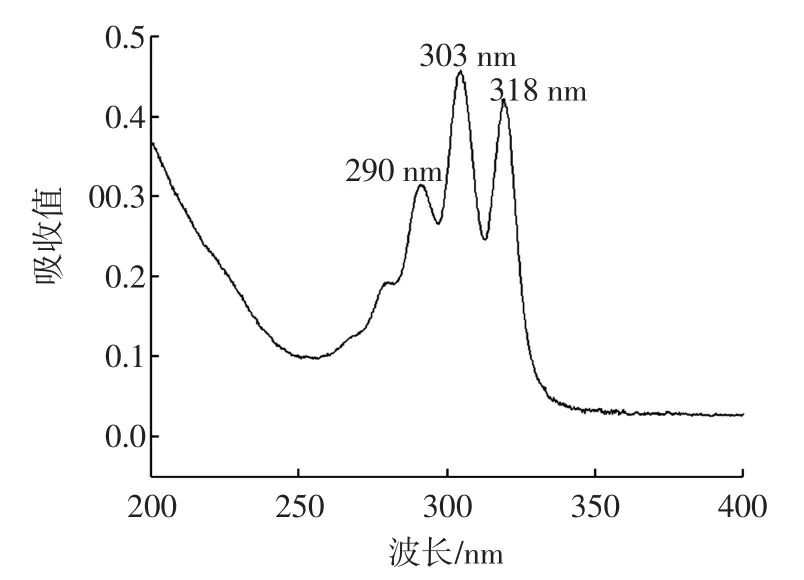
圖2 納他霉素200-400nm UV光譜圖Fig.2 200-400 nm UV spectra of natamycin
2.3 線性方程、相關系數、檢出限
將納他霉素系列標準工作溶液(0.2,0.8,2.0,4.0,8.0μg/mL)按照1.4節中的條件進樣分析。以納他霉素的質量(X,μg)為橫坐標,峰面積(Y)為縱坐標作圖,得線性方程為Y=2.48×107X+3.31×103,線性相關系數R2=0.999 7。以3倍噪聲值與最小濃度的色譜峰峰高比較,計算出檢出限為0.02μg/mL,根據前處理方法計算,該方法的最低檢出限為0.1mg/kg,表明乳制品中納他霉素含量在0.1 mg/kg~40 mg/kg時具有良好的線性關系。
2.4 回收率的測定
在酸奶、奶酪空白樣品中添加3個濃度水平的納他霉素標準溶液,做回收率試驗,結果列于表1。
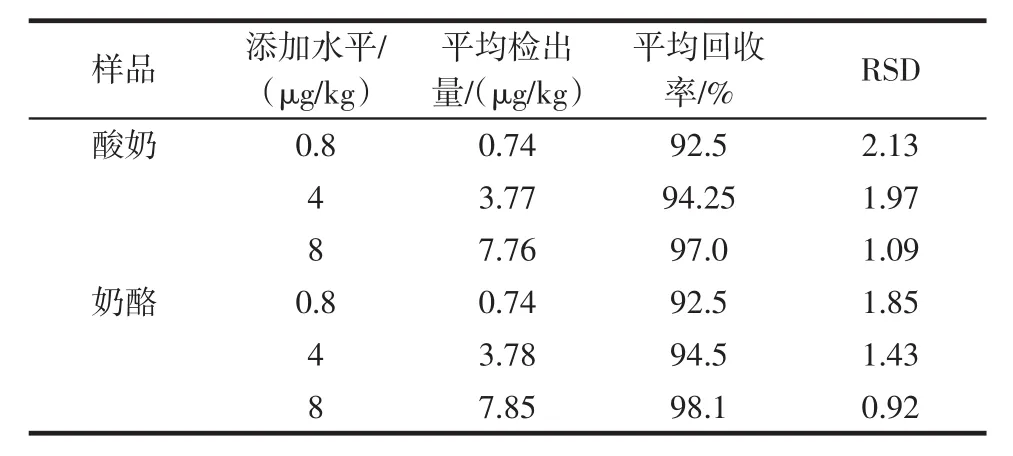
表1 納他霉素在乳制品中的回收率Table 1 Recovries of natamycin in dairy
在納他霉素濃度的3個水平上,回收率在92.5%~98.1%(n=6)之間,相對標準偏差(RSD)0.92%~2.13%。因此,該方法準確度、重復性良好。
2.5 “假陽性”樣品的驗證方法
由于基質的復雜性,本方法的前處理方法難以消除部分基質干擾,在定性方面有一定的弊端,容易引起假陽性。實驗過程中,可以通過以下方法進行“假陽性”驗證。
2.5.1 加標法
對疑似陽性的樣品進行加標實驗,若加標樣品流出的色譜峰并未出現新的組分或肩峰,呈現出完好的對稱性,且保留時間基本不變,則初步判斷為陽性(如圖3所示),但仍有分離效果差導致兩者不能分離的可能。
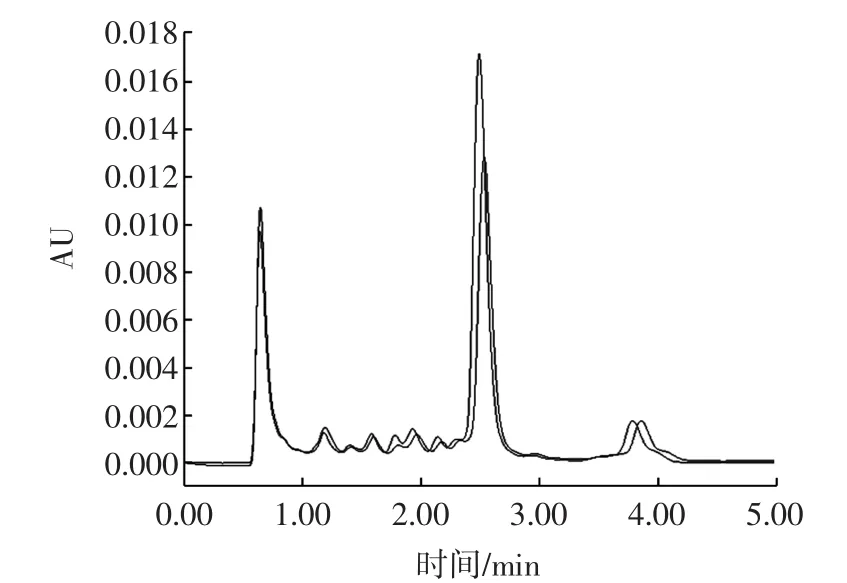
圖3 樣品與加標后樣品納他霉素的色譜圖Fig.3 Natamycin chromatogram of sample and addingstandarded sample
2.5.2 雙柱法
雙柱法是常用的假陽性驗證方法之一。通過改變色譜柱,即改變納他霉素的保留性,可改變納他霉素的保留時間,再將樣品的保留時間與標準物質進行對照,即可確定是否存在“假陽性”。如圖4所示。
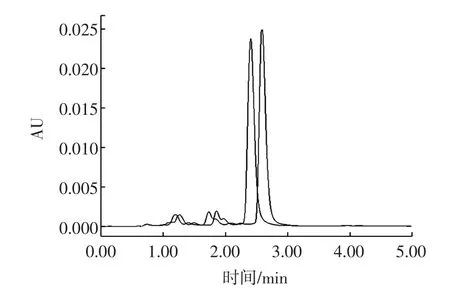
圖4 不同色譜柱的納他霉素色譜圖Fig.4 Natamycin chromatogram on different columns
更換后的色譜柱保留較強,納他霉素延后出峰,若兩種色譜柱上樣品與標準溶液出峰均一致,則可判斷為陽性樣品。
2.5.3 改變流動相極性法
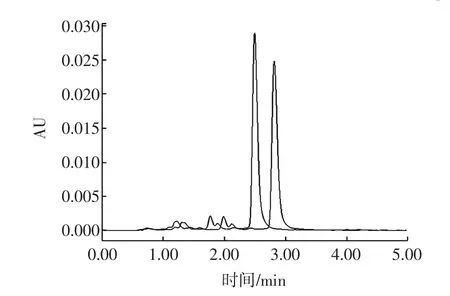
圖5 不同流動相比例下納他霉素的色譜圖Fig.5 Natamycin chromatogram at different ratio of mobile phase
改變流動相組成或者配比,即可改變流動相的洗脫強度,同樣也可以改變納他霉素的保留時間,確定樣品是陰性樣品還是陽性樣品。如圖5所示,將pH=3.0乙酸水溶液與甲醇比例由55∶45改變為60∶40,流動相洗脫能力減弱,納他霉素出峰時間延后,若在不同的流動相比例下樣品與標準溶液保留時間均能保持一致,則判斷為陽性樣品。
2.5.4 分光光度法
當納他霉素殘留量較高時,分光光度法也可進行驗證。對4 μg/mL和樣品進行測試,光譜圖如圖6所示,吸收波長303 nm和320 nm光區干擾較少,基本可以判定樣品是否含有納他霉素。
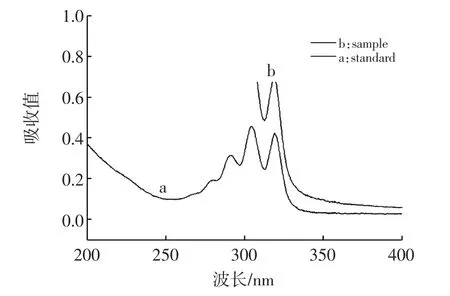
圖6 標液和陽性樣品的光譜圖比較Fig.6 Comparison of spectra of standard solution and sample
2.5.5 二極管陣列檢測器法
對于聯有二極管陣列檢測器的高效液相色譜儀,二極管陣列檢測器可以對分離后的色譜圖進行光譜分析,驗證色譜峰的光譜圖及其純度,可以進行陽性驗證。若光譜圖與標準物質峰型差別很大,則判為“假陽性”;若光譜圖與標準物質峰型基本類似,則有可能混有其它物質,需要進一步分離后才能定性定量;若光譜圖與標準物質峰型基本一致,只有吸光度大小的差異,則判為陽性樣品。
2.5.6 高效液相色譜-質譜/質譜法[18]
樣品經過液相色譜分離后,進入質譜檢測器。質譜法采用選擇反應監測(Selective Reaction Monitoring,SRM)掃描模式,子離子風度比進行定性,消除了基質干擾,是目前最準確的定性方式。陽性樣品不但總離子流圖與標準溶液基本一致(如圖7a和7c所示),子離子及選定的子離子風度比均與標準物質一致(如圖7b和7d所示)。而“假陽性”樣品在離子流圖上或者不出峰,或者離子風度比與標準物質差別不在允許誤差范圍內。
3 結論
本文建立了納他霉素的常規液相色譜檢測方法,該方法前處理簡單,回收率及靈敏度高,準確度和穩定性好,適用于日常的食品監督工作。同時,也討論了常用的“假陽性”驗證方法,對消除“假陽性”、維護質檢部門的權威性有著一定的的現實意義。
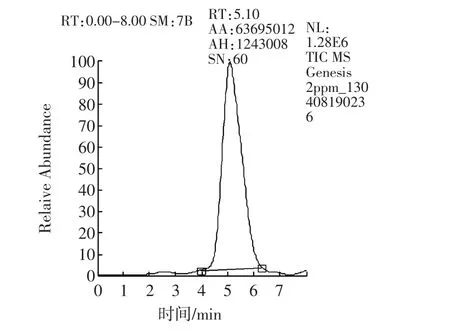
圖7a 納他霉素標準溶液總離子流圖Fig.7a Total ion current of natamycin
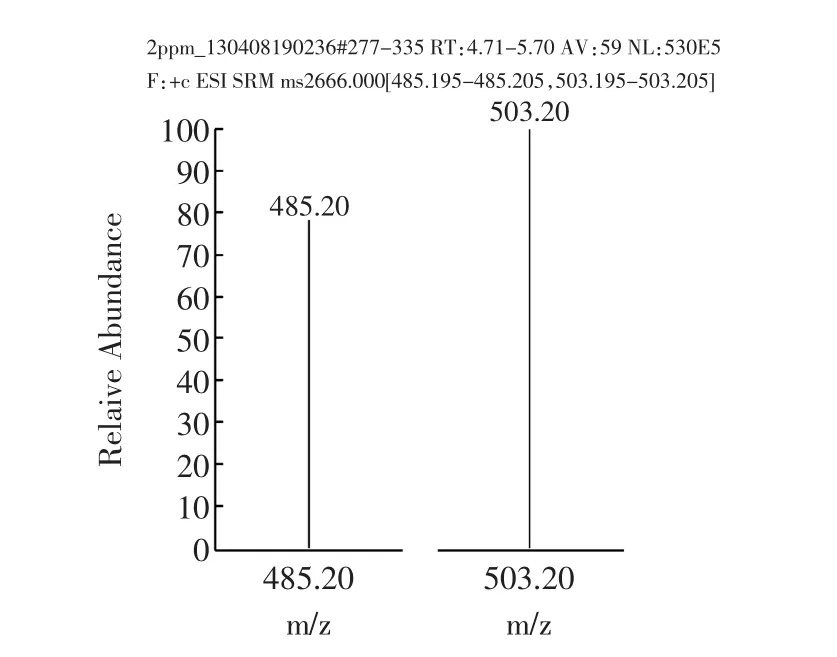
圖7b 納他霉素標準溶液定性離子與定量離子Fig.7b Qualitative ion and quantitative ion of natamycin standard
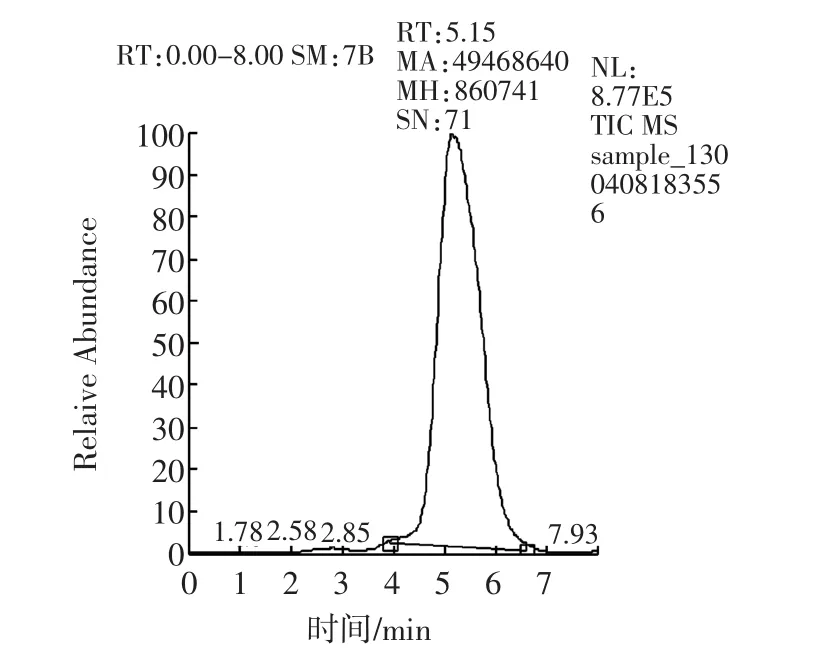
圖7c 陽性樣品總離子流圖Fig.7c Total ion current of positive sample
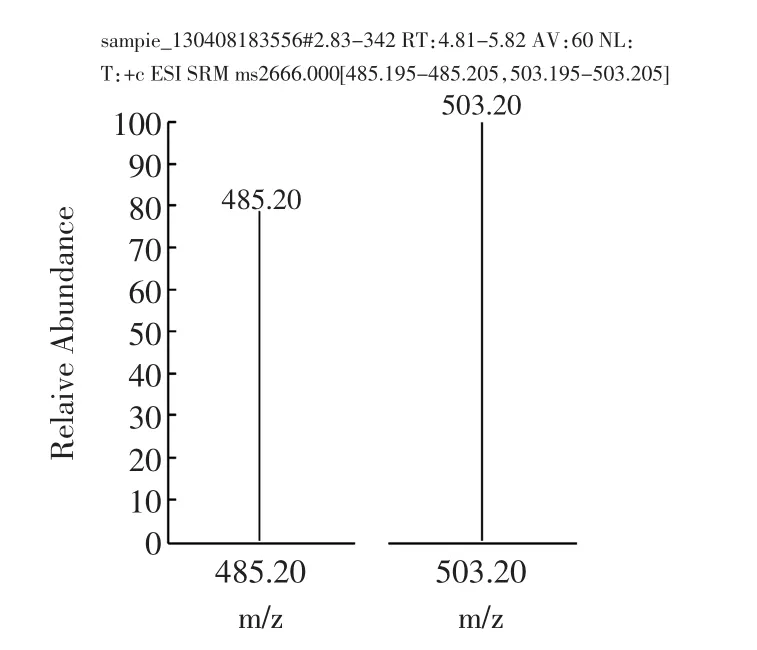
圖7d 陽性樣品定性離子與定量離子Fig.7d Qualitative and quantitative ion of negative sample

