晚期結直腸癌患者DC-CIK免疫干預前后D二聚體改變的臨床研究
王睿斌,郝筱詩,齊保聚,任連偉,盛敏佳
(1.北京市大興區人民醫院 肛腸外科,北京102600;2.吉林大學公共衛生學院2010級放射1班,長春130021;
3.吉林大學中日聯誼醫院 婦產科,長春130033)
惡性腫瘤患者往往伴有血液的高凝狀態,這種高凝狀態與惡性腫瘤的轉移密切相關。化療作為惡性腫瘤有效干預手段的同時,可加重這種高凝狀態甚至形成血栓[1]。近年來,免疫干預對于腫瘤干預的有效性得到肯定,并且與單細胞測序、“普朗克”探測微波背景輻射、人類連接組計劃、探索南極冰下世界、基礎植物研究共同被列為2013年人類6大科技任務之一[2]。本實驗的目的在于探討DC-CIK免疫干預對于晚期結直腸癌患者凝血功能及D二聚體的影響,進一步肯定DC-CIK的有效性及安全性。
1 資料與方法
1.1 研究對象
選擇2011年7月-2012年8月入住我院行DC-CIK免疫干預的IV期結直腸癌患者40人,其中男性26例,女性14例(年齡26-85歲),結腸癌15例,直腸癌25例(見表1)。所有患者在DC-CIK干預前后1月內均未接受放化療。患者及其法定代理人知情并同意接受該干預。所有患者在G-CSF動員前5天內及DC-CIK免疫干預1個月后行凝血功能及D二聚體的檢測。選擇同期體檢的健康成年人43例(年齡31-82歲)行凝血功能及D二聚體檢測作為對照。
1.2 主要試劑來源
G-CSF為日本中外制藥株式會社產品。干擾素-γ為上海凱茂生物醫藥有限公司產品,IL-2為北京四環生物制藥有限公司產品,CD3單抗為北京同力海源生物技術開發公司產品,TNF-α、IL-4、GMCSF為廈門特寶生物股份有限公司產品。纖維蛋白原、凝血酶原時間、D二聚體檢測試劑盒均為貝克曼庫爾特有限公司產品。
1.3 凝血功能及D二聚體的檢測方法
所有患者在G-CSF動員前5天內及DC-CIK免疫干預1個月后行凝血功能及D二聚體的檢測。檢測儀器為TOP全自動凝血儀,纖維蛋白原采用纖維蛋白原-C XL試劑盒,凝血酶原采用凝血酶原時間測定試劑盒(凝固法),D二聚體采用D-二聚體測定試劑盒(免疫比濁法)。
1.4 DC-CIK免疫干預經過
所有患者經骨髓穿刺細胞學檢查證實無骨髓轉移,骨髓造血功能大致正常,于-2天起予以G-CSF刺激造血,在-1天給予股靜脈留置雙腔ARROW靜脈導管,-1、0、1天給于速碧林0.4ml皮下注射(共3天,分血后拔除股靜脈置管,停止速碧林皮下注射)。當外周血白細胞﹥1×109/L、淋巴+單核﹥15%后,分兩天采集外周血干細胞200-250ml。取新鮮血25-50ml行DC-CIK細胞培養(剩余的-80℃分袋凍存備用)。培養7-10天進行細胞回輸,最低細胞數量大于1×108,隔日1次,每周期3次。
1.5 DC-CIK細胞懸液的制備
取新鮮外周血干細胞25-50ml用生理鹽水1∶1稀釋,緩慢加入淋巴細胞分層液表面上,無菌封蓋,400g,30min,輕輕吸細胞層,用生理鹽水1 500 rpm,5min,洗3次。細胞計數后,5×106/ml/瓶,將細胞加入完全培養基(含2.5%自體血漿的1640培養基)中60-80ml/瓶,3瓶放入5%的CO237℃培養箱中培養2-4h。懸浮細胞進行CIK培養,貼壁細胞進行DC培養。然后檢菌—將細胞與完全培養基進行細菌培養。
CIK培養:合并懸浮細胞培養液并移入完全培養基(含自體血漿的AIM-V),1LAIM-V培養基中加入各種細胞因子[干擾素-γ1ml(即全部加到1L AIM-V 中),IL-2 1 200μl,CD3單抗5-10μl并首次加1支肝素],放入5%CO2培養箱中培養。
DC培養:貼壁細胞加入DC培養基和各種細胞因子[TNF-α(30μl/30ml),IL-4(60μl/30ml),GMCSF(60μl/30ml)]放入5%CO2培養箱中培養。
隔日鏡下觀察,根據細胞狀態,補充完全培養基和細胞因子(含2.5%自體血漿 AIM-V加補IL-2終濃度1μl/ml)。
回收細胞后生理鹽水低速離心,洗3次。用適量含有12.5%血漿蛋白的生理鹽水重懸細胞,回輸患者。
1.6 統計方法
所有數據均以平均值±標準差表示,配對t檢驗,采用SPSS 13.0軟件包分析。
2 結果
2.1 DC-CIK細胞的流式檢測結果
所培養的DC和CIK細胞以1∶3的比例混合,所得細胞總數大于1×108,圖1為患者CIK細胞流式檢測結果圖例。
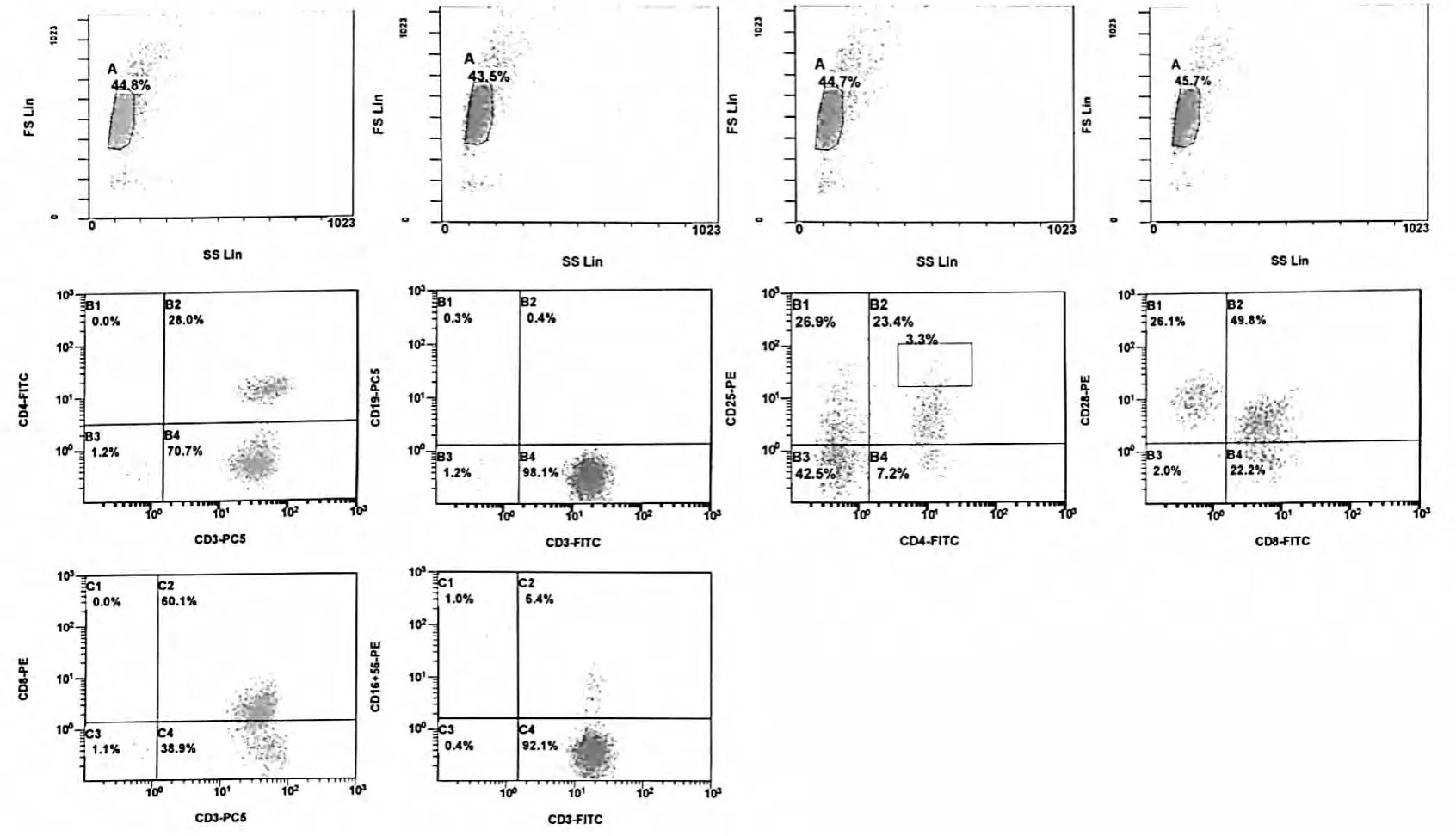
圖1 某患者CIK細胞流式檢測結果
2.2 晚期結直腸癌患者凝血功能與健康成年人的比較
所有晚期結直腸癌患者的D二聚體、FIB、PT%、INR均高于健康成年人(數據未顯示)。
40例晚期結直腸癌患者在DC-CIK免疫干預1月后D二聚體水平仍高于健康成年人,并且差異有統計學意義(P<0.05),FIB、PT%、INR也高于健康成年人,但差異無統計學意義(P>0.05),詳見表1。

表1 40例晚期結直腸癌患者免疫干預1月后與健康成年人凝血功能及D二聚體的比較
2.3 DC-CIK免疫干預前后凝血功能的比較
40例晚期結直腸癌患者在DC-CIK免疫干預前后D二聚體水平明顯下降,差異有統計學意義(P<0.05),FIB、APTT、PT%、INR也有所下降,但差異無統計學意義(P>0.05),詳見表2。
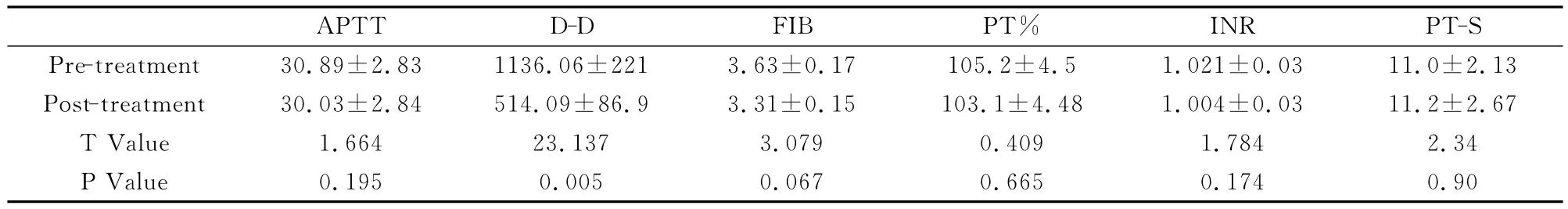
表2 40例晚期結直腸癌患者DC-CIK免疫干預前后凝血功能及D二聚體的變化
3 討論
惡性腫瘤患者往往伴有凝血功能異常——血漿纖維蛋白原增高[3]及D二聚體明顯增高,這與腫瘤高負荷導致的過度纖溶有關[4]。腫瘤患者患靜脈血栓的風險是健康人的7倍,而且是該人群的第二大死因[5],甚至有日本學者報道D二聚體可作為晚期結直腸癌的獨立不良預后因素[6]。化療是腫瘤患者干預的重要手段,但化療過程中腫瘤組織壞死產物及毒素對臨近組織和血管造成損傷,可激活凝血過程,從而增加靜脈血栓的風險[7],臨床上有待于發現一種有效并安全的干預手段。至2009年美國FDA批準了全球第一個免疫干預產品以來,人們對免疫干預對于腫瘤干預的有效性得到了肯定,我們的研究表明,DC-CIK免疫干預同時也可降低晚期結直腸癌患者D二聚體的水平,降低靜脈血栓風險,和化療相比更安全。
DC細胞是重要的抗原遞呈細胞,在介導免疫細胞的抗腫瘤活性中起著非常重要的作用。CIK細胞是非組織相容性復合物和非T細胞受體限制性的免疫活性細胞[8],既具有NK細胞的非 MHC限制性抗腫瘤作用也具有T細胞的抗腫瘤活性,抗瘤譜廣。和單獨培養的CIK細胞相比,DC-CIK的抗腫瘤活性更強,增殖速度更快并且凋亡速度更慢,CD3+CD56+細胞比例更高[9.10],并且對多藥耐藥的腫瘤細胞的療效更好[11]。
已有多篇文獻報道術后聯合DC-CIK、化療聯合DC-CIK 的有效性[12.13],任軍等[12]對比了轉移性乳腺癌患者標準劑量紫杉醇加塞替哌方案化療與大劑量該方案聯合DC-CIK免疫治療的PFS和OS,結果顯示DC-CIK組與標準劑量化療組相比,OS延長17.9個月(33.1比15.2),PFS延長6.5個月(10.2比3.7),差別均有統計學意義。本研究旨在探討DC-CIK免疫干預在有效的同時對于凝血功能及D二聚體的影響。結果表明,干預后D二聚體明顯下降(P=0.005),說明DC-CIK免疫干預可大大降低患者的靜脈血栓的風險,我們認為這與免疫干預后腫瘤負荷降低有關。我們的研究中患者在置管后及每日分血后均給于速碧林0.4ml皮下注射(僅3次),但根據速碧林的藥代動力學,該藥皮下注射后3小時血漿濃度達到高峰,而后5h進入半衰期,大約10-12h完全排出體外,故而對1月后的凝血功能及D二聚體沒有影響。本研究中干預后患者的D二聚體水平仍然高于同期體檢的健康成年人(P=0.03),可能與干預后仍有一定腫瘤負荷有關。另外,干預前后FIB也有明顯下降,但P=0.067尚無統計學差異,我們不排除與樣本量較少對結果的影響,隨著研究的樣本量進一步擴大尚待進一步觀察。
[1]程 艷,蔡 欣,劉基巍.惡性腫瘤與血栓形成[J].臨床腫瘤學雜志,2010,15(4):376.
[2]Adrian Cho.Breakthrough of the year[J].Science,2012,338(6114):1524.
[3]李佩章,王 英,黃玲莎,等.惡性腫瘤患者血漿纖維蛋白原檢測的意義[J].中華實用診斷與治療雜志,2009,23(6):566.
[4]Tas F,Kilic L,Bilgin E,et al.Clinical and prognostic significance of coagulation assays in advanced epithelial ovarian cancer[J].Int J Gynecol Cancer,2013,23(2):276.
[5]Dammacco F,Vacca A,Procaccio P,et al.Cancer-related coagulopathy(Trousseau's syndrome):review of the literature and experience of a single center of internal medicine[J].Clin Exp Med,2013,13(2):85.
[6]Yamamoto M,Yoshinaga K,Matsuyama A,et al.Plasma D-dimer level as a mortality predictor in patients with advanced or recurrent colorectal cancer[J].Oncology,2012,83(1):10.
[7]王明山,楊麗紅,潘景業,等.晚期肺癌患者化療過程中抗凝血酶和纖溶功能的變化及意義[J].中國肺癌雜志,2007,10(6):226.
[8]Schmidt-Wolf I G,Lefterova P,Mehta BA,et al.Phenotypic chracterization and identification of cytokine-induced killer cells[J].Exp Hematol,1993,21(13):1673.
[9]Yang L,Ren B,Li H,et al.Enhanced antitumor effects of DC-activated CIKs to chemotherapy treatment in a single cohort of advanced non-small-cell lung cancer patients[J].Cancer Immunol
Immunother,2013,62(1):65.
[10]Wang Q J,Wang H,Pan K,et al.Comparative study on anti-tumorimmune response of aut-ologous cytokine induced killer(CIK)cells,dendritic cells-CIK (DC-CIK)and semi-allogeneic DC-CIK[J].Chinese Journal of Cancer,2010,29(7):641.
[11]Li Shi-jun,Zhang Lian-sheng,Chai Ye,et al.Killing activity of co-cultured cytokine-induced killer cells and dendritic cells against multi-drug resistant tumor cells line[J].Chinese Journal of Oncology,2007,29(10):733.
[12]Ren J,Di L,Song G,et al.Selections of appropriate regimen of high-dose chemotherapy combined with adoptive cellular therapy with dendritic and cytokine-induced killer cells improved progression-free and overall survival in patients with metastatic breast cancer:reargument of such contentious therapeutic preferences[J].Clin Transl Oncol,2013Jan 29.[Epub ahead of print]
[13]Zhan HL,Gao X,Pu XY,et al.A randomized controlled trial of postoperative tumor lysate-pulsed dendritic cells and cytokine-induced killer cells immunotherapy in patients with localized and locally advanced renal cell carcinoma[J].Chin Med J,2012,125(21):3771.

