沉默Gli1基因對人非小細胞肺癌A549/DDP順鉑耐藥性的影響
達麗雋 李 華 張獻全(重慶醫科大學附屬第二醫院腫瘤科,重慶 400010)
肺癌是呼吸系統常見的惡性腫瘤,也是全世界癌癥死亡的首要原因。非小細胞肺癌(NSCLC)大約占肺癌總數的80%,其中有40%的患者在確診時已屬中晚期,這些患者的5年生存率僅有10%左右[1]。順鉑聯合其他化療藥物是治療晚期NSCLC的主要方案,然而,順鉑耐藥現象的出現導致了治療的失敗[2]。Hedgehog信號轉導通路在多種腫瘤中異常激活,包括 NSCLC[3]。該通路的激活依賴于Hh活性配體與其受體PTCH結合,解除對SMO的抑制,SMO將信號轉導給下游的鋅指結構轉錄因子Gli,引起靶基因的表達[4,5],例如 cyclinD1、Bcl-2、VEGF等[6]。其中,cyclinD1能有效調控細胞從G1期到S期的轉化,從而促進細胞分裂;近年來,Bcl-2已被定義為新型耐藥基因,有文獻報道下調Bcl-2的表達能增強腫瘤細胞對化療的敏感性[7-9]。因此,我們推測Shh-Gli信號通路可能參與了NSCLC的順鉑耐藥性。此外,相關文獻顯示Gli1的表達除了受Hedgehog信號通路的調控外,還受到其他致瘤信號通路的調控,包括TGF-β-Smads通路和PI3KAKT通路[10],這表明Gli1在腫瘤的發生中發揮著極其重要的作用。然而Gli1與順鉑耐藥是否相關至今仍未闡明。為此,本課題依據RNA干擾原理,設計并合成Gli1基因特異性小干擾RNA(small interfering RNA,siRNA)轉染至肺癌A549/DDP細胞株,通過檢測相關蛋白、細胞對順鉑敏感性及凋亡率的變化,初步探討Gli1基因對肺癌細胞順鉑耐藥的影響及可能的作用機制。
1 材料與方法
1.1 材料
1.1.1 細胞系 人肺腺癌細胞株A549及耐順鉑細胞株A549/DDP購自上海瑞鹿生物科技有限公司。
1.1.2 試劑 Gli1 siRNA、StealthRNAi Negative Control Duplexes購自Invitrogen公司;轉染試劑X-tremeGENE siRNA Transfection Reagent購自Roche公司;RNAiso Plus(Total RNA提取試劑盒)、熒光定量PCR試劑盒購自寶生物工程(大連)有限公司;Gli1、β-actin引物由生物工程(上海)有限公司設計并合成;Gli1、Bcl-2、cyclinD1、caspase-3、β-actin 抗體購自Abcam公司;Hoechst 33258、MTT細胞毒性檢測試劑盒、AnnexinV-FITC細胞凋亡檢測試劑盒購自江蘇碧云天公司。
1.2 試驗方法
1.2.1 細胞培養 向A549及A549/DDP細胞加入含10%胎牛血清(美國Gibco公司)的RPMI1640培養液(含 10 μg/ml青霉素及 10 μg/ml鏈霉素),置于37℃、5%CO2飽和濕度的培養箱中培養。每2 d細胞換液,每4~5 d 0.25%胰酶消化細胞,1∶4傳代培養。
1.2.2 轉染 根據X-tremeGENE siRNA Transfection Reagent轉染試劑說明書,轉染前1 d,6孔板收集細胞,無抗生素含血清培養基調節細胞濃度至1.0×105ml-1。次日,當細胞融合度達50%左右時進行轉染。具體步驟如下:實驗組:A液:用90 μl Opti-MEM?I稀釋10 μl X-tremeGENE siRNA Transfection Reagent,上下顛倒混勻 ;B 液:另取92.5 μl Opti-MEM?I稀釋 2 μg(7.5 μl)Gli1 siRNA,上下顛倒混勻;A液和B液在5 min之內混合,室溫下靜置20 min。實驗組加入上述混合液,另加2 ml無雙抗無血清培養基,即總體積為2.2 ml,37℃、5%CO2飽和濕度的培養箱中培養。6 h后換成含10%胎牛血清不含抗生素的RPMI1640培養液。陰性轉染組使用StealthTMRNAi Negative Control Duplexes代替Gli1 siRNA,空白對照組為等量培養基代替。
1.2.3 熒光定量PCR 按說明書提取細胞總RNA,逆轉錄成 cDNA。以 SYBR Premix Ex TaqⅡ12.5 μl,上、下游引物(10 μmol/;L) 各 1 μl,模板cDNA 2 μl,dH2O 8.5 μl的反應體系擴增 Gli1 基因,β-actin為內參照。Gli1上游引物:5'-CTGGACCTGCAGACGGTTATC-3',下游引物:5'-AGCCTCCTGGAGATGTGCAT-3',產物長度 82 bp;β-actin 上游引物:5'-TGACGTGGACATCCGCAAAG-3',下游引物:5'-CTGGAAGGTGGACAGCGAGG-3',產物長度205 bp。擴增條件:95℃預變性30 s,95℃變性5 s,60℃退火30 s,共40個循環后65℃延伸5 s,PCR產物根據Ct值進行相對定量分析。
1.2.4 Western blot 提取轉染后48 h的各組細胞的總蛋白,BCA法測定蛋白樣品濃度。每組分別取40 μg用以檢測相關蛋白表達量,依次進行 SDSPAGE凝膠電泳分離,轉膜,經5%脫脂牛奶(5 g脫脂奶粉溶于100 ml 1×PBST溶液中)封閉1 h后,分別以稀釋過的Gli1抗體、Bcl-2抗體、cyclinD1抗體、caspase-3抗體及β-actin抗體4℃孵育過夜,洗膜后以辣根過氧化酶標記的二抗(1∶2 000)37℃孵育1 h,再洗膜,ECL化學發光法顯影。
1.2.5 細胞免疫熒光染色 玻片滅菌處理后鋪于24孔板內,將適量細胞接種于玻片上,次日進行轉染。24 h后4%多聚甲醛室溫固定細胞15 min,加0.1%TritonX-100室溫放置30 s,經5%山羊血清蛋白室溫封閉1 h后,孵一抗,室溫孵育1 h,PBS洗滌后,以FITC標記的二抗室溫避光孵育1 h,DAPI染核,PBS再洗滌,用抗熒光淬滅液封片,熒光顯微鏡下觀察。
1.2.6 Hochest33258染色 細胞轉染48 h后,按照Hochest33258染色液說明書進行染色,用熒光顯微鏡觀察核染色及凋亡小體的情況。
1.2.7 細胞周期測定 轉染48 h后,收集細胞,70%乙醇固定,放于4℃冰箱過夜。次日,用流式細胞術進行細胞周期分析。
1.2.8 MTT法測定IC50 取對數生長期的細胞接種于96孔板上,每孔4.0×103個.轉染后6 h加入不同濃度順鉑(終濃度分別為 1、2、4、8、16 μg/ml),設三個復孔,同時設置陰性對照孔和空白對照孔。作用48 h后,每孔加入5 mg/ml四甲基偶氮唑藍(MTT)20 μl,繼續培養 4 h 后,加 DMSO 150μl/孔,震蕩10 min,酶標儀測定570 nm處的吸光度。計算順鉑對細胞的半數抑制濃度(IC50)。
1.2.9 Annexin V-FITC檢測細胞凋亡 轉染6 h后,向各組細胞加入順鉑(10 μg/ml)繼續培養48 h,用0.25% 胰酶消化收集細胞,PBS緩沖液輕輕重懸,進行Annexin V/PI雙染色測定細胞凋亡率。
1.3 統計學分析 采用SPSS18.0統計軟件進行數據處理,計量資料以表示,獨立樣本采用t檢驗,以P<0.05為差異有統計學意義。
2 結果
2.1 A549/DDP細胞耐藥指數 MTT結果表明:相同順鉑濃度下A549細胞的抑制率明顯高于A549/DDP細胞(圖1A)。A549細胞的IC50為(2.38±0.31)μg/ml,A549/DDP 細胞的 IC50 為(16.75 ±0.54)μg/ml,其耐藥指數約為 7.04(P=0.000),屬于中等耐藥細胞株(圖1B)。
2.2 Gli1在A549/DDP細胞中高表達 qPT-PCR和Western blot分別從mRNA和蛋白水平檢測兩種細胞中Gli1的表達。與A549細胞相比,A549/DDP細胞中Gli1在基因(P=0.001)和蛋白水平(P=0.008)的表達均顯著增高(圖2)。
2.3 Gli1 siRNA有效抑制A549/DDP細胞中Gli1的表達 轉染后48 h,qPT-PCR檢測Gli1 mRNA相對表達量的變化,結果顯示轉染48 h后實驗組的Gli1 mRNA水平顯著低于陰性轉染組及空白對照組(P=0.001,圖3A);Gli1蛋白的變化由Western blot和細胞免疫熒光染色來檢測,結果表明實驗組的Gli1蛋白表達量明顯低于陰性轉染組及空白對照組(P=0.001圖3B和3C)。
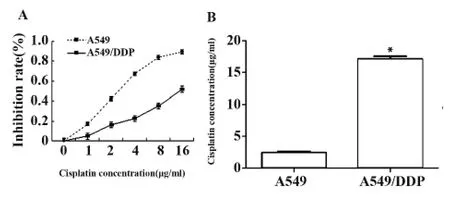
圖1 順鉑對A549及A549/DDP細胞的抑制率及IC50Fig.1 Cisplatin-inhibiting rate and DDP IC50 for A549 cells and A549/DDP cells
2.4 Gli1 siRNA對 A549/DDP細胞中 Bcl-2、cyclinD1和caspase-3蛋白表達的影響 Western blot用以檢測轉染后48 h各組細胞中Bcl-2、cyclinD1和caspase-3蛋白的表達水平。結果顯示實驗組Bcl-2、cyclinD1的表達量顯著低于陰性轉染組和空白對照組(P=0.003);而凋亡蛋白caspase-3在實驗組的表達量明顯高于在陰性轉染組和空白對照組中的表達(P=0.001,圖4)。
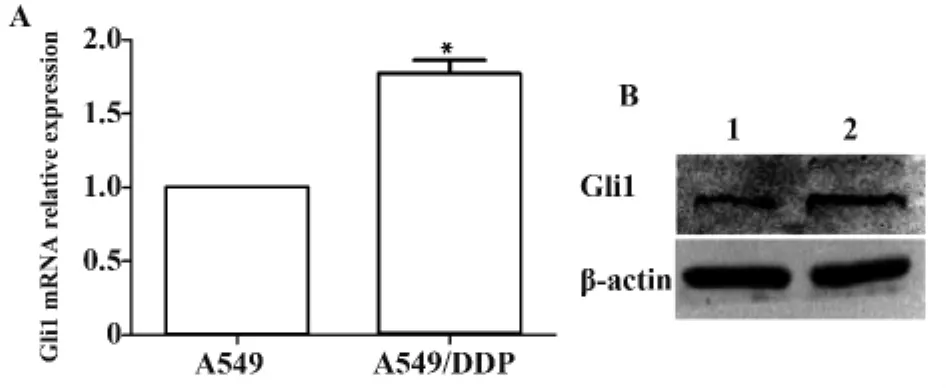
圖2 Gli1 mRNA、Gli1蛋白在A549和A549/DDP細胞中的表達Fig.2 Expression of Gli1 in A549 and A549/DDP cells

圖3 轉染Gli1 siRNA對A549/DDP細胞中Gli1表達的影響Fig.3 Inhibition of Gli1 expression by siRNA transfection
2.5 Gli1 siRNA對A549/DDP細胞自發性凋亡及細胞周期的影響 轉染48 h后,利用Hochest 33258對細胞進行染色。熒光顯微鏡下可見實驗組發生核固縮和核亮染的細胞數量明顯多于陰性轉染組及空白對照組(圖5A)。
轉染48 h后,流式細胞術測定細胞周期,各時期的細胞比例如下:實驗組:G1期(77.54% ±0.71%),S期(17.72% ±0.66%),G2(4.74% ±0.97%);陰性轉染組:G1期(62.47% ±1.15%),S期(33.50% ±1.05%),G2(4.07% ±0.38%);空白對照組:G1期(61.88% ±1.18%),S期(32.93%±1.76%),G2(5.16% ±0.61%)(P=0.000,圖5B)。實驗組有更多細胞停滯在細胞周期G1期。
2.6 沉默Gli1后A549/DDP細胞對順鉑的敏感性顯著提高 以MTT法檢測轉染Gli1 siRNA 48 h后不同濃度順鉑對A549/DDP細胞的抑制率。結果顯示:實驗組、陰性轉染組、空白對照組細胞的IC50值分別為(2.65 ±0.85)μg/ml、(12.63 ±1.11)μg/ml、(13.81±1.14)μg/ml。實驗組對順鉑的敏感性顯著提高(P=0.000,圖6A)。Annexin V-FITC法檢測轉染Gli1 siRNA 48 h后,10 μg/ml順鉑誘導的各組細胞凋亡率。結果顯示:實驗組 35.19% ±3.92%;陰性轉染組6.43% ±0.11%;空白對照組5.01%±0.77%。與陰性轉染組與空白對照組相比,沉默Gli1基因能顯著提高順鉑誘導的細胞凋亡率(P=0.000,圖6B)。
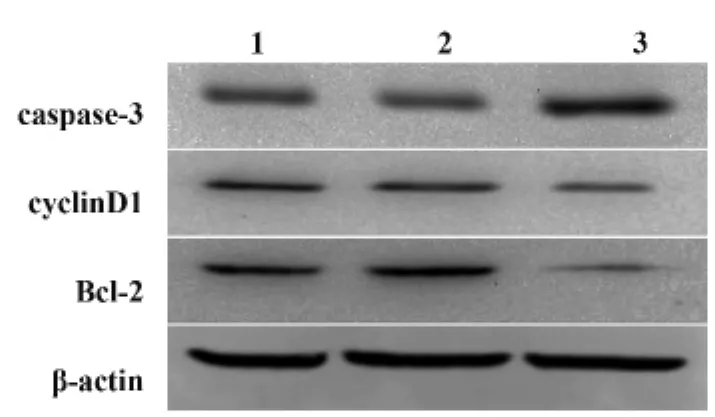
圖4 轉染 Gli1 siRNA對 A549/DDP細胞中 Bcl-2、cyclinD1和caspase-3蛋白的影響Fig.4 Effect of Gli1 depletion on expression of Bcl-2,cyclinD1 and caspase-3 proteins in A549/DDP cells.

圖5 轉染Gli1 siRNA對A549/DDP細胞自發性凋亡及細胞周期的影響Fig.5 Effects of Gli1 depletion on spontaneous apoptosis and cell cycle of A549/DDP cells

圖6 轉染Gli1 siRNA后A549/DDP細胞對順鉑敏感性的變化Fig.6 Effects of Gli1 depletion on the susceptibility of A549/DDP cells to DDP
3 討論
Gli1是一種鋅指核轉錄因子,與Shh信號通路中下游基因的特定序列結合,直接調控目的基因的轉錄表達[11]。研究表明Gli1在多種腫瘤中異常激活,參與腫瘤細胞的上皮間質轉化、侵襲與轉移、藥物耐藥等[12],內在機制都與Gli1調控其下游靶基因的表達有關。然而,Gli1的上調是否與肺癌細胞的順鉑耐藥性相關至今仍未闡明。
本實驗中,我們以耐順鉑的肺腺癌細胞A549/DDP及其親本細胞A549為細胞模型,MTT檢測得出該細胞株的耐藥指數為7.04,屬于中度耐藥。qRT-PCR、Western blot顯示與親本細胞A549相比,耐藥細胞A549/DDP中Gli1 mRNA和Gli1蛋白的表達水平均明顯上調,這預示著Gli1可能參與了肺癌細胞的順鉑耐藥。為了核實Gli1的這一作用,我們應用RNA干擾技術將Gli1 siRNA轉染至A549/DDP細胞,使Gli1在mRNA和蛋白水平都達到了顯著抑制。同時發現Gli1下游靶基因Bcl-2、cyclinD1隨著Gli1基因的沉默也出現了明顯下調,應用Hochest 33258對各組細胞進行染色,發現沉默Gli1可以誘導細胞自發性凋亡的發生。利用流式細胞術測定細胞周期,發現Gli1基因沉默后阻礙了細胞從G1期向S期的轉化,使停滯在G1期的細胞比例明顯高于對照組,這也證實了cyclinD1對細胞周期的調控作用。最后,我們應用MTT法和Annexin V-FITC法闡明了Gli1與肺癌順鉑耐藥的關系,即沉默Gli1能提高A549/DDP細胞對順鉑的敏感性。
綜上所述,我們的研究證實Gli1在耐順鉑的肺腺癌細胞株A549/DDP中異常激活。利用RNA干擾技術,我們最大限度地抑制了Gli1基因的表達,從而導致了A549/DDP細胞順鉑耐藥性的顯著逆轉。本研究首次在NSCLC細胞中探討了Gli1與順鉑耐藥的關系,為下一步建立動物耐藥模型,進行逆轉耐藥的體內實驗研究奠定了基礎。當然,腫瘤細胞耐藥的調控是一個復雜的過程,涉及多個基因,多條途徑[13],其中的機理和相互作用關系尚待進一步闡明。
[1]Viktor sson KR,Lewensohn.Apoptotic signaling pathways in lung cancer[J].J Thorac Oncol,2007,2(3):175-179.
[2]Fiaschi M,Rozell B,Bergstr?m A,et al.Development of mammary tumors by conditional expression of GLI1 [J].Cancer Res,2009,69(11):4810-4817.
[3]Gialmanidis IP,Bravou V,Amanetopoulou SG,et al.Overexpression of hedgehog pathway molecules and FOXM1 in non-small cell lung carcinomas[J].Lung Cancer,2009,66(1):64-74.
[4]Kasper M,Regl G,Frischauf AM,et al.GLI transcription factors:mediators of oncogenic Hedgehog signalling [J].Eur J Cancer,2006,42(4):437-445.
[5]Morton JP,Mongeau ME,Klimstra DS,et al.Sonic hedgehog acts at multiple stages during pancreatic tumorigenesis [J].Proc Natl Acad Sci USA,2007,104(12):5103-5108.
[6]Yoon JW.Defining a role for Sonic hedgehog pathway activation in desmoplastic medulloblastoma by identifying GLI1 target genes[J].Int J Cancer,2009,124(1):109-119.
[7]Zhang YL,Yue JR,Dong BR.Abnormal expression of caspase8,bcl-2 and cytochrome C in drug resistant lung cancer cell[J].Sichuan Da Xue Xue Bao Yi Xue Ban,2005,36(6):786-788.
[8]Huang SL,Wu Y,Yu H,et al.Inhibition of Bcl-2 expression by a novel tumor-specific RNA interference system increases chemosensitivity to 5-fluorouracil in Hela cells [J].Acta Pharmacol Sin,2010,27(2):242-248.
[9]Lei XY,Zhong M,Feng LF,et al.siRNA-mediated Bcl-2 and Bcl-xl gene silencing sensitizes human hepatoblastoma cells to chemotherapeutic drugs[J].Clin Exp Pharmacol Physiol,2007,34(5-6):450-456.
[10]Katoh YM,Katoh.Integrative genomic analyses on GLI1:positive regulation of GLI1 by Hedgehog-GLI,TGFbeta-Smads,and RTKPI3K-AKT signals,and negative regulation of GLI1 by Notch-CSLHES/HEY,and GPCR-Gs-PKA signals[J].Int J Oncol,2009,35(1):187-192.
[11]Buttitta L.Interplays of Gli2 and Gli3 and their requirement in mediating Shh-dependent sclerotome induction [J].Development,2003,130(25):6233-6243.
[12]Lauth M,Bergstr?m A,Shimokawa T,et al.Inhibition of GLI-mediated transcription and tumor cell growth by small-molecule antagonists[J].Proc Natl Acad Sci USA,2007,104(20):8455-8460.
[13]Xie J.Hedgehog signaling pathway:development of antagonists for cancer therapy[J].Curr Oncol Rep,2008,10(2):107-113.

