神經節苷脂對腦外傷大鼠大腦皮質和海馬區GAP-43表達的影響
金 玲,易建國,王春風,江興林*,李洪亮,曹湘玉
(湖南醫藥學院臨床醫學系,湖南 懷化418000)
腦性癱瘓(簡稱腦癱)是各種原因所引起的腦損傷或發育缺陷所致的運動障礙及姿勢異常的一種疾病,是繼脊髓灰質炎基本被控制之后,兒童肢體殘疾的主要疾病。 以往多從腦癱的病因、病理學研究來探討腦癱的發病機制,尚未獲理想的效果。 神經節苷脂(GM1,商品名“申捷”)是一種腦神經保護劑, 具有刺激中樞神經系統損傷后潛在的代償機制,促進“ 神經重構”(包括神經細胞的生存、軸突和突觸生長),在細胞的發育、分化、修復神經組織、神經元的可塑性等方面起著重要作用,國內尚未查到從分子生物水平研究GM1治療腦性癱瘓大鼠康復機制的文獻報道。 因此我們采用大鼠腦外傷模型,觀察應用GM1后各時間點腦外傷大鼠大腦皮質和海馬區神經細胞神經生長相關蛋白-43(growth associated protein 43,GAP-43)表達的變化,了解藥物對大腦皮質和海馬區神經細胞的保護作用,初步探討藥物干預對腦外傷大鼠受損神經功能修復的可能機制,為臨床應用藥物治療腦癱提供可靠的實驗依據。 現將方法和結果報道如下。
1 材料與方法
1.1 材料
1.1.1 動物 選取出生10 周并經適應性喂養3 d、體質量在200~250 g 的SD 大鼠200 只,來源于湖南斯萊克景達實驗動物有限公司, 合格證書號:SCXK(湘)2011-0003。 適應性喂養的飼料及屏蔽環境實驗設施由中南大學實驗動物中心 (SPF 級)提供,在光/暗周期為12 h/12 h(光照時間7:00-9:00)的條件下飼養于籠中,自由獲得飼料和飲水。
1.1.2 藥物 神經節苷脂(GMl,商品名“申捷”,北京四環制藥有限公司生產,生產批號:4010531,注射劑,2 mg/mL)。
1.1.3 主要儀器和試劑 芬蘭352 型352017148 酶標分析儀,芬蘭AC8 型洗板機。GAP-43 酶聯免疫分析試劑盒,批號:2010207,購自北京永輝生物科技有限公司。
1.2 方法
1.2.1 動物分組 200 只大鼠隨機分為假手術組60 只,GM1組和模型組各70 只。
1.2.2 動物造模 腦外傷造模方法按楚勝華等[1]運用特制的造模打擊裝置, 以自由落體撞擊致使動物腦外傷模型。 大鼠手術與腦外傷造模前禁食8 h,實驗時將大鼠俯臥位固定于腦立體定向儀上, 消毒頭部皮膚,按0.35 g/kg 腹腔內注射10%水合氯醛進行麻醉,正中切開頭皮后剝離骨膜,充分暴露右頂骨,用牙科鉆在冠狀縫后1.5 mm、 中線旁2.5 mm 處鉆一直徑5 mm 的骨窗,并保持硬膜完整。 假手術組:不施加砝碼撞擊即封閉頭皮,未致腦外傷。 模型組和GM1組:用20 g 砝碼于30 cm 高處墜落,撞擊撞桿從而撞擊硬膜,致右頂葉中度腦挫裂傷,最后封閉頭皮。 術后蘇醒再帶回到原飼養處喂養,并按楚勝華的曠野試驗等[1]行為學測評標準確定大鼠腦受損的行為學表現,實驗完成后剩余腦外傷大鼠一律處死。
1.2.3 給藥方法 假手術組、 模型組均按20 mL/(kg·d) 腹 腔 注 射 生 理 鹽 水;GM1組 給 予 濃 度 為2 mg/mL 的GM1注射液按20 mL/(kg·d)腹腔注射,以上各組每天1 次,術前連續注射3 d。
1.2.4 標本采集 (1) 造模后在0、2、4、8、12、16、24 h 時間點,分別在各組中提出6 只大鼠,以頸動脈取血后處死大鼠;(2)采大腦皮質組織標本方法:剪斷頭顱,沿正中線切開頭皮,剝開顱骨,暴露完整的大腦組織,撕開硬腦膜后,用彎鑷取出大腦最外層頂葉皮質放入標記好的冰凍管, 經液氮速凍后,放入-80 ℃冰箱保存;(3) 采大腦海馬組織標本方法:取腦并切除下丘腦,剪斷前聯合,切除小腦和腦干,沿大腦矢狀裂將大腦半球縱行切開,剝離枕葉內側丘腦及紋狀體,暴露邊緣系統,用小藥匙輕輕剝離雙側海馬組織, 放入凍存管, 經液氮速凍后,于-80 ℃保存;(4)所有的標本處理好后,分別稱取各份標本2 g, 加入pH 7.4 的磷酸鹽緩沖液2 mL中, 將標本充分研成勻漿,2 000 r/min 離心20 min,收集上清液,分裝后冷凍備用。
1.3 檢測指標
1.3.1 GAP-43 檢測 按GAP-43 酶聯免疫分析試劑盒操作使用說明進行測量。 即通過包被、加樣、加酶標抗體、加底物液顯色、終止反應,在酶標儀上于450 nm 波長處,以空白管調零測定吸光度值,通過標準曲線計算大鼠樣品中GAP-43 濃度。
1.3.2 動物行為學檢測 分別于術后第1~5 天時間點,由3 組隨機各取6 只實驗大鼠,在標本采集前進行運動功能計分檢測,通過不自主動作、曠場試驗、傾斜板試驗、拒俘反應檢測測試肢體肌力、隨意運動和情感行為能力[2]。
1.4 統計學分析
2 結果
2.1 各組大鼠不同時間點大腦皮質區GAP-43 表達的比較
與假手術組 0~24 h 的GAP-43 表達比較,模型組明顯高于假手術組, 差異有統計學意義 (P<0.01),但GM1組隨著時間的增加而升高,至24 h 已達模型組水平;GM1組大鼠大腦皮質區8~24 h GAP-43 的表達明顯高于假手術組, 差異有統計學意義(P<0.01)。 GM1組與模型組同時間點比較(P<0.01)。 結果見表1。
2.2 各組大鼠不同時間點大腦海馬區GAP-43 表達的比較
與假手術組大鼠大腦海馬區0~24 h 的GAP-43 表達,模型組各時間點均明顯升高,差異有統計學意義 (P<0.01);GM1組大鼠大腦海馬區GAP-43的表達與模型組比較,差異有統計學意義(P<0.01)。結果見表2。
表1 各組大鼠術后不同時間點大腦皮質區GAP-43 表達的比較 (n=6,±s,ng/L)

表1 各組大鼠術后不同時間點大腦皮質區GAP-43 表達的比較 (n=6,±s,ng/L)
注:與假手術組比較△△P<0.01;與模型組同時間點比較**P<0.01。 表2 同。
組 別假手術組模型組GM1 組0 h 2 525.4±179.9 3 539.6±267.4△△2 679.6±164.1**2 h 2 837.0±359.3 3 547.2±115.6△△2 703.2±115.6**4 h 2 730.9±256.6 3 262.5±306.4△△2 726.2±191.3**8 h 2 555.0±296.2 3 748.3±197.8△△2 747.5±270.0**△△12 h 2 744.5±256.9 3 935.2±102.3△△2 946.7±174.5**△△16 h 2 458.3±189.0 3 559.2±235.6△△3 045.6±208.4**△△24 h 2 867.8±361.2 3 132.8±109.9△△3 185.8±186.9△△
表2 各組大鼠術后不同時間點大腦海馬區GAP-43 表達的比較 (n=6,±s,ng/L)

表2 各組大鼠術后不同時間點大腦海馬區GAP-43 表達的比較 (n=6,±s,ng/L)
組 別假手術組模型組GM1 組0 h 2 643.7±361.6 3 188.6±206.7△△2 875.5±317.2**2 h 2 598.7±393.8 4 465.0±391.5△△2 795.1±289.3**4 h 2 471.8±275.7 3 958.8±366.8△△2 698.9±252.3**8 h 2 576.3±279.4 3 036.9±364.4△△2 611.5±280.9**12 h 2 849.4±277.5 3 571.8±110.9△△2 641.2±133.9**16 h 2 561.3±101.3 3 384.4±285.9△△2 663.4±189.9**24 h 2 744.4±322.4 3 644.6±308.8△△2 694.8±130.3**
2.3 各組大鼠不同時間點行為學檢測評分比較
假手術組大鼠運動能力術后第1~5 天不同時間點都是較強的, 得分顯著高于模型組和GM1組(P<0.01)。 GM1組大鼠手術后2~5 d 運動能力逐步增強,且明顯高于模型組(P<0.05)。 結果見表3。
表3 各組大鼠術后不同時間點行為學評分的比較 (±s,分)
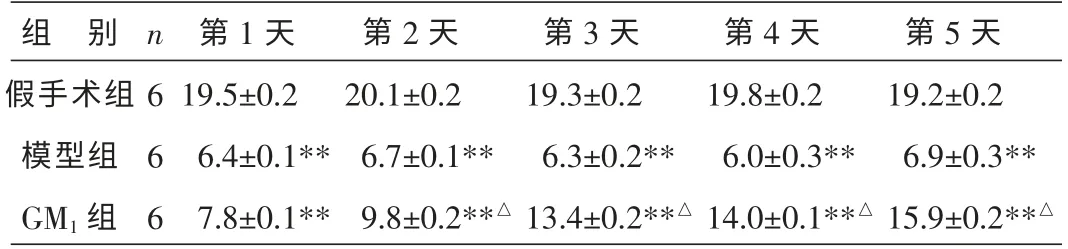
表3 各組大鼠術后不同時間點行為學評分的比較 (±s,分)
注:與假手術組同時間點比較**P<0.01;與模型組同時間點比較△P<0.05。
組 別假手術組模型組GM1 組n 6 6 6第1 天19.5±0.2 6.4±0.1**7.8±0.1**第2 天20.1±0.2 6.7±0.1**9.8±0.2**△第3 天19.3±0.2 6.3±0.2**13.4±0.2**△第4 天19.8±0.2 6.0±0.3**14.0±0.1**△第5 天19.2±0.2 6.9±0.3**15.9±0.2**△
3 討論
GAP-43 是一種特異性胞膜磷酸蛋白, 參與軸突的生長、突觸發育形成和神經再生,在神經再生時呈高表達狀態,但隨著損傷修復時間的延長而逐漸回落,直至再生完成。因此GAP-43 被很多學者認為是研究腦損傷修復的首選標志物之一[3]。 有研究證實,GAP-43 表達增加可以促進培養細胞和在體的軸突生長[4];Haynes 等[5]發現腦室周圍白質軟化(PVL) 大鼠壞死灶區域可以檢測到GAP-43 的表達, 說明該處的組織壞死可以導致GAP-43 保護性的表達上調;Farina V 等[6]研究表明GAP-43 在應激效應后3 d 才出現表達高峰;林棟等[7]實驗發現缺血缺氧大鼠治療7 d 后取材,GAP-43 表達水平未有顯著變化,說明取材時間點的不同會影響實驗結果的分析。
參考以上文獻,該實驗設計充分考慮了腦外傷治療中藥物干預特點, 并結合不同時間的作用結果, 即在干預研究中動態地納入時間因素分析,在不同療法的多個時間點上觀測指標的動態變化,從而客觀地反映不同干預方法對研究對象的影響。 在實驗過程中動用了200 只大鼠,手術腦外傷造模前3 d 開始給藥GM1注射液和生理鹽水,每天1 次,連續3 d。 運用GM1的目的既可增強神經營養因子活性,又可減輕造模時大鼠神經細胞變性、壞死和凋亡,希望能增加動物造模的成功系數。 因此,采用這些保護性措施,注射了GM1注射液的GM1組自然死亡的大鼠較少,模型組死亡的大鼠較多,這說明在腦損傷動物實驗中,預防性的給藥GM1可提高腦損傷大鼠造模的成功率,降低死亡率,本實驗中各組死亡率比較已另有論文發表[8]。
實驗結果表明:GM1組大鼠大腦皮質0~16 h 和海馬區0~24 h GAP-43 的表達均低于模型組,有顯著差異;行為學表現優于模型組。GM1組大鼠大腦皮質GAP-43 0~4 h 的表達與假手術組比, 差異無統計學意義,8~24 h 表達升高且明顯高于假手術組,這說明造模前用藥GM1對腦損傷起到了保護作用,故行為學表現優于模型組。 大鼠大腦海馬區GAP-43 的表達0~24 h 均無明顯上升,說明GM1對海馬區無明顯作用。GM1組大腦皮質GAP-43 8~16 h 表達逐步上升,大于假手術組,低于模型組,至24 h達到模型組水平,這說明GM1延緩了GAP-43 的表達高峰,這和Farina V 等[6]的觀點即GAP-43 表達要在腦損傷后3 d 才出現表達高峰較為一致。
該研究結果證實:預防性使用GM1可以有效地促進實驗性腦外傷大鼠大腦皮質GAP-43 的表達升高,降低腦損傷的程度,增強腦外傷動物行為學表現。 因此, 該研究提示是否能在臨床上盡早使用GM1,最好在產婦住院生產前預防性使用GM1,從而有效阻斷腦損傷的發生、發展,或者降低腦損傷患兒病死率和致殘率。 該研究為腦損傷的預防以及臨床治療提供了新的思路和研究基礎。
[1]楚勝華,陳二濤,馮東福,等.腦外傷后抑郁狀態模型的建立及效果評價[J].中華急診醫學雜志,2012,21(7):718-724.
[2]王 哲,伍明輝,鐘炳武,等.腦靈湯對阿爾茨海默病大鼠模型行為學及海馬CA3 區小膠質細胞和IL-6 表達的影響[J].中南大學學報(醫學版),2013,38(2):113-119.
[3]郭 敏,李 剛.突觸可塑性相關蛋白的研究進展[J].神經藥理學報,2013,3(6):57-64.
[4]劉 健,楊小玉,楊茂光,等.中樞神經損傷后GAP-43 蛋白對神經再生及軸突導向作用及其機制的研究進展[J]. 吉林大學學報(醫學版),2013,39(1):180-183.
[5]Haynes R L,Billiards S S,Borenstein N S, et al. Diffuse axonal injury in periventricular leukomalacia as determined by apoptotic marker fractin [J]. Pediat Res,2008,63(6):656-661.
[6]Farina V,Gadau S,Lepore G, et a1. Growth-associated protein expression in the frontal and occipital cortices of callosotomized rats [J]. Funct Neuro,2004,19(3):181.
[7]林 棟,闕秀琴,張學君,等.針刺與運動療法不同干預次序對缺血缺氧大鼠皮層GAP-43 表達的影響[J].時珍國醫國藥,2011,7(22):1 768-1 770.
[8]金 玲,黃民江,李洪亮,等.神經節苷脂對實驗性顱腦外傷大鼠的保護作用及機制[J].中國康復醫學雜志,2013,12(28):1 142-1 145.
圖1 Masson 三色染色皮膚組織圖(×200)

