左歸降糖解郁方對大鼠海馬神經元細胞的保護作用
張秀麗,王宇紅*,楊 蕙,徐雅蘭
(1.湖南中醫藥大學,湖南 長沙410208;2.湖南省中藥粉體與創新藥物省部共建國家重點實驗室培育基地,湖南 長沙410208;3.湖南中醫藥大學第一附屬醫院中藥藥理(心血管)實驗室,湖南 長沙410007)
糖尿病是一種常見的慢性疾病, 我國約有1.43 億人患有糖尿病, 糖尿病患者易并發抑郁癥, 其患抑郁癥的可能性是普通人的3~5 倍,復發率是非糖尿病患者的8 倍[1]。 而糖尿病并發抑郁癥(Diabetes mellitus with depression,DD)患者的自殺危險性高達10%[2],遠高于普通抑郁癥患者。 目前尚無一種模型能夠完全模擬人類DD 的臨床癥狀與體征,極大限制了DD 發病機制和藥物研究。本課題組在前期研究過程中, 基于臨床病人發病特征,采用復合式高脂灌胃、 鏈脲佐菌素(streptozotocin,STZ)注射和慢性應激“三聯法”,建立了一種簡便、可靠、穩定而又有與人類DD 相似癥狀的動物模型[3]。 但是,僅有動物模型,很難全面闡釋某一疾病的發生發展機制。 DD 發生發展的關鍵靶器官是海馬組織中的海馬神經元細胞,該細胞的損傷都是微觀的,在體實驗中很難觀察,只有進一步通過建立DD細胞模型, 才能全面闡明DD 損傷海馬神經元細胞的機制。 但國內外僅有糖尿病細胞模型以及抑郁癥細胞模型,DD 的細胞模型尚未見報道。 李靜等[4]采用CORT(100 μM/L)損傷原代海馬神經元細胞,模擬應激狀態下高濃度糖皮質激素導致的海馬神經元細胞損傷。 與我們前期經CORT 誘導建立抑郁癥細胞的實驗結果相吻合。 因此我們利用高糖(75 mM/L)聯合CORT(100 μM/L)誘導原代海馬神經元細胞建立DD 細胞模型。 左歸降糖解郁方是針對DD 中醫“虛、瘀、郁”基本病機的有效方藥,近年來本課題組對左歸降糖解郁方對DD 的干預進行了較深入的研究,如細胞模型復制及中藥干預[3,5-6]。 本實驗采用復方中藥左歸降糖解郁方對DD 細胞模型進行干預,探討中醫藥治療DD 療效,為其提供新思路,現將方法與結果報道如下。
1 材料
1.1 動物
SPF 級SD 懷孕大鼠(受孕19 d)1 只與SPF 級SD 大鼠(體質量約200~220 g)30 只購于湖南斯萊克景達實驗動物有限公司, 許可證號:SCXK (湘)2011-0003。
1.2 藥物
左歸降糖解郁方:黃芪18 g,熟地黃15 g,枸杞12 g,山茱萸12 g,丹參12 g,姜黃9 g,菟絲子9 g,杜仲9 g,牛膝9 g,牡丹皮6 g,貫葉連翹3 g。原材料購自湖南中醫藥大學第一附屬醫院,并由該院制劑科按比例水煎濃縮后制成口服液100 mL,采用一測多評的質量控制方法,其含主要藥效成分分別為黃芪甲苷≥30 μg/mL、 貫葉金絲桃素≥18 μg/mL、 姜 黃 素≥0.4 mg/mL、 丹 酚 酸B ≥1.2 mg/mL、 丹皮酚≥0.2 mg/mL; 鹽酸二甲雙胍片(規格0.25 g/片,批號1303106,湖南湘雅制藥有限公司); 鹽酸氟西汀膠囊 (規格20 mg/粒, 批號0972A,法國Patheon France)。
1.3 主要試劑
皮質酮、L-多聚左旋賴氨酸、 二甲亞砜(Sigma,美國);胰蛋白酶、噻唑藍(MTT) (AMRESCO,美國);膠原酶、D-葡萄糖、DMEM/F12、B27 添加劑、Neurolbasal、胎牛血清(Gibco,美國);NMDAR2A 一抗、二抗(Ambo 試劑公司分裝);羊抗兔IgG(二抗)(PROTEINIECH, 美國);TUNEL 試劑盒 (Boehringer,德國);DAB 顯色試劑盒、SABC 免疫組化試劑盒 (武漢博士德生物工程有限公司);Penicillin、Streptomycin(碧云天生物技術研究所);葡萄糖氧化酶-過氧化物酶(GOD-POD)試劑盒(中生北控生物科技股份有限公司);NSE 免疫組化試劑盒(北京博奧森生物技術有限公司)。
1.4 主要儀器
DMIRB 倒置熒光顯微鏡(Leica);TECAN 酶標定量測試儀 (瑞士Bio-Rad);3110 CO2細胞培養箱(Thermo Scientific Forma);BIX-103G 解 剖 顯 微 鏡(北京陸希科技有限公司);JA1003N 電子天平(天津精密科學儀器有限公司)。
2 方法
2.1 含藥血漿的制備
將SPF 級SD 大鼠30 只分為空白組、二甲雙胍合氟西汀組及左歸降糖解郁方組 (每組10 只)用于制備含藥血漿。 給藥劑量按前期動物實驗結果[5],即二甲雙胍按0.18 g/kg、氟西汀按1.8 mg/kg、左歸降糖解郁方按20.53 g/kg 給藥,1 天2 次,連續3 d,末次給藥1 h 后處死動物取含藥血漿。 空白組給予相同劑量的蒸餾水后取血漿作為空白血漿。
2.2 細胞培養
將受孕19 d 的SD 大鼠處死后,取出8 只胎鼠的海馬組織迅速投入盛有無菌PBS 緩沖液 (1 ℃)的培養皿中,加入與無菌PBS 等體積的0.25%胰蛋白酶和0.2%膠原酶, 輕輕吹打30~50 次,37 ℃消化,每隔3~5 min 手動輕輕混勻1 次,消化至無明顯組織沉淀后加入培養液終止消化,混勻,100 目篩網過濾,1 000 r/min 離心5 min 收集細胞。 調整細胞濃度為2×105/mL,按100 μL/孔接種至96 孔板,分4 組(即空白組、模型組、二甲雙胍合氟西汀組及左歸降糖解郁方組), 每組4個復孔,37 ℃、5%CO2培養箱中培養, 以后每隔3 d 換1 次維持培養液。海馬神經元細胞培養約7 d, 至觀察到由增大的神經元胞體、明顯的光暈、延長的突起形成較為復雜的網絡[3]。
2.3 細胞模型建立
將“2.1”接種的模型組與給藥組細胞加入高糖(75 mM) 聯合100 μM 皮質酮建立DD 細胞模型[4],空白組加入葡萄糖濃度至25 mM。
2.4 給藥方法及給藥劑量
于“2.2”各組細胞中加入空白血漿及含藥血漿,體積為25 μL/孔。
2.5 指標檢測
2.5.1 海馬神經元細胞一般形態學觀察 分別于接種后第6 h、24 h、3 d、7 d 用倒置顯微鏡對海馬神經元細胞進行一般形態學觀察,并拍照。
2.5.2 神經元特異性烯醇化酶(NSE)法鑒定神經細胞純度 培養7 d 的大鼠海馬神經元利用NSE 免疫細胞化學染色試劑盒進行純度鑒定,海馬神經元經染色呈彌漫性胞漿著色者為陽性細胞[5],隨機選取視野中200個細胞統計陽性細胞比率。
2.5.3 MTT 法檢測神經細胞活性 “2.2”項下各組細胞經“2.3”、“2.4”處理后,每孔加入20 μL MTT溶液,分別于6、12、24、48 h 及72 h 運用酶標儀于波長490 nm 測定各孔的OD 值。 細胞活性計算方法如下:
細胞存活率(%)=OD490(實驗組)/OD490(對照組)×100%
2.5.4 HE 染色觀察神經細胞損傷狀況 將分離的海馬神經元細胞均勻接種在放有14 mm 圓形蓋玻片的24 孔板中,培養7 d 后按分組情況參照“2.3”、“2.4” 加入不同誘導物與含藥血漿, 孵育24 h 后,HE 染色觀察各組海馬神經元的病理改變。
2.5.5 TUNEL 染色檢測細胞凋亡情況 將分離的海馬神經元細胞按“2.5.4”的方法做前期處理。 待藥物干預24 h 后,取出培養有細胞的蓋玻片置于4%的中性甲醛中固定10 min, 用PBS 緩沖液清洗2次,TUNEL 染色試劑盒染色。 光鏡下隨機取15個高倍鏡視野觀察。
2.5.6 GOD-POD 法檢測葡萄糖消耗量 將分離的海馬神經細胞植入96 孔板并參照“2.5.3”的方法進行相應藥物處理, 分別于孵育2、6、12、18、24 h 后按照各時間點收集各組細胞培養液,37 ℃保溫10 min, 用葡萄糖測定試劑盒在酶標儀于波長505 nm 檢測培養液OD 值 (理論計算公式:C樣本=△A 樣本/△A 校準×C校準,其中C校準=5.55 mM/L)。
2.6 統計學分析
采用SPSS 17.0 軟件進行統計學分析,所有數據以“±s”表示,兩組間的比較采用t 檢驗,多組間比較采用單因素方差分析(ANOVA)。 P<0.05 為差異有統計學意義。
3 結果
3.1 海馬神經元細胞一般形態觀察
顯微鏡下觀察發現, 大部分細胞在接種6 h 就已貼壁,圓球狀,小且透明,少量細胞有微小突起;培養24 h 后細胞完全貼壁, 有明顯光暈, 突起較6 h時稍有見長;培養的第3 天,神經元突起進一步拉長且數量明顯增多,交織構成較為稀松的網絡;培養的第7 天,神經元胞體繼續增大,周圍光暈顯著,突起延長,形成繁雜而緊密的神經元網絡。 結果見封三彩圖圖1 所示。
3.2 NSE 神經細胞鑒定結果
培養7 d 的大鼠海馬神經元胞體及樹突著色良好, 視野下海馬神經元NSE 染色陽性的細胞比率在93%以上,表明分離的海馬神經元純度高。 結果見封三彩圖圖2 所示。
3.3 神經細胞活性MTT 檢測結果
與空白組相比,各時間點模型組、二甲雙胍合氟西汀組及左歸降糖解郁方組海馬神經元細胞存活率均明顯降低,所有時間點均有顯著性統計學意義(P<0.01);與模型組相比,左歸降糖解郁方組、二甲雙胍合氟西汀組細胞存活率在第24、48 h 及72 h 均明顯增加,差異具有統計學意義(P<0.05 或P<0.01);與二甲雙胍合氟西汀組相比,左歸降糖解郁方組海馬神經元細胞存活率在6、12、24、48 h時與其作用相當, 但在72 h 時增加更明顯 (P<0.05)。 見表1。
表1 MTT 法檢測各組不同時間點的細胞存活率 (±s,n=5,%)
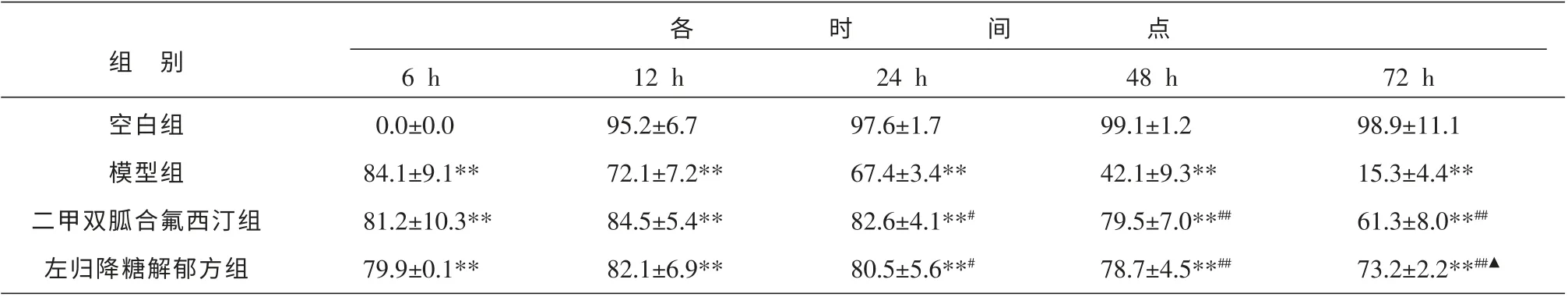
表1 MTT 法檢測各組不同時間點的細胞存活率 (±s,n=5,%)
注:與空白組比較**P<0.01;與模型組比較#P<0.05,##P<0.01;與二甲雙胍合氟西汀組比較▲P<0.05。
組 別空白組模型組二甲雙胍合氟西汀組左歸降糖解郁方組6 h 0.0±0.0 84.1±9.1**81.2±10.3**79.9±0.1**12 h 95.2±6.7 72.1±7.2**84.5±5.4**82.1±6.9**24 h 97.6±1.7 67.4±3.4**82.6±4.1**#80.5±5.6**#48 h 99.1±1.2 42.1±9.3**79.5±7.0**##78.7±4.5**##72 h 98.9±11.1 15.3±4.4**61.3±8.0**##73.2±2.2**##▲各時間點
3.4 HE 病理染色結果
鏡下觀察發現,空白組海馬神經元細胞的細胞核成卵圓形,極少數成梭形,且細胞質、細胞核界線分明;模型組絕大多數細胞核呈梭形,近半數海馬神經元細胞的細胞核、細胞質已融合在一起,界線模糊;其余兩組的損傷程度介于空白組和模型組之間。 結果見封三彩圖圖3 所示。
3.5 細胞凋亡情況
空白組TUNEL 染色陽性細胞極為少見, 在所選取的15個視野中僅見數個陽性細胞; 模型組免疫陽性細胞較多, 每個高倍鏡視野可見4~5個;左歸降糖解郁方組和二甲雙胍合氟西汀組免疫陽性細胞數明顯減少,每個高倍鏡視野只見2個左右陽性細胞,細胞核深染呈藍黑色,形態不規則,有的呈花瓣狀。 結果見封三彩圖圖4 所示。
3.6 各組海馬神經元細胞葡萄糖消耗量比較
與空白組比較,模型組葡萄糖消耗量于各時間點均有顯著降低(P<0.01);與模型組比較,左歸降糖解郁方組和二甲雙胍合氟西汀組葡萄糖濃度降低值升高, 并從12 h 開始差異均有顯著性統計學意義(P<0.01);與二甲雙胍合氟西汀組比較,在24 h時,左歸降糖解郁方組培養基中葡萄糖濃度降低值稍高于二甲雙胍合氟西汀組,但差異無統計學意義(P>0.05)。 結果見表2。
4 討論
近年來研究表明,海馬是學習、認知功能主要控制區,且參與了許多神經系統病變機制,而DD 的損傷部位主要在海馬[6],所以利用海馬細胞建立DD損傷模型,研究損傷機制并觀察藥物對海馬神經細胞的保護作用具有重要意義。 目前國內外采用高糖誘導糖尿病模型最為廣泛[7],也有許多學者[4]采用皮質酮損傷原代海馬神經元細胞,模擬應激狀態下高濃度糖皮質激素導致的海馬損傷來建立抑郁癥細胞模型。 故本實驗采用二者聯合的方法,采用高糖聯合皮質酮誘導建立DD 細胞模型。
表2 各組不同時間點培養基中葡萄糖濃度降低值 (±s,n=5,mmol/L)
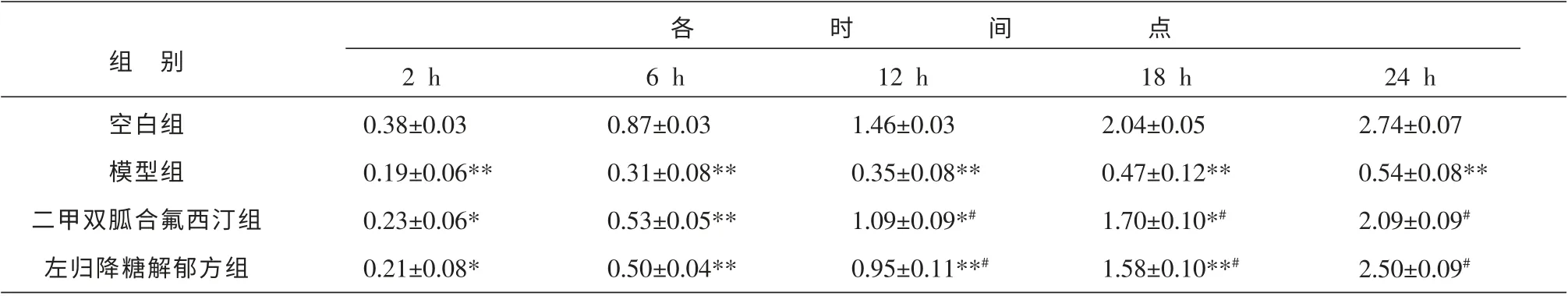
表2 各組不同時間點培養基中葡萄糖濃度降低值 (±s,n=5,mmol/L)
注:與空白組比較*P<0.05,**P<0.01;與模型組比較#P<0.01。
組 別空白組模型組二甲雙胍合氟西汀組左歸降糖解郁方組2 h 0.38±0.03 0.19±0.06**0.23±0.06*0.21±0.08*6 h 0.87±0.03 0.31±0.08**0.53±0.05**0.50±0.04**12 h 1.46±0.03 0.35±0.08**1.09±0.09*#0.95±0.11**#18 h 2.04±0.05 0.47±0.12**1.70±0.10*#1.58±0.10**#24 h 2.74±0.07 0.54±0.08**2.09±0.09#2.50±0.09#各時間點
本研究結果顯示,與空白組比較,模型組各時間點細胞存活率明顯降低;海馬神經元細胞損傷顯著;TUNEL 染色陽性細胞即凋亡細胞增多; 葡萄糖濃度降低值從2 h 開始明顯低于空白組(P<0.01);該特征既符合糖尿病細胞模型又與抑郁癥細胞模型相一致,表明采用高糖聯合皮質酮方法可成功建立DD 細胞模型。
左歸降糖解郁方以張景岳的左歸飲、左歸丸為基礎方化裁而成,方中熟地黃為君滋養腎陰,山茱萸、枸杞為臣,合君藥以加強滋補腎陰作用,佐以菟絲子、牛膝、杜仲補肝腎,黃芪健脾益氣,丹參、牡丹皮活血散瘀,加入化瘀行氣、疏肝解郁的姜黃、貫葉連翹,功能滋陰益氣,化瘀解郁。 本課題組前期臨床研究表明, 左歸降糖解郁方能明顯緩解DD 患者抑郁狀況以及血糖、血脂、胰島素的升高,實驗研究發現其能明顯改善DD 大鼠糖脂代謝紊亂、 延緩海馬組織的病理損傷[3,5-6]。
本研究采用MTT 法檢測海馬神經元活性,結果顯示左歸降糖解郁方組細胞存活率在第24 h、48 h及72 h 均明顯高于模型組(P<0.05 或P<0.01),且其在72 h 時也較二甲雙胍合氟西汀組高(P<0.05);HE染色后鏡下觀察發現:左歸降糖解郁方組細胞損傷程度介于空白組和模型組之間。TUNEL 染色發現左歸降糖解郁方組免疫陽性細胞數明顯減少,每個高倍鏡視野只見2個左右陽性細胞,且細胞形態較模型組好。 以上結果說明,左歸降糖解郁方可有效保護糖尿病合并抑郁癥細胞模型中產生的細胞損傷,可明顯提升細胞存活率,抑制細胞凋亡。 GOD-POD法檢測結果顯示, 左歸降糖解郁方從12 h 起即可明顯增加海馬神經細胞的葡萄糖消耗量(P<0.01)。
綜上所述, 左歸降糖解郁方對DD 模型海馬神經細胞模型具有明顯的保護作用。 該研究結果將為左歸降糖解郁方治療糖尿病合并抑郁癥的有效性提供體外細胞實驗佐證,該研究結果也將為進一步結合體內試驗研究左歸降糖解郁方的中藥干預的分子機制奠定基礎。
[1]Egede LE, Ellis C. Diabetes and depression:Global perspectives[J]. Diabetes Res Clin Pr,2010,87(3):302-312.
[2]Franois P. Should we screen for emotional distress in type 2 diabetes mellitus[J]. Nat Rev Endocrinol,2009,5(12):665-671.
[3]Wang YH,Yin LT,Yang H, et al. Hypoglycemic and anti depressant effects of Zuogui Jiangtang Jieyu formulation in a model of unpredictable chronic mild stress in rats with diabetes mellitus [J]. Exp Ther Med,2014(8):281-285.
[4]李 靜,田 燕,陳紅霞,等.小補心湯總黃酮含藥血清對皮質酮損傷神經細胞的保護作用[J].軍事醫學,2011,35(10):765-768.
[5]王宇紅.左歸降糖解郁方對糖尿病并發抑郁癥大鼠血糖血脂的影響[J].中草藥,2014,4(11):1 602-1 606.
[6]楊 蕙. 糖尿病并發抑郁癥動物模型的建立及中藥保護作用[D].長沙:湖南中醫藥大學,2013.
[7]易 屏. 小檗堿抑制核因子NF-κB p65 表達及轉位改善游離脂肪酸誘導的3T3-L1 細胞胰島素抵抗的分子機制[J].中國中西醫結合雜志.2007,27(12):1 099-1 103.

