Pak1在小鼠卵母細胞紡錘體形成中的相關性
李秀紅,張獻彩,周德山*,馬 偉*
(1.首都醫科大學 基礎醫學院 組織學與胚胎學教研室,北京 100069;2.邢臺醫學高等專科學校解剖學教研室,河北 邢臺 054000)
Pak1在小鼠卵母細胞紡錘體形成中的相關性
李秀紅1,張獻彩2,周德山1*,馬 偉1*
(1.首都醫科大學 基礎醫學院 組織學與胚胎學教研室,北京 100069;2.邢臺醫學高等專科學校解剖學教研室,河北 邢臺 054000)
目的研究自動磷酸化Pak1在小鼠卵母細胞減數分裂過程中的亞細胞定位模式及其在紡錘體形成中的相關性。方法用Western blot檢測Ser144位點自動磷酸化的Pak1(pPak1S144)的蛋白表達量的動態變化;免疫熒光染色追蹤pPak1S144的亞細胞定位模式及其與紡錘體和微管組織中心蛋白之間的時空關系。結果在小鼠卵母細胞內pPak1S144持續穩定地表達于減數分裂各期,pPak1S144與中心粒周圍蛋白(pericentrin)和γ微管蛋白(γ-tubulin)在時空上呈現緊密的共定位關系并特異地定位于紡錘體兩極。結論pPak1S144是小鼠卵母細胞MTOC相關蛋白,提示其與減數分裂紡錘體形成相關。
pPak1S144;卵母細胞;減數分裂;微管組織中心;紡錘體
卵母細胞減數分裂過程中染色體分離錯誤會導致產生非整倍體(aneuploidy) 胚胎,是流產和出生缺陷的最常見原因[1]。哺乳動物卵母細胞沒有中心粒,其紡錘體的形成依賴于微管組織中心(microtubule organizing centers, MTOC)[2]。研究證實卵母細胞內γ-tubulin和Pericentrin是MTOC核心成分,前者催化微管的形成和釋放[3],后者參與形成MTOC結構平臺。
P21-activated kinase (Pak1)是一種Ser/Thr蛋白激酶,參與細胞骨架的組織、細胞形態維持和細胞生存等過程[4]。Pak1在Ser144位點發生自動磷酸化,對于Pak1活性的維持有重要的作用[5]。有研究證實Pak1與小鼠卵母細胞減數分裂紡錘體的穩定性相關,但其自動磷酸化活性在卵母細胞減數分裂過程中的形態和作用仍需進一步探討[6]。
1 材料與方法
1.1 材料
清潔級雌性21~23日齡C57BL/6與BALB/C雜交后的F1代(CB6F1)小鼠,體質量10~15 g[由北京維通利華實驗動物技術有限公司提供,許可證編號SCXK(京)2012-0001]。兔抗Ser144位點磷酸化的PAK1(pPak1S144)單克隆抗體(Abcam公司),鼠抗Ace-tubulin單克隆抗體、鼠抗γ-tubulin單克隆抗體(Sigma公司),鼠抗Pericentrin單克隆抗體(BD公司),胎牛血清(Gibco公司),孕馬血清促性腺激素、人絨毛膜促性腺激素(寧波第二激素廠),40% Acrylamide/Bis Solution 29∶1(3.3%C)(Bio-Rad公司),Pre-stained Marker(Thermo公司),PVDF膜(Amersham HybondTM公司)
1.2 方法
1.2.1 小鼠卵母細胞收集和培養:給CB6F1代雌性小鼠腹腔注射10 IU孕馬血清促性腺激素,44~48 h后以CO2窒息處死小鼠,收集卵丘-卵母細胞復合體(cumulus cell-oocyte complexes,COC),體外培養至不同時期[7]。
1.2.2 蛋白免疫印跡 (Western blot):卵母細胞脫去卵丘后收集在含有蛋白酶抑制劑(protease inhibitor cocktail)的緩沖液(Laemmli Sample Buffer)中,在100 ℃沸水中處理5 min;樣品利用10%丙烯酰胺0.1%十二烷基磺酸鈉的凝膠分離,之后轉移到聚偏氟乙烯膜上,聚偏氟乙烯膜在封閉后轉入適當稀釋的一抗溶液中4 ℃過夜;聚偏氟乙烯膜漂洗后,二抗孵育液中孵育,然后暗室曝光。
1.2.3 免疫熒光染色(Immunofluorecent staining):卵母細胞在2%多聚甲醛0.5%曲拉通X-100的PEM緩沖液(100 mmol/L Pipes,1 mmol/L MgCl2,1 mmol/L乙二醇二乙醚二胺四乙酸,pH 6.9)中固定45 min, 1%牛血清蛋白中漂洗和封閉后,一抗4 ℃過夜。兔抗pPak1S144抗體(1∶3 000)、鼠抗Acetylated-tubulin抗體(1∶12 000)、鼠抗γ微管蛋白的抗體(1∶3 000)和鼠抗中心粒周圍蛋白的抗體(1∶3 000)。漂洗后利用Alexa Flour 488或555標記的二抗避光孵育1 h,DNA用DAPI標記封片。使用Olympus(D7)結合軟件ImageJ進行拍照和分析。
1.3 統計學分析

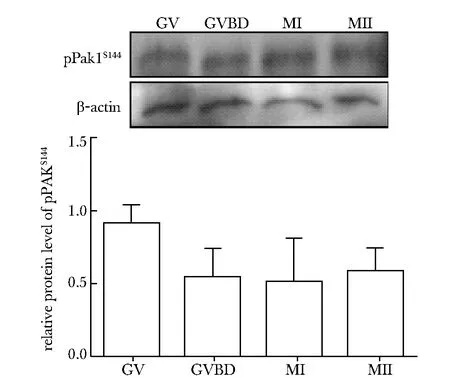
With Western blot analysis, high level of pPak1S144 was detected at GV stage and remained stable up to MII stage圖1 pPak1S144在小鼠卵母細胞減數分裂過程中的蛋白表達Fig 1 Protein expression of pPak1S144 in mouse oocytes
2 結果
2.1pPak1S144在小鼠卵母細胞減數分裂過程中蛋白表達量
pPak1S144蛋白在小鼠卵母細胞內有特異表達,在GV期高水平表達,并持續保持至MII期,各個時期蛋白表達量無明顯差異(圖1)。
2.2pPak1S144亞細胞定位模式及其與MTOC蛋白的相關關系
在GV期,pPak1S144呈現出單個高度致密的點狀聚集,定位于胞質中,并表現出與中心粒周圍蛋白共定位的特性 (圖2A:b,c,d)。在GVBD期,染色質開始凝集形成單個染色體,pPak1S144呈點片狀聚集在凝集中的染色體周圍,仍舊保持與中心粒周圍蛋白的共定位性質(圖2A:f,g,h)。隨著染色體逐漸向赤道板聚集,pPak1S144和中心粒周圍蛋白同時向赤道板兩側紡錘體兩極的部位聚集(圖2A:j,k,i),當卵母細胞成熟至MI期時,所有的染色體整齊排列于赤道板中央(圖2A:m),pPak1S144呈“O”或“C”形聚集在推測的紡錘體兩極的位置,在紡錘體以外的胞質中也有點狀的聚集,并在所有這些區域,均表現出與中心粒周圍蛋白共定位特性(圖2A:n,o,p)。pPak1S144在MII期表現出與MI期相似的分布模式(圖2A:v,w,x)。如圖2B所示,在MI和MII期,pPak1S144與MTOC的另一核心蛋白,γ微管蛋白,共同定位于紡錘體兩極(圖2B:b,c,d,f,g,h),同時在胞質中呈點狀分布(圖2B:b,c,f,g)。在第一次減數分裂后期(Ana-Ⅰ期)以及末期(Tel-Ⅰ期)進程中,染色體向紡錘體兩極分離, pPak1S144離開MTOC的位置,彌散地分布在細胞質收縮環周圍(圖2A:r,s,t)。pPak1S144與MTOC關鍵蛋白在時空上的共定位關系表明其間存在高度關聯性,提示pPak1S144是卵母細胞MTOC相關蛋白。
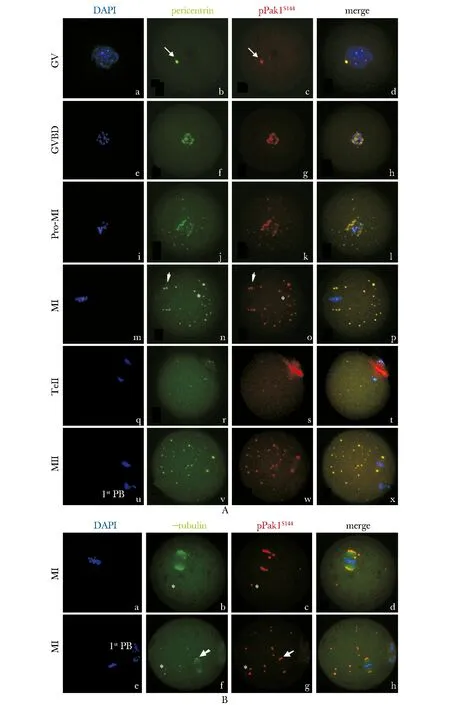
A.immunofluorescent staining reveals tight co-localization of pPak1S144with MTOC structural component, pericentrin in oocytes during the whole meiosis; B.pPak1S144is co-localized with MTOC key component, microtubule nucleating protein, γ-tubulin on the poles of meiotic spindles; pPak1S144is labeled in red, while Percientin/γ-tubulin in green and chromosome in blue
圖2小鼠卵母細胞減數分裂過程中pPak1S144與MTOC核心蛋白的共定位特性
Fig2Co-localizationofpPak1S144andMTOCkeyproteinsinmouseoocytesduringmeiosis
2.3pPak1S144聚集在減數分裂紡錘體兩極
在MI期卵母細胞內染色體整齊排列于赤道板中央(圖3a),微管裝配成典型的雙極對稱圓桶狀的紡錘體結構(圖3b),此時pPak1S144呈“O”或“C”形聚集在紡錘體兩極(圖3c,d),同時在胞質中呈點狀分布(圖3c),這一分布特性同樣出現在MII期卵母細胞內(圖3f,g,h),再次提示了pPak1S144與卵母細胞減數分裂紡錘體形成的相關性。
3 討論
胚胎的非整倍體是臨床上流產和出生缺陷的最常見原因,這與母親卵母細胞在減數分裂成熟過程中染色體的分離錯誤密切相關[1]。染色體的分離依賴于紡錘體的有序牽引,揭示其形成和維持機制是認識和預防人類非整倍體胚胎形成的重要研究內容。哺乳動物卵母細胞中缺少中心粒,不形成中心體,減數分裂進程中微管組裝形成紡錘體依賴于特異的MTOC[8]。
迄今,MTOC結構的組裝、成熟和功能維持的分子調控機制仍然不甚清楚。最新證據表明蛋白激酶AUKA,PKC、MAPK kinase1 (MEK1)和Breast cancer 1 (BRCA1) 等在卵母細胞MTOC的形成和結構維持中發揮一定作用[7,9-11]。本研究證實了在小鼠卵母細胞減數分裂過程中pPak1S144始終與γ-tubulin和Pericentrin呈現出緊密的亞細胞共定位特性,共同聚集在紡錘體兩極,遵循與AUKA、磷酸化PKC和MEK1相似的分布模式,提示pPak1S144是MTOC相關蛋白。
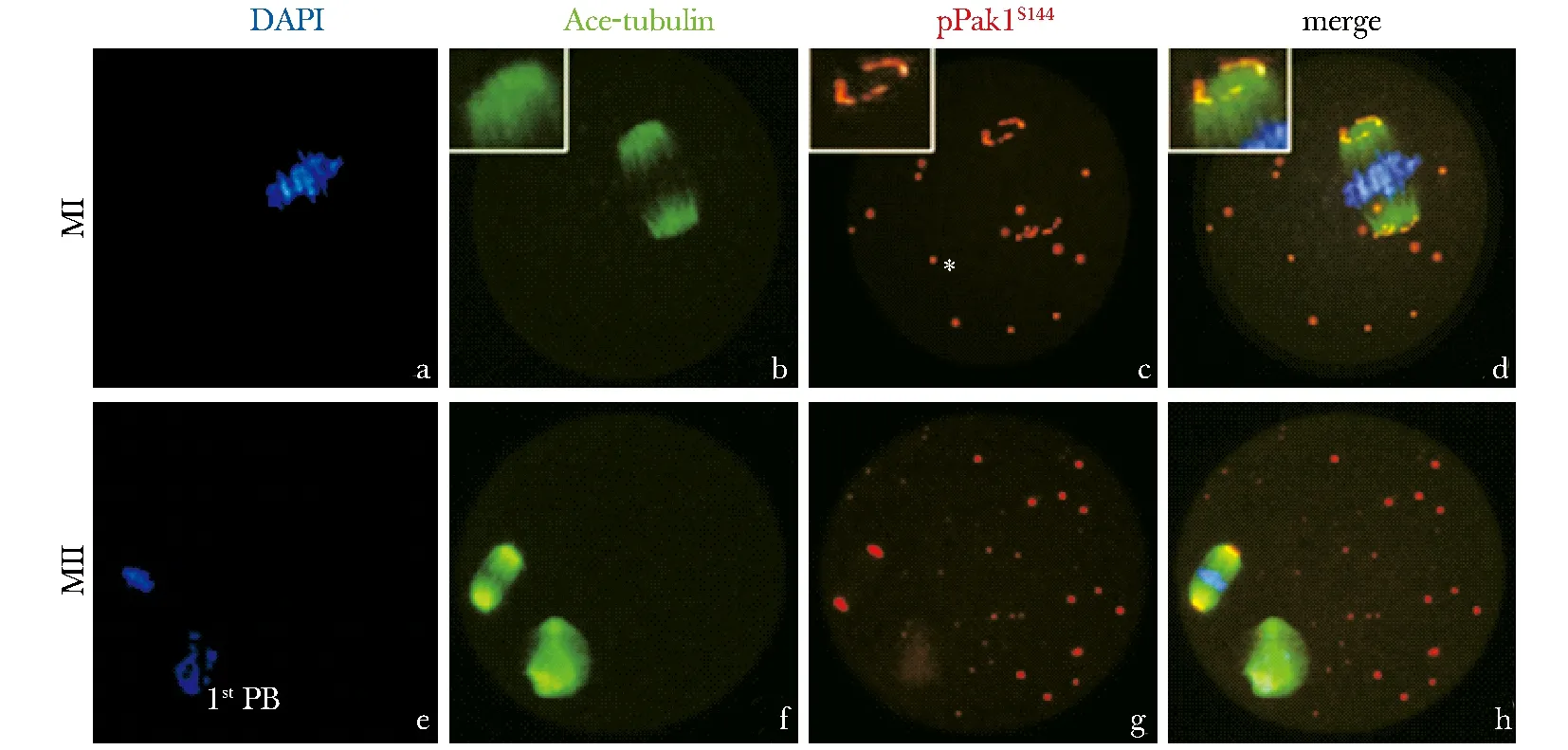
Immunofluorescent staining determined specific localization of pPak1S144on spindle poles in oocytes at MI and MII stages; pPak1S144was labeled in red, while ace-tubulin in green and chromosome in blue
圖3pPak1S144定位于小鼠卵母細胞紡錘體兩極
Fig3LocalizationofpPak1S144onmeioticspindlepolesinmouseoocytesduringmeiosis
Pak1的功能的活化需要在多個位點發生一系列的自動磷酸化過程,其中在Ser144位點的磷酸化(pPak1S144)可以抑制Pak1形成非活性的同源二聚體,維持其活化狀態[12]。在體細胞有絲分裂過程中活化的Pak1能夠特異地激活AUKA催化中心體成熟的活性[13],可以介導和調節PKC和MEK1等激酶的活性[14~15]。卵母細胞減數分裂過程中,pPak1S144是否與AUKA、PKC和MEK1等在調節MTOC功能方面存在協同作用尚待研究。
[1] Hunt P, Hassold T. Female meiosis: coming unglued with age [J]. Curr Biol, 2010, 20:699-702.
[2] Miao YL, Kikuchi K, Sun QY,etal. Oocyte aging:cellular and molecular changes, developmental potential and reversal possibility[J]. Hum Reprod Update, 2009, 15:573-585.
[3] Gueth-Hallonet C, Antony C, Aghion J,etal. γ-tubulin is present in acentriolar MTOCs during early mouse development [J]. J Cell Sci, 1993, 105:157-166.
[4] Molli PR, Li DQ, Murray BW,etal. PAK signaling in oncogenesis [J]. Oncogene, 2009, 28: 2545-2555.
[5] Dummler B, Ohshiro K, Kumar R,etal. Pak protein kinases and their role in cancer[J]. Cancer Metastasis Rev, 2009, 28:51-63.
[6] Lin SL, Qi ST, Sun SC,etal.PAK1 regulates spindle microtubule organization during oocyte meiotic maturation[J]. Front Biosci (Elite Ed), 2010, 2:1254-1264.
[7] Ma W, Koch JA, Viveiros MM. Protein kinase C delta (PKCδ) interacts with microtubule organizing center (MTOC)-associated proteins and participates in meiotic spindle organization[J].Dev Biol,2008,320:414-425.
[8] Zimmerman WC, Sillibourne J, Rosa J,etal. Mitosis-specific anchoring of γ-tubulin complexes by pericentrin controls spindle organization and mitotic entry[J]. Mol Biol Cell, 2004, 15:3642-3657.
[9] Suja JA, Barbero JL.Cohesin complexes and sister chromatid cohesion in mammalian meiosis[J]. Genome Dyn, 2009, 5:94-116.
[10] Xiong B, Sun SC, Lin SL,etal. Involvement of Polo-like kinase 1 in MEK1/2 regulated spindle formation during mouse oocyte meiosis[J].Cell Cycle, 2008,7:1804-1809.
[11] Xiong B, Li S, Ai JS,etal. BRCA1 is required for meiotic spindle assembly and spindle assembly checkpoint activation in mouse oocytes[J]. Biol Reprod, 2008, 79:718-726.
[12]Ke Y, Lei M, Solaro RJ. Regulation of cardiac excitation and contraction by p21 activated kinase-1[J]. Prog Biophys Mol Biol, 2008, 98:238-250.
[13] Zhao ZS, Lim JP, Ng YW,etal. The GIT-associated kinase PAK targets to the centrosome and regulates Aurora-A[J]. Mol Cell,2005, 20:237-249.
[14] Wang Z, Fu M, Wang L,etal. P21-activated kinase 1 (PAK1) can promote ERK activation in a kinase-independent manner[J]. J Biol Chem,2013, 288:20093-20099.
[15] Wada-Kiyama Y, Suzuki C, Hamada T,etal. Estrogen-induced cell signaling in the sexually dimorphic nucleus of the rat preoptic area: potential involvement of cofilin in actin dynamics for cell migration[J]. Biochem Biophys Res Commun,2013, 434:287-292.
The role of Pak1 in spindle formation of mouse oocytes
LI Xiu-hong1, ZHANG Xian-cai2, ZHOU De-shan1*, MA Wei1*
(1.Dept. of Histology and Embryology, Basic Medical College Capital Medical University, Beijing 100069;2.Dept. of Anatomy, Xingtai Medical College, Xingtai 054000, China)
ObjectiveTo investigate the subcellular localization of autophosphorylated Pak1 in mouse oocytes during meiosis and its correlation with spindle formation.MethodsWestern blot procedure was employed to assay the dynamic changes in protein expression of autophosphated Pak1 at Ser144(pPak1S144); immunofluorescence staining was carried out to label pPak1S144subcellular distribution and its temporal-spatial relationship with spindle and microtubule organizing centers(MTOCs) proteins, Pericentrin and γ-tubulin.ResultspPak1S144was stably expressed during meiotic progression in mouse oocytes; it was specifically co-localized with Pericentrin and γ-tubulin and concentrated on spindle poles.ConclusionspPak1S144is MTOC-associated protein, implying a role in meiotic spindle formation.
pPak1S144;oocytes;meiosis;microtubule organizing centers(MTOCs);spindle
2013-12-07
2014-01-17
國家自然科學基金(31271253);教育部博士點基金 (20121107120019)
*通信作者(correspondingauthor): zhouds08@ccmu.edu.cn;mawei1026@ccmu.edu.cn
1001-6325(2014)04-0449-05
研究論文
R 321.1
A

