Nrf2減輕小鼠非酒精性脂肪性肝炎
張海峰, 王 鋒,曹 戩
(1.內蒙古醫科大學 基礎醫學院 生理教研室, 內蒙古 呼和浩特 010110; 2.中國中醫科學院 廣安門醫院 病理科, 北京 100053)
Nrf2減輕小鼠非酒精性脂肪性肝炎
張海峰1*, 王 鋒1,曹 戩2
(1.內蒙古醫科大學 基礎醫學院 生理教研室, 內蒙古 呼和浩特 010110; 2.中國中醫科學院 廣安門醫院 病理科, 北京 100053)
目的研究Nrf2對小鼠非酒精性脂肪性肝炎(NASH)的作用及其可能機制。方法通過蛋氨酸-膽堿缺乏飼料(MCD)飼喂小鼠獲得NASH模型;隨機分為對照組、模型組以及Nrf2組,Nrf2組灌胃姜黃素0.9 mL/d,對照組和模型組給予相應體積的0.9%氯化鈉注射液灌胃。4周后檢測肝組織中Nrf2含量,肝指數,血清谷丙轉氨酶(ALT)、谷草轉氨酶水平(AST)、葡萄糖(GLU)、三酰甘油(TG)和膽固醇(Chol)含量;對肝臟進行油紅O染色;檢測肝組織中TG、Chol、丙二醛(MDA)和谷胱甘肽(GSH)含量及超氧化物歧化酶(SOD)的活性;并檢測細胞色素C和ATP含量。結果與模型組小鼠相比,Nrf2組小鼠的血清中ALT,AST和GLU含量下降 (Plt;0.05),肝組織中TG、Chol和MDA含量下降(Plt;0.05),GSH水平、SOD活性升高(Plt;0.05);同時細胞色素C漏出降低,ATP含量上升(Plt;0.05)。結論Nrf2對由蛋氨酸-膽堿缺乏所引起的NASH具有一定的保護作用,其機制可能是通過減少氧化應激,提高線粒體活性實現的。
轉錄因子E2相關因子2;非酒精性脂肪性肝炎;蛋氨酸-膽堿缺乏飼料;氧化應激
非酒精性脂肪型肝炎(non-alcoholic steatohepatitis, NASH)是非酒精性脂肪性肝病的一種病理分型,由于其患病人數較多,因此越來越多的受到人們的重視。轉錄因子E2相關因子2(nuclear factor-erythroid 2 related factor 2, Nrf2)幾乎存在于機體各個細胞,不僅與機體的防御系統密切相關,而且是細胞防御氧化應激的重要調節因子[1-2]。同時 Nrf2的表達與谷丙轉氨酶(alanine aminotransferase, ALT)、谷草轉氨酶(aspartate aminotransferase, AST)的水平成正相關[3],這提示Nrf2在NASH中起到重要作用。文獻研究表明,姜黃素可以誘導肝臟分泌Nrf2[4]。因此,本實驗采用姜黃素誘導小鼠肝臟分泌Nrf2,并用蛋氨酸-膽堿缺乏飼料(methionine choline-deficient, MCD)制備NASH模型,旨在探討Nrf2在NASH中的保護作用及其可能機制。
1 材料與方法
1.1 材料
1.1.1 實驗動物和飼料: 野生型SPF級C57BL/6小鼠30只, 6周齡, 雄性,體質量為20~25 g,北京維通利華實驗動物技術有限公司(J 2011-0011)。MCD配方[5]由北京華阜康生物技術股份有限公司制作;正常飼料購買于北京維通利華實驗動物技術有限公司。
1.1.2 主要試劑: 抗Nrf2兔抗鼠多克隆抗體(Abcam公司),細胞色素C抗體 (Santa Cruz公司)、辣根過氧化物酶標記山羊抗兔(北京中杉金橋生物技術有限公司);Western blot超敏發光液、游離脂肪酸超敏測定試劑盒、組織細胞總膽固醇酶法測定試劑盒、三酰甘油測定試劑盒、丙二醛(malonaldehyde, MDA)試劑盒、ATP檢測試劑盒、GSH 試劑盒和SOD 活性檢測盒(北京蒂諾奧基因技術有限公司);其他試劑均為國產分析純。
1.2 模型制備及分組
將小鼠飼喂普通飼料適應性飼養1周后隨機分成: 對照組(control組)、模型組(MCD組)和Nrf2組(MCD+curcumin組),每組10只。模型組與Nrf2組飼喂MCD飼料,MCD+curcumin組用姜黃素以0.9 mL/d劑量灌胃[6], 實驗動物均自由攝食、飲水。
1.3 取材
飼喂4周后,禁食水12 h,稱體質量,4%水合氯醛麻醉,下腔靜脈取血,分離血清,-80 ℃保存;肝臟稱重后部分液氮凍存,部分4%多聚甲醛固定。
1.4 指標檢測
1.4.1 一般情況:觀察各組小鼠行為活動、體形及毛發狀態。稱取體質量和肝濕重,計算肝指數[肝指數(%)=肝臟質量(g)/體質量(g)×100%]。
1.4.2 肝組織病理學檢測:取小鼠肝臟組織用于油紅O染色和HE染色。
1.4.3 血清學檢測:下腔靜脈取血獲取血清,保存于-80 ℃冰箱中。血清ALT、AST、TG和Chol采用全自動生化分析儀測定。用 MDA 試劑盒、GSH 試劑盒、SOD 活性檢測盒檢測相應指標。
1.4.4 測定肝組織TG,FFA,Chol含量:精確稱取0.5 mg肝組織,按照TG,FFA,Chol測定試劑盒及ATP檢測試劑盒說明書進行檢測。
1.4.5 Western blot法檢測蛋白水平:取0.5 mg肝組織,用RIPA裂解液提取總蛋白,用BCA定量法測定樣品的濃度, 取適量樣品進行SDS-PAGE。
1.6 統計學分析
2 結果
2.1 給予姜黃素干預后,肝臟中Nrf2的表達變化
給予姜黃素干預后,發現MCD+curcumin組中肝臟Nrf2表達含量明顯升高(Plt;0.05)(圖1)。

*Plt;0.05 compared with control group圖1 Western blot檢測Nrf2蛋白質水平Fig 1 Quantification of Nrf2 by Western blot(n=5)
2.2肝臟誘導Nrf2后可以減輕由MCD引發的小鼠體質量下降和肝指數下降
對照組小鼠體毛整齊,有光澤,體質量正常且穩步增長, 其攝食量和飲水量也正常,墊料干燥。和對照組小鼠相比,模型組小鼠體毛凌亂,精神萎靡,進食量明顯下降, 進水量上升,墊料潮濕。而使用姜黃素誘導Nrf2組的小鼠體質量減輕,精神良好,進食量無明顯下降。模型組與對照組小鼠相比,體質量、肝濕重和肝指數均有所下降 (Plt;0.05);而在使用姜黃素誘導Nrf2組小鼠與模型組小鼠相比,體質量、肝濕重和肝指數均顯著升高 (Plt;0.05) (表1)。
2.3 肝組織形態學改變
對照組小鼠肝組織中肝竇清晰可見,肝索排列整齊,形態結構正常。組織內未出現紅色脂滴。模型組小鼠肝細胞內出現大量大小不一的脂肪空泡,肝細胞結構紊亂,肝小葉內出現多淋巴細胞浸潤,可見到大量紅色脂滴,約為60%~75%。而姜黃素誘導Nrf2組小鼠肝細胞出現部分空泡,少部分區域出現肝索結構紊亂,偶見炎性細胞浸潤,紅色脂滴含量較少,約為15%~20%,其病變程度遠低于模型組(圖2A)。且姜黃素誘導Nrf2組小鼠肝臟病理評分低于模型組 (Plt;0.05) (圖2B)。
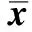
表1 各組小鼠的體質量、肝臟濕重和肝臟指數Table 1 Body weight, Liver wet weight and Hepatic index of mice in each group(±s,n=10)
*Plt;0.05 compared with control group;#Plt;0.05 compared with MCD group.
2.4 血清ALT、AST、GLU、Chol、TG結果
模型組小鼠血清中ALT、AST水平均高于對照組小鼠(Plt;0.05),其血清Chol、TG、GLU的含量均低于對照組 (Plt;0.05);與模型組相比,姜黃素誘導Nrf2組血清中ALT、AST水平明顯降低(Plt;0.05);血清中Chol、TG、GLU含量則明顯升高(Plt;0.05) (表2)。
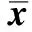
表2 各組小鼠血清中的ALT、AST、GLU、Chol和TG水平Table 2 The level of ALT, AST, GLU, Chol and TG in serum of each group mice(±s,n=10)
*Plt;0.05 compared with control group;#Plt;0.05 compared with MCD group.
2.5 肝組織中Chol、TG、FFA含量
與空白對照組小鼠相比,模型組小鼠肝組織中Chol、TG、FFA含量均有明顯增高(Plt;0.05);Nrf2組小鼠與模型組小鼠相比,肝組織中Chol、TG、FFA含量降低(Plt;0.05)(表3)。

表3 各組小鼠肝組織中Chol、TG、FFA的水平Table 3 The levels of Chol, TG and FFA in liver of each
*Plt;0.05 compared with control group;#Plt;0.05 compared with MCD group.
2.6 肝組織氧化應激指標的檢測
與空白對照組小鼠相比,模型組小鼠肝組織中MDA含量有所升高(Plt;0.05),而GSH含量及 SOD活性均明顯降低(Plt;0.05); Nrf2組小鼠與模型組小鼠相比,肝組織中MDA含量降低,但GSH含量及SOD活性明顯增加(Plt;0.05)(表4)。
2.7 線粒體功能指標檢測
與空白對照組小鼠相比,模型組小鼠肝組織中細胞色素C漏出增多,ATP含量降低(Plt;0.05)

表4 各組小鼠肝組織中MDA、GSH和SOD的水平Table 4 The levels of MDA, GSH and SOD in liver of
*Plt;0.05 compared with control group;#Plt;0.05 compared with MCD group.
(圖3B); Nrf2組與模型組相比,小鼠肝組織中細胞色素C漏出減少(圖3A),ATP含量升高(Plt;0.05)。
3 討論
MCD飼料是營養缺乏性飼料,是目前國際上公認的作為研究NAFLD中炎性反應及纖維化最好的動物模型之一[7]。正常小鼠飼喂MCD飼料后,脂質會在小鼠肝細胞內堆積。其病癥特點為伴有胰島素抵抗,消瘦,無血脂異常,血清學TG水平降低,體重下降明顯,并伴有肝質量及肝指數下降[7]。
本實驗首先通過飼喂MCD飼料成功建立了NASH模型。在NASH進程中,氧化應激是“二次打擊學說” 中重要的致病因素[8]。由于過多的脂質堆積在肝細胞中,脂肪酸激活線粒體,微粒體氧化作用,導致活性氧(reactive oxygen species, ROS)的大量生成。一方面脂肪酸影響線粒體正常功能,導致線粒體出現代謝紊亂,細胞色素C漏出,ATP生成下降,影響肝細胞功能系統。另一方面ROS可以引發脂質過氧化,蛋白變性和DNA損傷。大量的脂質過氧化物堆積可以降低肝細胞運輸三酰甘油的能力,從而促進肝細胞脂肪變性。

A.change of cytochrome C in the cytosolic and mitochondrial;B.levels of ATP in the liver;*Plt;0.05 compared with control group;#Plt;0.05 compared with MCD group
圖3Westernblot檢測線粒體及胞質中細胞色素C的水平及小鼠肝組織中ATP含量
Fig3WesternblotanalysisofcytochromecinthecytosolicandmitochondrialandthelevelofATPintheliverofeachgroupmice
文獻研究表明Nrf2可以抑制脂質的沉積和氧化應激反應[9]。但是Nrf2能夠減輕NASH的機制卻并不完善。本實驗中,通過姜黃素誘導Nrf2在肝細胞中分泌,從而達到過表達Nrf2的目的。實驗結果也表明,Nrf2可以明顯改善由于MCD飼料所引發的小鼠體重,肝重和肝指數降低以及由其引發的血清中ALT、AST、GLU含量的降低,保護肝臟功能。與此同時,可以減少脂質在肝細胞中的沉積。由于脂質的沉積減少,作為氧化應激的原料減少,肝細胞中SOD的活性有所降低。氧化應激效應的降低以及脂肪酸含量的減少,使肝臟中線粒體細胞色素C漏出減少,ATP含量穩定,因此其對線粒體損傷具有保護所用。然而關于Nrf2對線粒體損傷保護作用的機制有待更一步深入的研究。
[1] Hayashi A, Suzuki H, Itoh K,etal. Transcription factor Nrf2 is required for the constitutive an inducible expression of mu1tidrug resistance-associated protein 1 in mouse embryo fibroblasts[J]. Biochem Biophys Res Commun, 2003,310: 824-829.
[2] Charoensuk L, Pinlaor P, Prakobwong S,etal. Curcumin induces a nuclear factor-erythroid 2-related factor 2-driven response against oxidative and nirative stress after praziquantel treatment in liver fluke-infected hamsters[J]. Int J Parasitol, 2011, 41: 615-626.
[3] 邵洛林,許偉華, 周成軍, 等. Nrf2在小鼠非酒精性脂肪性肝炎發病機制中的作用[J]. 山東大學學報, 2010, 48:53-56.
[4] 李乒乓, 王龍, 陳維維, 等. 姜黃素對大鼠非酒精性脂肪性肝炎的作用及其機制初探[J].肝臟雜志, 2013,1: 18-22.
[5] Lee GS, Yan JS, Ng RK,etal. Polyunsanturated fat in the methinine-choline-deficient diet influences hepatic inflammation but not hepatocellular injury[J]. J Lipid Res,2007,48: 1885-1896.
[6] 王正, 張靜. 姜黃素對小鼠肝損傷的影響[J]. 食品科學雜志, 2007, 10: 501-503.
[7] 劉偉, 馬東林. 過表達apoA-I對小鼠分酒精性脂肪性肝炎作用的研究[J]. 中國組織化學與細胞生物學雜志, 2013,2:109-114.
[8] Farrell GC, Larter CZ. Nonalcoholic fatty liver disease: from steatosis to cirrhosis[J]. Hepatology, 2006, 43: 99-112.
[9] Xu W, Shao L, Zhou C,etal. Upregulation of Nrf2 expression in non-alcoholic fatty liver and steatohepatitis[J]. Hepatology, 2011, 58: 2077-2080.
NF-E2-related factor2 alleviates non-alcoholic steatohepatitis in mice
ZHANG Hai-feng1*, WANG Feng1, CAO Jian2
(1.Dept. of Physiology, Inner Mongolia Medical University, Hohhot 010110;2.Dept. of Pathology, Guang’anmen Hospital, China Academy of Chinese Medical Sciences, Beijing 10053, China)
ObjectiveTo investigate the clinical significance of NF-E2-related factor2 in preventing and treating non-alcoholic steatohepatitis(NASH).MethodsC57BL/6 mice were randomly divided into control group (control), model group (MCD) and curcumin induced Nrf2 group (MCD+curcumin). Mice in control group were fed with a standard diet while those in other two groups were fed with methionine choline-deficient (MCD) diet. At the same time, mice in Curcumin induced Nrf2 group were gavaged with 0.9 mL of curcumin daily. Control group and MCD group were gavaged with equal water. 4 weeks later, Nrf2 expression level, liver index, serum ALT and AST levels, serum triglyceride (TG), cholesterol (Chol) and GLU contents were measured, the HE and oil red O staining of liver cross section were observed, hepatic TG, Chol levels, MDA contents, GSH levels and SOD activity were quantified. Cytochrome c and ATP are also measured to investigate the mitochondrial function.ResultsAfter gavaged with Curcumin, compared to MCD group, the mice’s liver showed decreased lipid accumulation, serum ALT,AST, MDA, hepatic TG, Chol, and elevated serum TG and Chol levels.MDA level, Cytochrome c level also decrease, while GSH contents,SOD activity and the content of ATP increase (Plt;0.05).ConclusionsNrf2 has the effect of protection of NASH from MCD diet and primarily through the way of reducing oxidative stress and increasing mitochondrial function.
NF-E2-related factor2, non-alcoholic steatohepatitis, methionine choline-deficient diet, oxidative stress
2013-11-05
2013-12-13
內蒙古醫科大學青年創新基金(YKD2013QNCX003)
*通信作者(correspondingauthor):1980zhanghaifeng@163.com
1001-6325(2014)03-0360-05
研究論文
R333.4
A

