PCR-DGGE 法在水體微生物多樣性研究中的應用
焦晨JIAO Chen;夏甜XIA Tian
(①內蒙古化工職業學院材料工程系,呼和浩特 010070;②內蒙古化工職業學院思政理論教研部,呼和浩特 010070)
(①Department of Materials Engineering,Inner Mongolia Vocational College of Chemical Engineering,Hohhot 010070,China;②Ideological and Political Theory Teaching and Research Department,Inner Mongolia Vocational College of Chemical Engineering,Hohhot 010070,China)
1 湖泊水體系微生物生態學
1.1 湖泊水體系微生物多樣性 ①藻類,常見的藻類約56 個屬138 個種,包括:硅藻、裸藻、金藻、甲藻、小球藻屬,柵列藻屬,以及藍細菌等。②細菌,在被研究水體中BOD 符合負荷值比較低、維持好氧狀態的富營養話水體中,常見的優勢菌群有芽孢桿菌屬、假單胞菌屬、產甲烷菌屬、光和細菌屬、硫酸鹽還原菌等。③原生動物及微型后生動物,富營養化水體中常見固著型纖毛蟲、鞭蟲、甲殼類、搖蚊幼蟲等。
1.2 湖泊水體系微生物間的相互關系 位于食物鏈中的各種生物與其生存環境間通過一系列的能量和物質的轉移與循環保持著相互依存的穩定關系,即生態平衡。但當湖泊水體系中大量累積N、P 等營養元素時,生態系統的平衡就被破壞,主要表現為藻類通過大量繁殖,數量明顯增多,進而導致水體透明度下降和臭閾值增加。經過反復試驗驗證,向湖泊水體系中投加復合細菌能與原有水體中微生物形成共生增殖關系,從而使藻類優勢種群無法形成,起到了強化水體生物自凈能力,恢復湖泊生態平衡的作用。
2 微生物多樣性分析的常用方法
2.1 水體微生物多樣性的傳統研究方法 水體微生物多樣性的傳統研究方法是先將被檢測水體樣品中的微生物進行分離培養,經過純培養后獲得純菌株,再研究純菌株的特征及細胞性質,最后總結特性。但由于微生物形態簡單,個體較小,僅依靠外觀形態觀察無法獲得太多信息,且自然界中大多數微生物無法依靠純培養分離,也不能精確鑒定分離物,進而揭示分離物間的系統發育關系。
2.2 分子生物學技術 應用分子生物學技術研究水體微生物生態學,能夠在一定程度上避免微生物多樣性丟失及種群構成變化等問題的發生,有利于被研究水體微生物中新的菌株、新菌種的發現,進一步提高對環境微生物多樣性的認知水平。
3 應用PCR-DGGE 技術進行水體微生物多樣性檢測的原理、步驟和主要優缺點
3.1 應用PCR-DGGE 技術進行水體微生物多樣性檢測的原理 本論文擬采用基于凝膠中不同DNA 片段電泳遷移率差異的變性梯度凝膠電泳DGGE 技術分離被研究水體系微生物的DNA。
如圖1 將尿素和甲酰胺等DNA 變性劑添加到聚丙烯酰胺凝膠中,使溶液呈現線性的變性劑濃度梯度變化。在電泳過程中水體微生物的DNA 雙鏈分子在變性凝膠中逐步進行解鏈,形成解鏈區域,此接連區域的形成增大了DNA 分子的遷移阻力。當到達一定變性劑濃度,水體微生物的DNA 分子在變性凝膠中的解鏈程度恰好合適,DNA分子所受到的遷移阻力與周圍電場力互相平衡時,DNA分子便停留在該變性濃度的聚丙烯酰胺凝膠中。DNA 雙鏈分子由于堿基排列順序不一樣解鏈區域及解鏈行為也不相同,導致雖然處于同種變性凝膠電泳環境中,其遷移行為也不一致,因此可以在其周圍電場作用下得到分離。
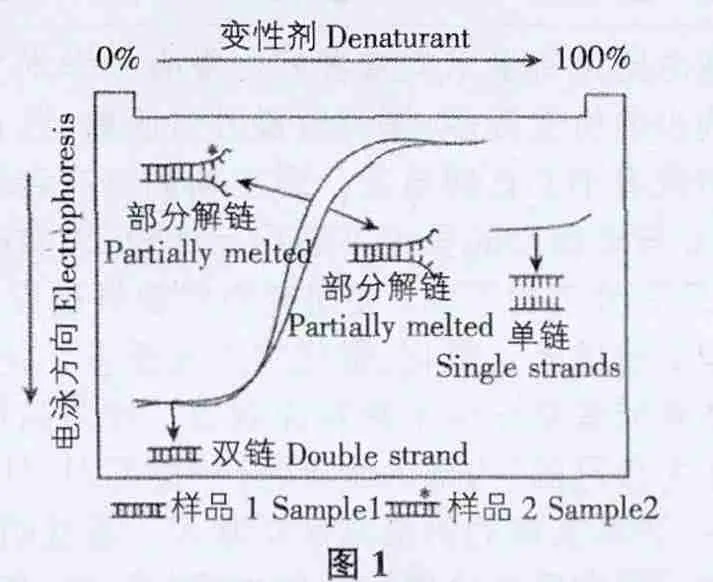
為了提高被研究水體樣品中微生物多樣性的檢驗精確度和檢出率,能夠更好的反映被檢測水體微生物的實際情況,徹底分離DNA 片段,在PCR 擴增過程時將GC 發夾結構添加到正向引物的5'端,使其在PCR 過程中,通過擴增連接到目的DNA 雙鏈分子片段的一端上[1],使其在含有變性劑的電泳凝膠中難以完全解鏈而形成DNA 單鏈。由于單鏈DNA 在DGGE 凝膠中的電泳行為完全取決于DNA 的分子大小,而與DNA 的堿基排列順序無關,因此DGGE 電泳無法將其完全分離。因此,可以說只要將檢測過程中的電泳條件設置合適且其滿足條件足夠細致,哪怕僅有一個堿基區別的DNA 片段也可以被區分。
應用PCR-DGGE 技術在水體微生物多樣性研究中具有以下優點:檢測極限低;檢測速度快;檢測費用低;結果有較強的客觀性;能夠針對多個樣品及多種微生物進行同時檢測;可以結合其他檢測方法提高檢測質量。
3.2 PCR-DGGE 技術分析微生物多樣性的主要實施步驟:①環境樣品微生物DNA 的提取;②環境樣品微生物DNA 的純化;③Touch-down PCR[2];④GC 發夾;⑤染色和測序。
3.3 PCR-DGGE 技術分析研究水體系微生物多樣性的局限性 如同任何檢測分析技術一樣,PCR-DGGE 技術分析微生物多樣性也存在一定的局限性,其局限性主要表現在如下幾個方面:①存在DNA 片段檢測的最理想長度一般在200~500bp 之間,所以能夠提供的生物系統發育信息具有局限性[3]。②在湖泊水體系微生物多樣性檢測中,由于被研究水體樣品中個別種類的微生物16S rDNA 在復制時的異質性問題及異源核酸雙鏈分子的檢出影響,會導致檢測結果偏離真實值略高。③DNA 片段擴增后的PCR產物由于受到具有不同序列的DNA 共遷移問題的影響,DGGE 電泳圖譜中可能出現同一條帶中含有不同種類的微生物,這將導致對湖泊水體環境微生物的多樣性估計偏低。同時受到電泳條件的影響,也不能保證具有序列差異的DNA 片段完全分離。④無法還原被研究水體中微生物在生活環境中的真實圖景,也無法提供微生物數量、群落新陳代謝活性和基因水平等研究信息,需要進一步結合微電極測量或熒光原位雜交等其他技術方法對被研究水體系中的微生物進行更詳盡地群落的復雜性分析。⑤DGGE凝膠電泳技術雖然可以檢測到占有超過全部研究水體系的整個群落微生物數量1%的優勢菌群的存在,但仍無法將被研究水體樣品中環境微生物群落的復雜性完整地體現出來。對于以上技術方法中存在的檢測缺陷,可以從改善PCR 擴增及DGGE 電泳條件著手;同時將與其他傳統的技術檢測方法與DGGE 電泳技術進行有機的結合、相互補充,這樣將被研究水體系微生物群落的代謝、數量、結構和功能等情況的動態變化更貼近實際地反映出來,并進一步將原位生理等環境中微生物的多樣性信息進行表達,從而不斷提高分析微生物生態學的研究水平。
4 總結
本文擬使用PCR-DGGE 分子生物技術分析研究水體微生物群落多樣性,使用該方法的研究較少目前仍然沒有明確出一種具體的、行之有效的方法來對微生物群落多樣性研究進行實驗,實驗的后續性研究擬從傳統培養方法上對各種菌體進行更全面的研究,進而將分子生物技術在水體微生物群落多樣性上建立起一套快捷、可靠的分析方法,在對水體微生物處理以及富營養化水體的治理研究中起到相應的作用。
[1]曾薇,楊慶,張樹軍等.采用FISH、DGGE 和Cloning 對短程脫氮系統中硝化菌群的比較分析[J].環境科學學報,2006,26(5).
[2]刑德峰,任南琪,宋業穎等.DG-DGGE 分析產氫發酵系統微生物群落動態及種群多樣性[J].生態學報,2005,25(7).
[3]陳桐生,李建軍,岑英華等.DG-DGGE 分析除臭生物濾池微生物多樣性及富集后的種群結構差異[J].應用與環境生物學報,2006,12(1).

