尿液蛋白質組學中樣品前期處理方法的研究進展
盧海濤,牛超,倪茂巍,朱忠欣,叢維濤,金利泰
尿液是血液經腎小球濾過,腎小管和集合管重吸收、排瀉及分泌產生的終末代謝產物,其組成與性狀可反映整個泌尿系統的狀況。尤其是尿液中蛋白質種類和數量的變化攜帶有泌尿系統疾病發生、發展及預后的各種信息,而尿液蛋白質組學是詮釋尿液蛋白所攜帶信息的最有效方法之一,而且此研究可以發現體內很多疾病的生物標志,例如膀胱癌和腎炎等。然而尿液中的鹽濃度高,代謝廢物多,還有很多低濃度的復合物,復雜的組成成分大大增加了尿液蛋白質組學的研究難度[1]。因此,尿液樣品的前期處理在尿液蛋白質組學分析和疾病分析過程中是一個相當重要的環節。本文著重闡述近年來國內外尿液蛋白質組學樣品的前期處理方法以及各方法的比較。
常用的尿液樣品前期處理技術主要包括兩種:非濃縮型與濃縮型尿液樣品處理。用考馬斯亮藍結合法、Folin 法及凝膠電泳技術檢測這兩種方法處理的尿液樣品,并且利用臨床上的腎活檢符合率指標來檢驗其準確度。其中非濃縮尿液樣品腎活檢符合率約 90.0%;濃縮型尿液樣品腎活檢符合率約 99.0%。
1 非濃縮型尿液蛋白質組學的樣品處理
尿蛋白成分可用于反映腎小球及腎小管損傷的程度。從近幾年研究來看,臨床檢驗主要運用腎組織穿刺活檢和非濃縮型處理尿液后蛋白檢測兩種技術。腎組織穿刺活檢雖是準確判斷腎臟病變的方法,但其創傷性和高風險性限制了其應用,不易被患者接受。而非濃縮型處理尿液后蛋白檢測方法因其對患者身體無任何損傷、取材方便、報告快速準確,而且比較全面、客觀反映尿中蛋白質的整體情況等優點而被廣泛應用,其方法步驟主要是非濃縮處理尿液后進行凝膠電泳檢測。姜儻[2]用此方法檢測腎炎患者尿液,用磺柳酸作蛋白定性,生理鹽水予以稀釋后進行十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)和十二烷基硫酸鈉-瓊脂糖凝膠電泳(SDS-AGE),將尿液中的蛋白質在電場作用下按照分子量大小進行分離。分子量 < 70 kD 為腎小管性蛋白尿,主要用來反映腎小管重吸收功能障礙;分子量 = 70 kD 為選擇性腎小球性蛋白尿;分子質量 > 70 kD 為非選擇性腎小球性蛋白尿,主要用來反映腎小球濾過功能障礙。文獻[1]報道,腎組織活檢與 SDS-AGE 尿蛋白電泳技術檢測的結果進行對比,其符合率高達 94.4%。
2 濃縮型尿液蛋白質組學的樣品處理
按照濃縮法處理尿液后的效果可以分為低濃縮型與高濃縮型兩種方法[3],這兩種方法各有其特點(表1)。低濃縮型方法是指對尿樣進行相對較低程度的處理或經過低濃縮程度設備的過程;高濃縮型則是對尿樣進行相當高的濃縮過程,進一步減少尿中微量蛋白的丟失,更加適用于尿樣臨床腎病檢驗。這兩種方法具有純化濃縮性能優越、準確性好、操作條件溫和、尿中微量蛋白丟失少和腎活檢符合率高等優點,但其缺點是操作相對復雜,經濟費用較高。

表1 高濃縮型與低濃縮型樣品處理方法的比較
2.1 低濃縮型尿液樣品處理
對尿液樣品進行低濃縮型方法處理的目的是運用簡便的操作去除尿液中非蛋白的部分雜質,減少后續處理的負荷,以利于精制、分析等后續工序的進行,最終減少部分雜質的干擾[4],提高與臨床組織活檢的符合率。這類型的尿液蛋白處理方法各有其特點(表 2)。

表2 低濃縮型尿液樣品處理方法的比較
2.1.1 物理法濃縮 物理法濃縮就是利用溫度、壓強、分子大小等物理性質對尿樣進行前期濃縮處理。易菲等[5]對尿液樣品在低溫加壓超濾系統中濃縮尿微量蛋白質。磁力攪拌(200 r/min),在 N2高壓(40000 kg/m2)下使尿液通過濾膜濃縮尿液微量蛋白。在 5 mol/L Tris-緩沖液下透析過夜去鹽,再次濃縮后收集,檢出限可達 10 μg。
這類方法操作簡單、對蛋白活性影響小,對后續操作影響低,但是濃縮尿液效果不佳,準確度較低。
2.1.2 化學法濃縮 化學法濃縮則是利用外加化學試劑來處理尿樣。Thongboonkerd 等[6]進行的有機溶劑沉淀法是常用的尿液蛋白富集濃縮方法。從防腐劑(異噻唑啉酮)、尿液解凍溫度(37 ℃)、丙酮沉淀時間(過夜)和尿液與丙酮體積比(1∶3)等 4 個方面考察,綜合探尋丙酮沉淀法富集蛋白的最佳方法,更好地優化丙酮濃縮尿液樣品的方法,檢出限可達 5 μg。Sarote 等[7]利用 80% PEG 及 15%(NH4)2SO4組成的雙水相體系,從尿液中萃取出尿蛋白。研究了 (NH4)2SO4飽和度、鹽析次數、分級鹽析對尿蛋白提取率和濃縮度的影響,結果表明,尿蛋白的濃縮度隨(NH4)2SO4飽和度的提高而增加,飽和度為 45% 時濃縮度最高,達到 97.98%。該作者還做了 (NH4)2SO4兩次鹽析,尿液濃縮度提高。二步法鹽析尿蛋白的濃縮度是一步法鹽析的 122.42%,尿蛋白鹽析條件的優化為下游尿蛋白質組學的操作奠定基礎,檢出限可達 1 μg。
化學法濃縮尿液樣品處理方法的優點為靈敏度比物理法濃縮型高,操作較為簡便,但是效果仍不太理想,對蛋白活性影響大,容易丟失微量蛋白,故仍需對這類方法進行相關優化實驗。
2.2 高濃縮尿液樣品處理
高濃縮型尿液樣品處理方法因其具有準確度高、可信度高、檢出限低、蛋白丟失少和腎活檢符合率高等優點廣泛運用于尿液蛋白質組學的前期實驗中,各種方法的特點如表 3所示。一方面濃縮蛋白可保證強的檢測信號,另一方面又能去除大部分非蛋白雜質。但是因為價格貴、操作復雜等缺點,限制該技術廣泛運用于臨床腎病檢驗中。
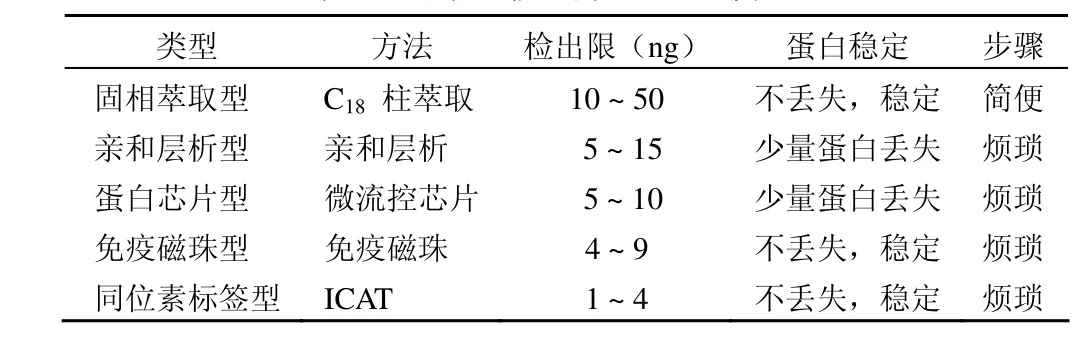
表3 高濃縮型方法的比較[8-10]
2.2.1 固相萃取型濃縮 Al-Musaimi 等[11]采用固相萃取-高效液相色譜的方法對尿液進行濃縮純化,此方法利用萃取劑對尿液中的蛋白進行選擇性吸附,洗脫液富集后以甲醇-乙酸(15∶85,V/V)溶液為流動相,C18為固定相,于280 nm 測定其中的尿蛋白含量。該方法結果表明:尿蛋白在 2.26~145 mg/L 濃度范圍內呈良好的線性關系,檢出限為 0.45 mg/L,方法的平均加權回收率大于 90%,RSD 小于 4.2%。采用該方法對 80 名健康人尿樣進行了前期蛋白處理,并進行蛋白檢測,結果為 1.55~6.79 mg/L。后來,Nagaraj 和 Mann[12]利用固相萃取處理尿液樣品并進行LC-MS/MS 分析處理泌尿道炎癥患者的尿液。其有 4 個主要步驟:提取患者晨尿中段、胰蛋白酶消化、SPE 小管純化蛋白質以及 LC-MS/MS 分析,成功檢測出 TNF、ILs、IFN 等因子,并且檢出極其微量的 B 因子。但是該方法對尿液蛋白質具有選擇性吸附,難免會有微量蛋白丟失,并且洗脫分離的時間不容易把握。
2.2.2 親和層析型濃縮 親和層析是利用偶聯親和配基的親和吸附介質為固定相親和吸附目標產物,使目標產物得到分離純化的方法。它具有很高的選擇和分離性能以及較大的載量,可以使待分離的尿液蛋白質從復雜的混合物中分離出來,并保持較高的活性。Malinowska 等[13]報道,對體內各種蛋白質進行檢測,其中具有關于尿液樣品蛋白質檢測的描述。實驗員選取正常尿液、腎病患者的發病期與治療期的尿液進行檢測蛋白質的種類與含量。其中,對尿液樣品同位素標記尿液蛋白質后進行 HiTrapr Protein AFF 親和層析柱純化的前期處理,然后采集一部分進行免疫沉淀,另一部分進行 MS/MS 測定尿液中蛋白質的相對和絕對含量。這種實驗室處理尿液樣品的方法十分準確地檢測出腎病患者的蛋白種類與含量,指導臨床的診治。但是要處理體積較大的尿液樣品,親和柱層析的效率較低,需要進行相關優化實驗。后來發展了親和超濾法,既保持了尿液蛋白與固定相的親和性,又對尿液樣品進行超濾法處理,這種方法提高了對尿液蛋白質的濃縮度與濃縮效率。Tekea 和 Telefoncub[14]用親和超濾技術濃縮尿液樣品,并提取分離尿液中牛胰磷脂酶A2(PLA2)。這種方法是基于殼聚糖-磷酰乙醇胺的合成樹脂為親和載體,濃縮處理尿樣后,將前次濃縮的尿樣再次在Ca2+存在條件下進行親和超濾,最后以 EDTA 為洗脫劑,結果顯示該酶被純化 79 倍,活性回收率為 76.3%。
2.2.3 蛋白芯片型濃縮 蛋白芯片是一種高通量監測系統,通過靶分子和捕捉分子相互作用來監測蛋白分子之間的相互作用。捕獲分子一般都固定在芯片表面,由于配體的高度特異性和與溶液蛋白強結合特性所以被廣泛地用作捕獲分子。Alkhalaf 等[15]采用的蛋白質芯片-質譜聯用(SELDI-TOF-MS)技術是基于蛋白質芯片與尿液蛋白結合牢固的原理進行的。將尿液樣品上樣到芯片表面,孵育后,送入 TOF-MS 檢測。分離到 195 個斑點,而用固相配體處理后的樣品則分離到 487 個清晰的斑點,極大地擴大濃縮度,并且減少微量蛋白的丟失,更有可信度。后來,Per?i等[16]發展了蛋白質微陣列晶片技術,運用了特異性抗原-抗體結合技術與尿液蛋白質微陣列晶片技術結合來處理并分析慢性腎炎患者尿液,非常準確地檢測相關的腎炎疾病。蛋白質微陣列晶片技術是一項與固定在表面的蛋白配體或者某些片段(DNA、RNA、protein、antibody 等)相關的技術。隨著研究的深入,發現這項技術的不足之處是沒有簡單的方法濃縮大體積的尿液,可能在尿液中出現功能性保守的現象,從而導致下游檢測靈敏度下降。
2.2.4 免疫磁珠型濃縮 Hall 等[17]運用免疫磁珠分離技術(immuno-magnetic bead-based separation,IMS)處理尿樣來建立尿液快速免疫學檢測和分離濃縮技術。它是以高均一性的磁性微球為固相載體,表面包被有免疫配基,如抗體等。結果表明前期尿樣處理理想,與尿蛋白的結合力更強。把磁珠結合到輔助激光解吸電離基質 MALDI-matrix(如CHCA)中,濃縮倍數大大增加。目前該項技術在尿液蛋白分離及尿液生化檢測等方面均取得了較大的進展。
2.2.5 同位素標簽型濃縮(ICAT) Weeks[18]對尿液中蛋白質進行二向差異凝膠電泳(2D-DIGE)分離純化蛋白質,篩選出癌癥疾病代謝的相關尿液蛋白質之后進行質譜分析,準確檢測出主要的 26 種癌癥相關蛋白質。2D-DIGE 方法能夠使尿液中的蛋白質經花青素標記其 N 端區域后可以對多個蛋白質樣品進行同步化檢測和差異分析。這種方法實現了在蛋白質分子水平上對癌癥進行實時的臨床診治和臨床護理。有兩組實驗室先后對腎病患者尿液蛋白質檢測過程中的蛋白質穩定性的問題提出“穩定同位素標記多肽標準物(stable-isotope-labeled peptide standards,SIS)”的實驗方案,在液相層析聯用質譜處理腎病患者尿液樣品的過程中添加氨基酸 C 端同位素標記物 [13C6,15N2]-Lys(98%)或者[13C6,15N4]-Arg(98%)[19-20]。從實驗結果來看,這種實驗方案避免尿液中的常量與微量蛋白質的降解,更加全面準確地分析腎病患者代謝的蛋白質種類與含量的情況,進而準確地探究患者患病情況。
3 蛋白質組學檢測尿液
利用尿液蛋白質組學檢測泌尿道疾病的蛋白質可以探究疾病的病理機制。通過采集正常尿液(作為對照)和各種泌尿道疾病患者的尿液進行蛋白質組的方法處理與分析,獲得尿液中蛋白質種類與含量等信息,建立尿液蛋白質圖譜,并且結合臨床上泌尿道疾病的相關信息,探究疾病的病理機制。
3.1 正常尿液蛋白質圖譜
Liu 等[21]對 20 名正常志愿者(10 男、10 女)的晨尿通過液相層析純化處理后聯用 MS/MS 分析,檢測到少于5% 的新生多肽或蛋白質,并且檢測到男性與女性尿中蛋白質含量差異。另外,也運用 Western blot 的技術檢測男性與女性尿液蛋白質種類差異性表達。通過各實驗組數據的分析與整理,建立了正常尿液蛋白質組學圖譜。
3.2 腎臟移植
Loftheim 等[22]采用尿液蛋白質捕獲的蛋白質組學方法并結合質譜儀分析手段,對數十名患者腎臟移植發生的急性排斥反應的尿液代謝物進行處理、檢測與分析,從而檢測出急性排斥反應中的蛋白質種類,包括類生長因子蛋白質、免疫應答因子等,從而確診出疾病類型。其方法的疾病符合率高于臨床上腎活體檢測的診斷。既證實尿液蛋白質可以很好地作為疾病標簽分子,也證實尿液樣品的前期處理、檢測分析等尿液蛋白質組學方法非常有利于與尿液相關疾病的臨床診治。
3.3 常染色顯性多囊性腎病
常染色顯性多囊性腎病(ADPKD)的患病率占晚期腎炎疾病的 10%。尿液蛋白質組學在 ADPKD患者中的尿液標簽蛋白分子的檢測具有準確率高的良好優勢。運用尿液蛋白質組學的低分子量指紋圖譜方法檢測 ADPKD 患者尿液蛋白質的含量和蛋白質足跡方法分析 ADPKD 患者尿液蛋白質大分子片段。Bakun 等[23]利用尿液蛋白質組學研究30 名 ADPKD 患者的尿液,結果發現 1400 多個蛋白質,繼而通過蛋白足跡分析,確定了 155 個與 ADPKD 患者顯著性相關的蛋白質。接下來與體內補體系統聯合分析,確定載脂蛋白、絲氨酸蛋白酶抑制劑、幾種生長因子、膠原以及胞外基質補體系統等參與 ADPKD 疾病的形成。
3.4 泌尿道腫瘤
Chen 等[24]利用液相色譜純化后聯用質譜分析二甲基同位素標簽的泌尿道腫瘤的終尿蛋白質,檢測出 24 種微量腫瘤相關蛋白,如胰島素樣生長因子 II mRNA 結合蛋白(IMP3,一種癌胚蛋白)的含量升高,染色質重塑因子腫瘤相關鈣離子信號轉導因子 2(TACSTD2)的含量大大增加,以及 ARID1A(一種腎小球癌的抑制蛋白)的含量降低等情況。實驗員建立了臨床確診的泌尿道腫瘤與其尿液蛋白質相關聯的圖譜,并建立某些疾病的致病信號通路。然后,利用已建立的圖譜所提供的信息,建立多反應機制來觀測患者尿液中蛋白質的變化進而關注治療藥物的代謝情況。
3.5 非侵襲性腎炎
Torres 等[25]通過藥物托伐普坦(選擇性抗利尿激素 2的拮抗藥物)治療非侵襲性腎炎的機制與尿液蛋白質組學檢測尿中蛋白質的方法的結合來研究非侵襲性腎炎的病理機制。通過對尿液樣品進行六勝肽處理重塑尿液蛋白質后經抗體親和柱純化蛋白,然后同位素標記蛋白質,最后利用MS/MS 聯用測定蛋白質種類和含量。在多名非侵襲性腎炎患者中檢驗出 7 種載脂蛋白以及 TIM、SAA4和 proEGF等 111 種蛋白。進一步驗證獲悉,載脂蛋白與 TIM 共同誘發非侵襲腎炎癥的發生,而 SAA4和 proEGF 使炎癥加劇,甚至誘發泌尿道癌癥的發生。這整個實驗過程充分地證實了尿液蛋白質組學對腎病的病理分析和臨床診治提供重要的信息,并有助于建立臨床預防與診治的方案。
4 結語
尿液蛋白,尤其是低豐度尿液蛋白是良好的生物標志物來源,在疾病的診斷、監測、預后等方面很有價值,有廣闊的應用前景[26]。但由于尿液蛋白濃度低和干擾因素多等原因,很多檢測手段無法對尿液中的蛋白進行準確檢測。目前常規的尿蛋白濃縮法已無法滿足飛速發展的尿液蛋白質組學研究。尿液蛋白濃縮方法的開發及優化將是尿液蛋白質組學研究的重點之一。
[1] Marimuthu A, O'Meally RN, Chaerkady R, et al.A comprehensive map of the human urinary proteome.J Proteome Res, 2011, 10(6):2734-2743.
[2] Jiang T.Urine proteins and kidney diseases.Chin J Lab Med, 2002,25(5):312-313.(in Chinese)姜儻.尿液蛋白與腎臟病.中華檢驗醫學雜志, 2002, 25(5):312-313.
[3] Sánchez-Juanes F, Mu?iz MC, Raposo C, et al.Unveiling the rat urinary proteome with three complementary proteomics approaches.Electrophoresis, 2013, 34(17):2473-2483.
[4] Liu HC, Liu RH, Ho HO, et al.Development of an information-rich LC-MS/MS database for the analysis of drugs in postmortem specimens.Anal Chem, 2009, 81(21):9002-9011.
[5] Yi F, Lei YX, Feng SM, et al.Enriched collection of urinary microprotein.Chin Occup Med, 2001, 28(4):4-5.(in Chinese)易菲, 雷毅雄, 馮蘇妹, 等.尿微量蛋白質的優化收集.中國職業醫學, 2001, 28(4):4-5.
[6] Thongboonkerd V, McLeish KR, Arthur JM, et al.Proteomic analysis of normal human urinary proteins isolated by acetone precipitation or ultracentrifugation.Kidney Int, 2008, 62(4):1461-1469.
[7] Sarote N, Rajni HK, Pawinee K.Purification of papain from Carica papaya latex: Aqueous two-phase extraction versus two-step salt precipitation.Enzyme Microb Tech, 2006, 39(5):1103-1107.
[8] Lambie SM, Schipper LA, Balks MR, et al.Solubilisation of soil carbon following treatment with cow urine under laboratory conditions.Soil Res, 2012, 50(1):50-57.
[9] Frommberger M, Zürbig P, Jantos J, et al.Peptidomic analysis of rat urine using capillary electrophoresis coupled to mass spectrometry.Proteomics Clin Appl, 2011, 1(7):650-660.
[10] Dayon L, Turck N, Garcí-Berrocoso T, et al.Brain extracellular fluid protein changes in acute nephritis patients.J Proteome Res, 2011,10(3):1043-1051.
[11] Al-Musaimi OI, Fayyad MK, Mishal AK.Novel liquid chromatographic determination of cystatin C in human urine.J Chromatogr B Analyt Technol Biomed Life Sci, 2009, 877(8-9):747-750.
[12] Nagaraj N, Mann M.Quantitative analysis of the intra- and inter-individual variability of the normal urinary proteome.J Proteome Res, 2011, 10(2):637-645.
[13] Malinowska A, Kistowski M, Bakun M, et al.Diffprot - software for non-parametric statistical analysis of differential proteomics data.J Proteomics, 2012, 75(13):4062-4073.
[14] Tekea M, Telefoncub A.Purification of bovine pancreatic phospholipase A2 by an affinity ultrafiltration technique.Sep Purif Technol, 2008, 63(3):716-720.
[15] Alkhalaf A, Zürbig P, Bakker SJ, et al.Multicentric validation of proteomic biomarkers in urine specific for diabetic nephropathy.PLoS One, 2010, 5(10):1932-6203.
[16] Per?i N, Pleadin J, Vuli? A, et al.Determination of ochratoxin A in serum and urine of pigs.World Mycotoxin J, 2012, 5(4):351-356.
[17] Hall DA, Ptacek J, Snyder M.Protein microarray technology.Mech Ageing Dev, 2007, 128(1):161-167.
[18] Weeks ME.Urinary proteome profiling using 2D-DIGE and LC-MS/MS.Methods Mol Biol, 2010, 658:293-309.
[19] Domanski D, Smith DS, Miller CA, et al.High-flow multiplexed MRM-based analysis of proteins in human plasma without depletion or enrichment.Clin Lab Med, 2011, 31(3):371-384.
[20] Parker CE, Domanski D, Percy AJ, et al.Mass spectrometry in high-throughput clinical biomarker assays: multiple reaction monitoring.Top Curr Chem, 2014, 336:117-137.
[21] Liu X, Shao C, Wei L, et al.An individual urinary proteome analysis in normal human beings to define the minimal sample number to represent the normal urinary proteome.Proteome Sci, 2012, 10(1):70.
[22] Loftheim H, Midtvedt K, Hartmann A, et al.Urinary proteomic shotgun approach for identification of potential acute rejection biomarkers in renal transplant recipients.Transplant Res, 2012, 1(1):1-9.
[23] Bakun M, Niemczyk M, Domanski D, et al.Urine proteome of autosomal dominant polycystic kidney disease patients.Clin Proteomics, 2012, 9(1):13.
[24] Chen CL, Lai YF, Tang P, et al.Comparative and targeted proteomic analyses of urinary microparticles from bladder cancer and hernia patients.J Proteome Res, 2012, 11(12):5611-5629.
[25] Torres VE, Meijer E, Bae KT, et al.Rationale and design of the TEMPO (Tolvaptan Efficacy and Safety in Management of Autosomal Dominant Polycystic Kidney Disease and its Outcomes) 3-4 Study.Am J Kidney Dis, 2011, 57(5):692-699.
[26] Sturm T, Leinders-Zufall T, Ma?ek B, et al.Mouse urinary peptides provide a molecular basis for genotype discrimination by nasal sensory neurons.Nat Commun, 2013, 4:1616.

