青島近海多棘海盤車繁殖生物學的初步研究*
張秀梅,李淑蕓,劉 佳,吳桑桑,李文濤
(中國海洋大學水產學院,山東 青島 266003)
多棘海盤車(Asteriasamurensis)俗稱海星,隸屬于棘皮動物門(Echinodermata)、海星綱(Asteroidea)、鉗棘目(Forcipulatida)、海盤車科(Asteriidae)、海盤車屬(Asterias),廣泛分布于北太平洋和澳大利亞沿海,為我國黃渤海習見種[1]。其喜食貝類,是底棲生物群落中重要的捕食者,大量聚集時對扇貝、魁蚶、牡蠣、鮑魚等貝類養殖和底播增殖造成嚴重危害[2-5]。國內外對海盤車屬生物種類繁殖方面的研究主要集中在受精作用的頂體反應[6]及激活機制[7-8]、環境因素對受精、胚胎發育的影響[9-10]以及配子的超微結構[11]等方面,對多棘海盤車性腺發育、繁殖規律的研究僅見于日本、俄羅斯、澳大利亞等少數報道[3,12-14],且研究結果不盡一致。俄羅斯彼得大帝灣的多棘海盤車一年繁殖2次,日本沿海和澳大利亞近海的種類一年繁殖1次,而我國沿海多棘海盤車的周年內繁殖規律還未見報道。本實驗對逐月采集的多棘海盤車樣本,采用常規生物學測定、解剖觀察、組織學切片等方法,研究不同發育時期的性腺結構變化及配子發育特征,研究結果將豐富海星繁殖生物學基礎資料,為貝類底播增養殖和人工魚礁區敵害生物防除提供基礎數據。
1 材料與方法
1.1 實驗樣本及環境數據收集
實驗所用的多棘海盤車樣本為2011年6月~2012年5月在青島浮山灣(36°01′N~36°04′N,120°22′E~120°68′E)沿岸海域潛水隨機采捕。浮山灣位于膠州灣東側,東臨燕兒島,西至太平角,灣口向南為黃海。每月取樣1次,每次取30~60只,繁殖期10~15d取樣1次,每次取樣10~30只,共取樣525只。各月海水表層水溫數據來源于青島市海洋與漁業局海洋水文預報(http://ocean.qingdao.gov.cn),日照長度數據來源于日出日落時刻查詢網站(青島地區)觀測數據(http://sunrise.supfree.net)。
1.2 實驗方法
1.2.1 形態學測定 樣本運回實驗室后放至水族箱內,待腕完全伸展后進行實驗。多棘海盤車結構示意圖見圖1。用游標卡尺和電子天平分別測定輻徑、間輻徑、體高(精確到0.01mm)、體重(精確到0.01g)等生物學指標。用解剖剪沿多棘海盤車腹面步帶區剪開,并稍稍用力將兩側掰開,露出性腺和消化腺,測量性腺和消化腺長度,用鑷子小心取出二者后,分別測定其凈重量,并記錄性腺的顏色變化及發育狀況。
1.2.2 組織切片及顯微觀察 解剖后取出性腺,Bouin氏液固定。常規石蠟切片后,Nikon Eclipse LV100POL顯微鏡下觀察并拍照。各月分別取雌性、雄性個體各10~15只進行組織學切片,繁殖期內每個樣本隨機選取30個視野進行拍照,借助測微尺和Image J軟件統計每個視野中所有包含細胞核的卵母細胞最大直徑。
1.3 數據處理和統計分析
多棘海盤車性腺分期方法主要參照Vevers[16]和Byrne[3]的分期方法。結合性成熟系數法與組織學方法將性腺發育分為6期。其中卵巢(Ovary)的發育分期主要根據卵巢組織學切片上面積比例超過50%或比例相對高的卵母細胞的時相來確定。精巢(Testis)分期主要依據生殖上皮中的生精細胞的組織學特點、內腔中精細胞的數量、血細胞層的發展程度等特點。
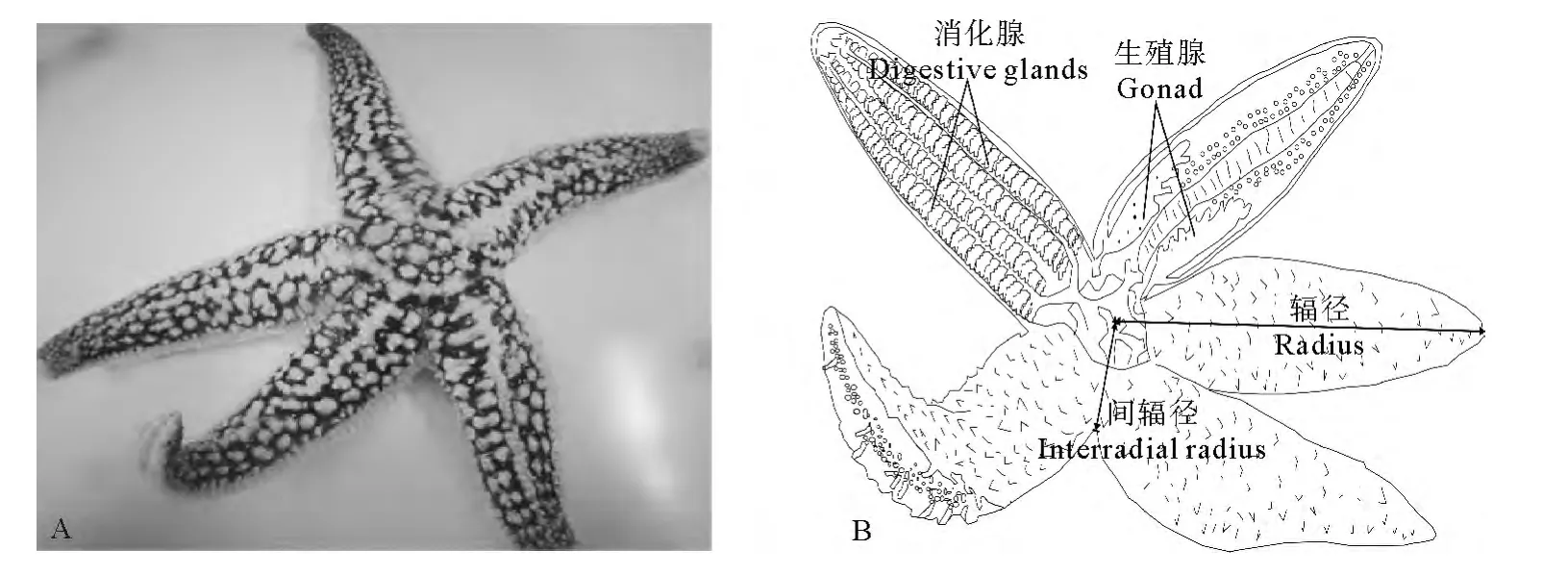
圖1 多棘海盤車結構示意圖Fig.1 Structure diagram of Asterias amurensis
性成熟系數和消化腺指數計算方法:
性成熟系數(GI)=性腺重量/體重×1000‰;
消化腺指數(PI)=消化腺重量/體重×100%。
所有數據均以平均值±標準誤(Mean±SE)表示,利用SPSS17.0統計軟件對各月的GI和PI進行單因素方差(one-way ANOVA)統計分析,并對不同月份間的數據進行Duncan多重比較,以P<0.05作為差異顯著標準。
2 結果
2.1 卵巢
2.1.1 解剖學特征 多棘海盤車的卵巢包括5對,每腕1對。分枝成葡萄叢狀,分別位于間步帶區腕的基部兩側。無交配器官,也無其他附屬腺體。腕中每個卵巢各有生殖管并以小孔開口于反口面的兩腕之間。生殖腺與圍血系統的生殖圍血竇、反口面環血竇以及反口面神經系統緊密結合在一起。卵巢的體積隨季節變化很大,在非生殖季節一般細小,分枝少,且精、卵巢外觀相同,不易分辨雌雄。而在生殖季節,卵巢為橙紅色,呈葡萄狀,膨大、充滿體腔,并一直深達腕末端,輕輕擠壓卵巢會有淡黃色漿體滲出。
2.1.2 卵巢發育分期及對應的形態特征 多棘海盤車的卵巢結構是海盤車科的典型結構,由內、外2層囊狀結構與生殖腔相分離。雙層囊結構在產卵后以及卵黃發生前期的個體中比較明顯,此時,卵巢壁較厚且呈收縮狀態。參照 Vevers[16]和 Byrne[3]的分期方法,根據多棘海盤車卵巢的外觀特征、組織學結構特點和性成熟系數等將卵巢發育的周年變化分為6期。除成熟期可以通過外觀橙紅色及解剖后有淺黃色漿體滲出可以區分雌雄外,其他期的卵巢都需要組織學方法確定雌雄及發育程度。
組織學結構的主要分期特征是卵母細胞的數量、大小、位置和著色情況,核徑、核仁數目,卵巢壁的寬度,液泡、卵黃粒、濾泡膜等形態特征,血細胞層的發育程度,吞噬細胞、細胞碎片的存在情況等。卵黃發生前卵母細胞嗜堿性較強,卵黃沉積后卵母細胞逐漸變成嗜伊紅性。各期的主要特征如下:
Ⅰ期:卵巢尚未發育。
卵巢透明且小,長度一般小于0.5cm,寬度小于0.15cm。緊貼于間步帶區腕基部兩側。
組織學切片顯示卵巢中偶見無卵黃的初級卵母細胞(見圖2a)。卵母細胞胞質嗜堿性較強,核大染色較深,核質較少。此期一生只經歷1次,在幼體多棘海盤車性腺發生時形成。
Ⅱ期:卵巢開始發育或產卵后重新發育。
該時期卵巢不透明,長度一般為0.5~1.5cm,寬度為0.15~0.40cm。
組織學切片顯示卵巢外壁較厚,雙層結構明顯。卵巢內腔可能充滿無定形組織,也可能包含嗜伊紅細胞碎片和吞噬細胞。一些早期和中期的具有卵黃的卵母細胞可能會出現,整個卵母細胞的外周有一薄層濾泡質。生殖上皮出現褶皺,增加表面積以供大量卵子發生。初級卵母細胞一般不規則排列于卵巢內生殖上皮附近,分布較散。形態不規則,有三角形、梨形、圓形或橢圓形等(見圖2b)。卵徑約為5.80~13.89μm,平均為(9.56±0.86)μm(見表1)。細胞質顆粒均勻分布,被染成深紫色而顯示強嗜堿性。細胞核位于細胞中央,呈圓形或橢圓形。此期卵巢成熟系數為0.31‰~14.94‰,平均為(2.91±0.57)‰。2~8月采集的多棘海盤車卵巢多處于這個時期。
Ⅲ期:卵巢正在成熟。
卵巢逐漸發育,末端逐漸膨大并出現分枝,長度一般為1.5~2.5cm,寬度為0.40~0.60cm。
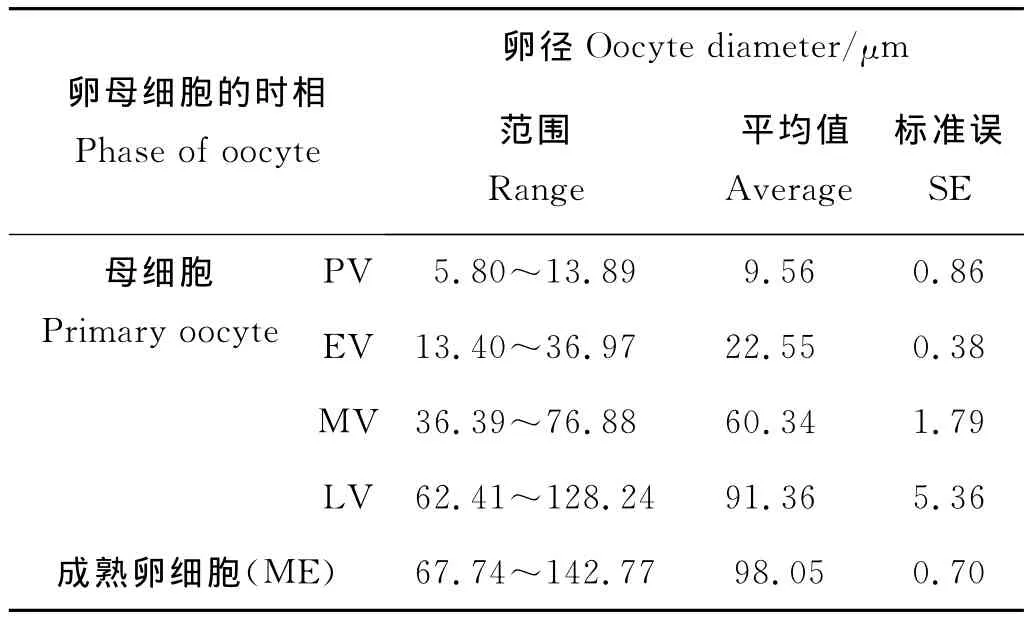
表1 不同時相卵母細胞的直徑Table 1 Oocyte diameter at different phases in Asterias amurensis ovaries
組織學切片顯示卵母細胞數目明顯增多(見圖2c),生發層內出現不同時期的卵母細胞(見圖2e)。此時卵黃開始形成和積累。生殖上皮輪廓迂回,血細胞層充滿了褶皺的中心,形成血竇,呈明顯的嗜伊紅性。卵黃形成早期,卵母細胞形狀不規則,呈梨形或橢圓形,由卵柄與血細胞層緊密連接,卵徑約13.40~36.97μm,平均為(22.55±0.38)μm(見表1)。卵母細胞基部附于濾泡壁膜上,另一側則明顯突入濾泡腔。卵母細胞細胞膜清晰,核大,近球形(見圖2d)。卵黃形成中期卵徑約36.39~76.88μm,平均為(60.34±1.79)μm(見表1)。卵黃形成后期,卵母細胞因卵黃大量積累體積變得很大,形成成熟的卵細胞,卵徑約為62.41~128.24μm,平均卵徑為(91.36±5.36)μm(見表1)。卵母細胞大多呈圓球形,外周濾泡膜明顯,但形態不一,核大、核內染色質少。卵母細胞在濾泡內成熟時,與卵柄脫離,逐漸向卵巢中央移動。隨著成熟的卵母細胞數目增多,卵巢壁逐漸變薄,血細胞層也逐漸變得不明顯(見圖2e)。該期卵巢成熟系數為2.01‰~128.44‰,平均為(65.03±8.21)‰,8~10月采集的多棘海盤車卵巢多處于這個時期。
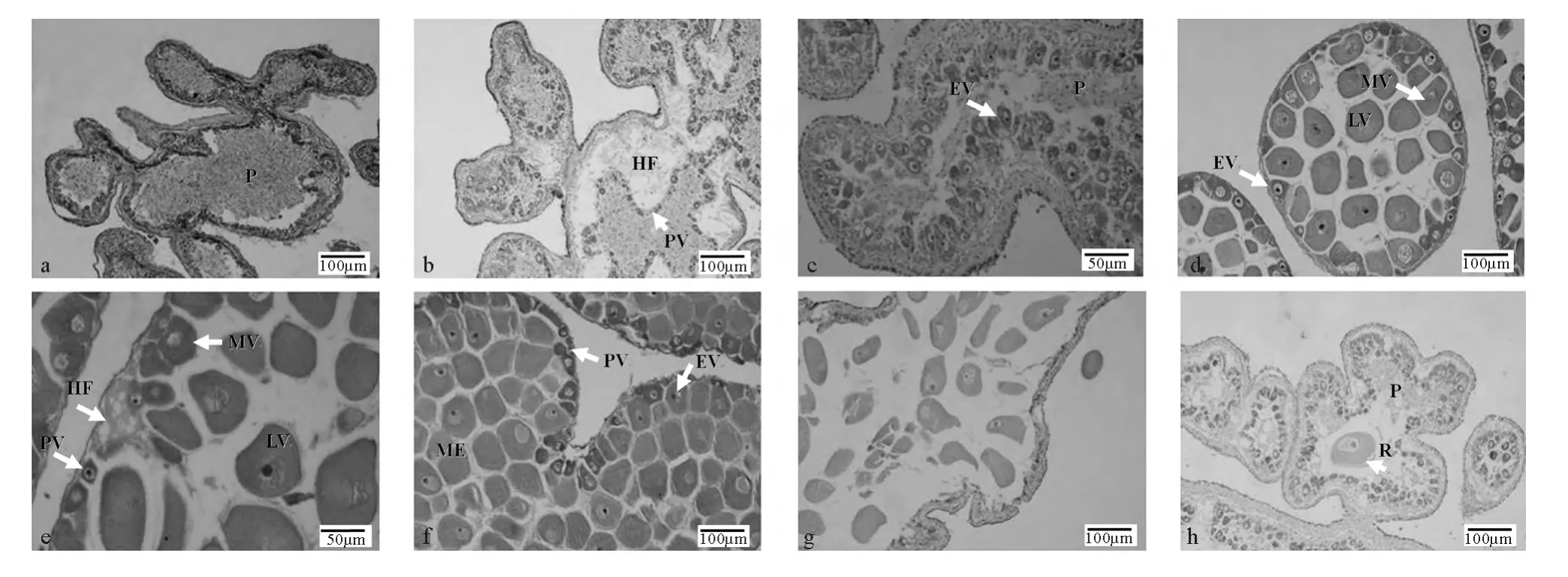
圖2 多棘海盤車不同發育時期卵巢的組織學結構Fig.2 Histological structure of ovaries in Asterias amurensis at different stages
Ⅳ期:性腺完全成熟,即將產卵。
卵巢已經很發達,呈橙紅色,膨大飽滿且分枝較多,有的伸長至腕末端。長度一般長于2.5cm,寬度寬于0.60cm。
切片顯示此期卵巢主要特點是卵巢中積聚大量成熟的卵細胞,呈橢圓形或圓球形,卵徑為67.74~142.77μm,平均卵徑為(98.05±0.70)μm(見表1)。核大、核徑約為7.31~10.64μm,平均為(8.65±0.25)μm(見表1)。卵母細胞已從濾泡膜中脫出,成游離狀態。生殖上皮周圍的初級卵母細胞繼續發育,卵巢壁薄且光滑(見圖2f)。此期卵巢成熟系數97.17‰~257.07‰,平均(182.80±19.94)‰,10~11月上旬采集的多棘海盤車卵巢多處于這個時期。
Ⅴ期:已部分產卵的卵巢。
卵巢部分開始萎縮,顏色開始變暗,長度一般為1.0~4.0cm,寬度為0.20~0.50cm。
組織切片顯示卵巢壁薄。由于成熟卵細胞的排放,剩余的成熟卵母細胞松散地排列于內腔,留有很多空間(見圖2g)。在一些雌性個體產卵前期和中期,具卵黃的卵母細胞在生殖上皮繼續發育,生成的卵母細胞進入內腔代替已經排出的卵細胞。內腔出現一些殘余的卵母細胞碎片和吞噬細胞。此期卵巢成熟系數為6.21‰~285.54‰,平均為(67.04±23.38)‰,11月下旬~12月上旬采集的多棘海盤車卵巢多處于這個時期。
Ⅵ期:產卵后的卵巢。
排完卵的卵巢萎縮、呈棕黃色,體積顯著縮小,只占體腔一小部分。長度一般為1.0~2.5cm,寬度為0.15~0.30cm。
組織切片顯示卵巢壁增厚,雙層囊狀結構明顯,血細胞層開始擴展并逐漸增厚。內腔含有少量未排出的卵細胞。這些殘余的卵細胞中卵黃被消化吸收,逐漸開始衰退。內腔中出現大量的吞噬細胞和細胞殘骸(見圖2h)。此期卵巢成熟系數0.90‰~15.97‰,平均為(5.21±0.75)‰,12月中旬~1月采集的多棘海盤車卵巢多處于這個時期。
2.2 精巢
2.2.1 解剖學特征 多棘海盤車精巢的形態結構及組成與卵巢類似,無明顯區別,非生殖季節精巢細小,分枝少,很難依據顏色與形態辨別出雌雄。成熟精巢呈淡黃或乳白色,因充滿精液而膨大,輕輕擠壓會有乳白色漿體滲出。
2.2.2 精巢發育分期及對應的形態特征 多棘海盤車精巢中生殖細胞的存在狀態也可以分為6個時相。根據精巢的外觀特征、組織學結構特點和成熟系數等將精巢發育的周年變化分為6期。除成熟期可以通過外觀的淡黃或乳白色及解剖后有乳白色漿體滲出可以區分雌雄外,其他期的精巢都需要組織學方法來確定雌雄及精巢發育程度。組織學結構的主要依據是生殖上皮中生精細胞的組織學特點、內腔中精細胞的數量、血細胞層的發展程度,隨著精巢的發育,嗜堿性逐漸增強。與卵巢一樣,精巢同樣具有海盤車科性腺典型的雙層囊狀結構。精巢各期的主要特征如下:
Ⅰ期:精巢尚未發育。
精巢呈透明錐狀,長度一般小于0.5cm,寬度小于0.15cm。
組織學切片顯示精巢中有許多精原細胞,胞質嗜堿性較強,核大染色深。Ⅰ期精巢在幼體性腺發生時形成,一生只經歷1次(見圖3a)。
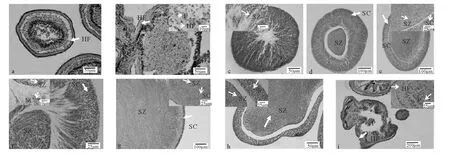
圖3 多棘海盤車不同發育時期精巢的組織學結構Fig.3 Histological structure of testes in Asterias amurensis at different stages
Ⅱ期:精巢開始發育或排精后重新發育。
精巢半透明,長度一般為0.5~1.5cm,寬度為0.15~0.35cm。包括初次進入生殖周期的精巢以及繁殖后重新發育的精巢。
組織學切片顯示精巢壁增厚,位于生殖上皮的精母細胞嗜堿性強,呈縱隊狀排列。生殖上皮開始出現較多褶皺,表面積增加以供大量的精子發生。褶皺的中心形成血液竇,血細胞層向外擴展,呈顯著的嗜伊紅性(見圖3b)。內腔中可能存在殘存的精子。此期精巢成熟系數在0.21‰~22.69‰之間,平均為(3.01±0.89)‰,2~8月期間的多棘海盤車精巢多處于這個時期。
Ⅲ期:精巢正在成熟。
此期精巢逐漸發育,分枝增多。長度一般1.5~2.5cm,寬度0.30~0.50cm。
組織學切片顯示精子發生劇烈,縱隊狀的精原細胞發育經初級精母細胞、次級精母細胞后形成精子。初級精母細胞呈圓形,直徑小于精原細胞,細胞核染色深(見圖3f)。成熟的精子細胞呈圓形,無明顯的細胞質,只含有嗜堿性強的細胞核,成熟后向內腔擴展延伸(見圖3d)。生殖上皮褶皺逐漸減少,血細胞層逐漸變得不明顯(見圖3c)。
Ⅳ期:精巢接近成熟。
此期精巢成熟系數為2.21‰~132.11‰,平均為(51.90±9.28)‰,8~10月采集的多棘海盤車精巢多處于這個時期。
Ⅳ期:精巢完全成熟,即將排精。
精巢飽滿,呈淡黃色或乳白色,輕輕擠壓表面會有少量乳白色漿液滲出,這是精巢成熟的標志。長度一般長于2.50cm,寬度寬于0.50cm。
組織學切片顯示精巢壁薄且光滑,內腔中充滿精子,精子大量聚集成渦流狀(見圖3e)。生殖上皮縱列的精原細胞繼續發育,因此盡管繁殖早期可能釋放了一部分精子,但精巢仍保留著成熟的外形,且精原細胞層逐漸變薄(見圖3g)。此期精巢成熟系數為117.12‰~375.74‰,平均為(189.33±26.86)‰,10~11月采集的多棘海盤車精巢多處于這個時期。
Ⅴ期:部分排精的精巢。
精巢部分開始萎縮,排精后的精巢呈棕黃色,長度一般為1.0~4.0cm,寬度為0.20~0.45cm。
組織切片顯示內腔中精子排列稀疏,生殖上皮精原細胞與中央精子團之間會出現間隙(見圖3h)。繁殖后期,生殖上皮的精原細胞減少,此期精巢成熟系數19.82‰~290.00‰,平均為(136.00±22.71)‰,11月~12月中旬采集的多棘海盤車精巢多處于這個時期。
Ⅵ期:排精后的精巢。
排精后的精巢萎縮、呈棕黃色,體積縮小,只占體腔一小部分。長度一般為1.0~2.5cm,寬度為0.15~0.30cm。
組織切片顯示精巢壁增厚,雙層囊狀結構明顯,血細胞層開始擴展并逐漸增厚。內腔存在少量未排出的精子,出現吞噬細胞(見圖3i)。生殖上皮僅有少量精原細胞存在。此期精巢成熟系數1.35‰~32.19‰,平均為(6.03±1.21)‰,12月下旬至次年1月采集的多棘海盤車精巢多處于這個時期。
2.3 性腺發育的月變化
卵巢在2~5月多處于Ⅵ期產卵后的階段,卵巢中殘留的卵母細胞和空濾泡逐漸退化并被消化吸收。6~7月多處于Ⅱ期,8~9月起卵巢開始進入生長發育階段,Ⅲ期個體逐漸增多,卵巢迅速由Ⅲ期進入成熟Ⅳ期。10~11月出現發育成熟并開始排卵的Ⅴ期個體,12月部分排卵的Ⅴ期個體數達到最大,隨著繁殖的進行,產卵后Ⅵ期個體增多,次年2月份達到最大。說明多棘海盤車雌性繁殖高峰期主要集中在10月至次年1月(見圖4A)。
精巢在8月開始生長發育,9月Ⅲ期個體數增多,并迅速由Ⅲ期進入成熟Ⅳ期。10月即出現部分排精個體,11月部分排精的Ⅴ期個體數達到最大,隨著繁殖的進行,排完精的Ⅵ期個體從12月開始出現,并一直持續至次年2月。說明多棘海盤車雄性繁殖高峰期主要集中在10~12月(見圖4B)。
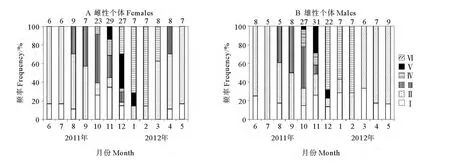
圖4 雌性個體卵巢和雄性個體精巢發育的月變化Fig.4 Monthly variation of gonadal development in Asterias amurensis based on the relative frequencies of ovary and testis phrases
2.4 性成熟系數和消化腺指數的周年變化
多棘海盤車雌性在8~9月開始生長發育,10月卵巢迅速生長,成熟系數迅速增加,達到最大(=69.87,SE=14.13;n=23),11月略有下降(=68.28,SE=16.07;n=29)。成熟系數在12月至次年1月急劇下降,2月之后保持較平穩的狀態。精巢的成熟系數變化情況與卵巢類似,在10月達到最大(=74.44,SE=12.53;n=27),11月略有下降(=73.27,SE=18.19;n=31),12月至次年1月急劇下降,2月之后大多進入恢復狀態,成熟系數略有增加。
雌性和雄性個體消化腺指數有比較明顯的周期性特征(見圖5)。消化腺指數在周年內呈現雙峰變化,7月達到一個峰值,隨著性腺開始發育而逐漸減小,雌性個體在10月達到最低(=11.31,SE=0.69;n=23)(見圖5),雄性個體在11月達到最低(=9.73,SE=0.60;n=31)(見圖5)。性成熟個體繁殖過后,消化腺指數開始逐漸增大。
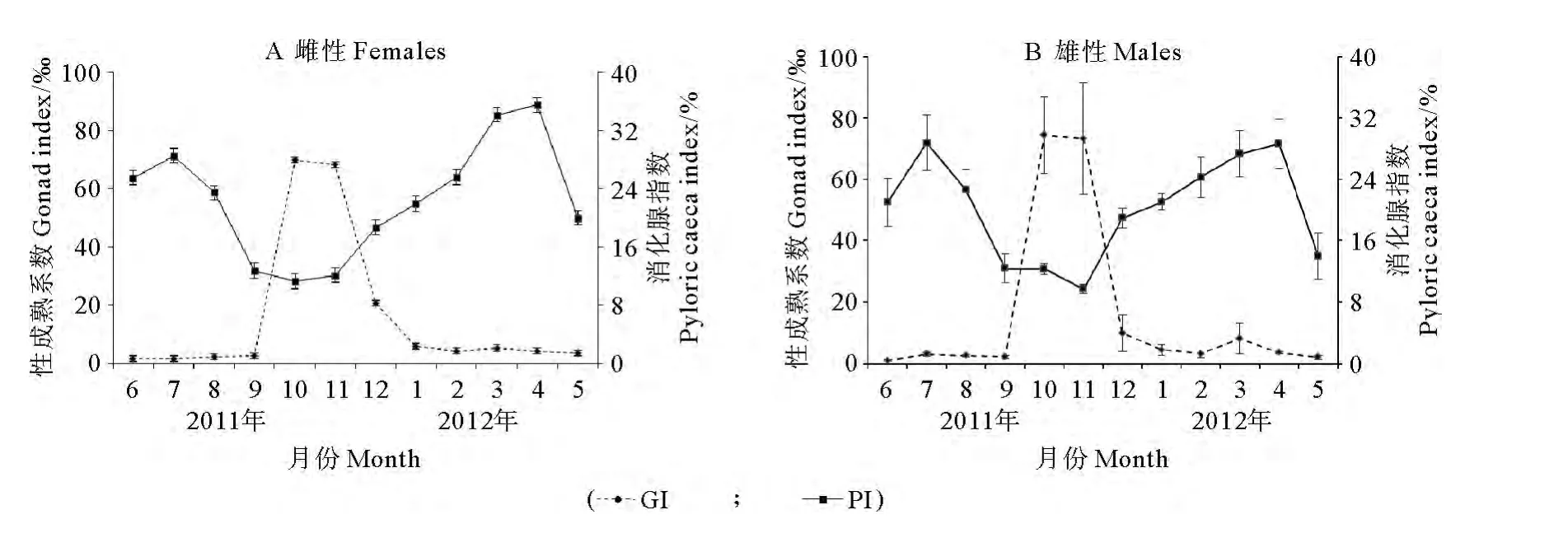
圖5 多棘海盤車雌性個體和雄性個體性成熟系數和消化腺指數的月變化Fig.5 Variation of gonad(GI)and pyloric caecal index(PI)between females and males of Asterias amurensis at different months
2.5 性別比例
統計2010年6月~2012年5月可明顯辨別雌雄的樣本共281個,其中雌性144只,雄性137只(見表2),整體雌雄比約為1.05∶1。χ2檢驗結果顯示與雌雄比1∶1之間無顯著差異。
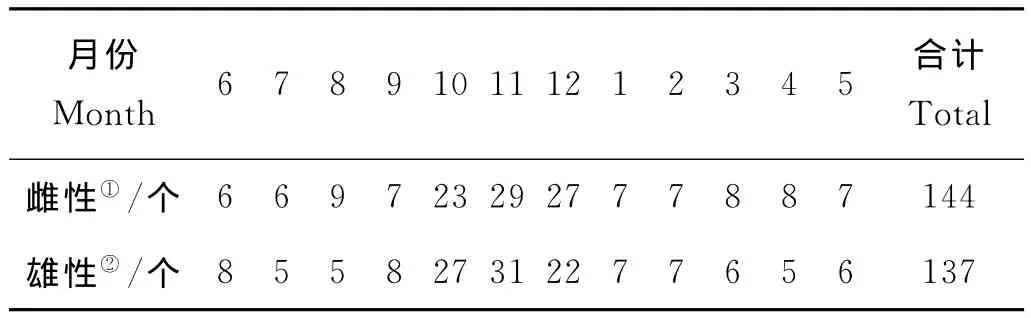
表2 各月雌雄個體數Table 2 Numbers of females and males in different months
3 討論
3.1 性腺發育分期
多棘海盤車的性腺結構是海盤車科種類的典型結構[17]。繁殖后生殖上皮輪廓曲折,血細胞層在配子形成前以及配子形成過程中循環存在。當配子發育時,血細胞層逐漸變薄,配子排放之后血細胞層增厚,這種特征也是海盤車屬種類的典型特征[18-20]。
多棘海盤車性腺發育目前有多種分期方法,Byrne根據卵母細胞細胞核直徑大小、卵母細胞內容物的沉積變化和形態特征等將性腺發育分為恢復期、生長期、成熟期、部分產卵期和產卵后期5期[3],Vevers將海星卵巢發育分為休止期、未成熟期、生長期、完全成熟期、排放后期和恢復期6期[16],Kim將多棘海盤車的性腺周年發育共分為7期[13]。Giese和Pearse,Byrne認為性成熟系數法與組織學方法結合起來確定生物繁殖規律有較高的準確性[21]。本文依據性成熟系數及性腺組織學結構特點,主要參照 Vevers[16]和 Byrne[3]的分期方法,將多棘海盤車的性腺發育共分為6期。其中卵巢組織學特征主要根據卵巢組織學切片上面積比例超過50%或比例相對較高的卵母細胞的時相確定,具體通過卵母細胞的卵徑、核徑、核仁數目等參數指標以及液泡、卵黃粒、濾泡膜等形態特征來確定卵母細胞的形態發育特征。精巢分期的組織學結構主要依據生殖上皮中的生精細胞的組織學特點、內腔中精細胞的數量、血細胞層的發展程度等特點來確定。
3.2 繁殖規律
多棘海盤車為雌雄異體,雌雄個體大小、外觀無明顯差異,性比接近1∶1,這與棘皮動物門其他雌雄異體的動物一致[22]。Fuji采集了不同海區的蝦夷馬糞海膽(Strongylocentrotusintermedius)樣本,并統計雌雄比例,得出性比約為1∶1[23]。Kim對日本陸奧灣[13]的多棘海盤車樣本進行統計,均得出性比為1∶1的結論。本研究中青島浮山灣多棘海盤車整體雌雄比約為1.05∶1,推測是由于采集數量不足所致,可以認為雌雄性別比例接近1∶1。
不同種類的卵巢內卵子發育狀況差異反映出不同的產卵規律,因此形成了不同的產卵類型。產卵類型決定著資源補充的性質,因此與種群數量波動形式有密切關系[24]。以往對海星的研究發現海星卵巢主要是分批產卵型。Byrne研究發現八腕海星(Patiriellacalcar)和小面包海星(P.exigua)2種海星卵徑分布頻率為雙峰型,即分2批進行產卵[21]。Marion等研究發現皇家海星(Astropectenarticulatus)雌性個體產卵時間持續較長,卵巢可以長時間處于發育的狀態[25]。Carvalho和Ventura通過對巴西東南部海域海燕(Asterinastellifer)2個群體的繁殖研究發現,不同群體的海燕繁殖規律類似,產卵期較長而且不同步[26]。本研究的組織學觀察發現,在繁殖期間隨著排卵的進行,多棘海盤車卵巢壁附近仍然持續產生初級卵母細胞,隨著成熟卵細胞的排出,初級卵母細胞繼續發育成成熟的卵細胞并排出。因此多棘海盤車雌性個體并不是一次性將卵排出,屬于多次產卵型。
3.3 繁殖期與環境因素的關系
通常海星的配子形成過程有明顯的季節性[27]。季節性變化的環境因素,如海水溫度、日照長度及食物的供應情況等,可以影響海星的有性生殖過程[28]。其中水溫和食物供應是影響海星繁殖發育最主要的2個因素[29]。
本研究結合性成熟系數法與組織學方法發現多棘海盤車有明顯的繁殖周期。一般來說,北半球海盤車科的種類在秋季和冬季配子開始快速發育,春天進行繁殖[30]。日本沿海多棘海盤車(35°N~41°N)在冬季1月份性腺發育最好,冬末或早春(2~5月)當溫度為5~12 ℃時開始產卵[13-14]。澳大利亞德文特河河口(42°S)的多棘海盤車性腺發育規律與日本沿海的種類相類似,卵巢在秋、冬季開始發育,春季(7~10月)當底層水溫達到10~13℃開始產卵[3]。Novikova研究發現俄羅斯彼得大帝灣的多棘海盤車一年繁殖2次,分別在夏季和秋季(6、9月),表層水溫為17和23℃時產卵[12](見表3)。本調查結果發現,青島濱海水溫在8月份達到最高(http://ocean.qingdao.gov.cn),并開始逐月下降,而多棘海盤車在8~9月份性腺開始快速發育。本研究海域多棘海盤車繁殖期集中在10月至次年1月,11~12月為繁殖盛期,此時水溫平均為9.6~16.2℃。Pearse和Eernisse研究發現赭石海星(Pisasterochraceus)在4月份溫度最高時開始發育,在7月溫度較低時開始繁殖,因此,可以認為水溫是影響海星配子發育的重要因素之一[31]。

表3 北半球和南半球多棘海盤車繁殖季節的比較Table 3 Comparison of spawning season between northern and southern populations of Asterias amurensis
Pearse和Eernisse研究認為光照周期及強度刺激赭石海星的性腺生長,短日照刺激性腺生長,而長日照可以使得性腺生長受到抑制[30]。這種繁殖受光照影響的模式在其他海星的研究中也有報道,主要包括Sclerasteriasmollis[32],Coscinasteriastenuispina[33]。 本 實驗中日照長度自6月開始逐漸縮短,在12月達到最低(http://sunrise.supfree.net),此時多棘海盤車處于繁殖期。Eckelbarger認為光照主要影響卵子中卵黃的發育速度,由多棘海盤車繁殖周期較短的特點可以認為其卵黃形成速度較快,繁殖率高[34]。日照長度和周期也影響海水中浮游植物的生長,秋季和初冬季節浮游植物生長旺盛可為海星浮游幼蟲的生長提供食物來源[35]。Pearse和Walker認為在許多海星的繁殖活動中,海水溫度和日照長度及周期對海星配子發育起到復雜的協同作用[30]。
3.4 GI與PI關系
多棘海盤車在8~9月開始發育,GI在9月份急劇上升,繁殖季節由于部分配子的釋放,GI會同步下降,10月份GI達到最大,11月份略有下降,分析原因可能是由于多棘海盤車繁殖早期伴隨著部分配子的釋放,性腺繼續發育,新形成的配子代替釋放的配子,較高的GI意味著配子補充較多、環境營養條件較好[3]。隨著配子的大量釋放,GI急劇下降。在1~2月性腺處于排放后的恢復期,GI較平穩,直到下一次生殖開始。
海星的儲能器官是消化腺[22,36]。充足的食物供應使海星消化腺重量增加,為性腺發育儲備能量[27]。由于海星的繁殖期較短,因此需要花費長時間來儲備能量以備繁殖時的高能量消耗[37-38]。在整個生殖循環中,PI和 GI之間的負相關關系比較常見[21,28,32,39]。本試驗中多棘海盤車PI在7月達到最大,隨著8月性腺開始發育PI逐漸降低,而10~11月時開始逐漸升高,說明在性腺發育期間消化腺為性腺發育提供了能量,在繁殖結束后開始儲備能量以備下一次生殖周期利用。
綜上所述,青島浮山灣地區與日本、澳大利亞沿海的多棘海盤車有類似的繁殖規律,雌雄異體,性比1∶1,均在水溫開始下降的秋、冬季節開始繁殖,冬末或早春開始幼體發育。海水溫度及日照長短會影響性腺發育。在不同的發育時期,性腺含有不同時相的卵母細胞、精母細胞。整體來看,性腺生長期間,消化腺為其提供能量,性成熟系數和消化腺指數在一周年內呈負相關關系。
[1]楊德漸,孫世春.海洋無脊椎動物學[M].青島:青島海洋大學出版社,1999:486-496.
[2]O'Hara T.Northern Pacific seastar[J].Vic Nat,1995,112:261.
[3]Byrne M,Morrice M G,Wolf B.Introduction of the northern Pacific asteroidAsteriasamurensisto Tasmania:reproduction and current distribution[J].Mar Bio,1997,127(4):673-685.
[4]Minchin D.Decapod predation and the sowing of the scallop,Pectenmaximus(Linnaeus,1758)[C].//Shumway S E,Sandifer P A.An International Compendium of Scallop Biology and Culture.Baton Rouge:World Aquaculture Society,1991.
[5]Spencer B E.Predators and methods of control in molluscan shelfish cultivation in North European waters[J].EAS Special Publication,1992,16:309-338.
[6]Nakachi M,Moriyama H,Hoshi M,et al.Acrosome reaction is subfamily specific in sea star fertilization[J].Dev Biol,2006,298(2):597-604.
[7]Matsumoto M,Solzin J,Helbig A,et al.A sperm-activating peptide controls a cGMP-signaling pathway in starfish sperm[J].Dev Biol,2003,260(2):314-324.
[8]Nishigaki T,Chiba K,Hoshi M.A 130-kDa membrane protein of sperm flagella is the receptor for asterosaps,sperm-activating peptides of starfishAsteriasamurensis[J].Dev Biol,2000,219(1):154-162.
[9]Lee C H,Ryu T K,Choi J W.Effects of water temperature on embryonic development in the northern Pacific asteroid,Asterias amurensis,from the southern coast of Korea[J].Invertebr Reprod Dev,2004,45(2):109-116.
[10]Lee C H,Ryu T K,Chang M,et al.Effect of silver,cadmium,chromium,copper,and zinc on the fertilization of the Northern Pacific asteroid,Asteriasamurensis[J].B Environ Contam Tox,2004,73(4):613-619.
[11]Lamash N E.Identification and isolation of GTP-binding regulatory protein from starfish(Asteriasamurensis)oocyte plasma membranes[J].Biol Bull,2001,28(1):107-109.
[12]Novikova G P.Reproductive cycles of sea starsAsteriasamurensisandPatiriapectiniferain Peter the Great Bay,sea of Japan[J].Biol Morya Kiev,1979,6:33-40.
[13]Kim Y S.Histological observations of the annual change in the gonad of the starfish,AsteriasamurensisLüken[J].Bull Fac Fish Hokkaido Univ,1968,19(2):97-108.
[14]Hatanaka M,Kosaka M.Biological studies on the population of the starfish,Asteriasamurensis,in Sendai Bay[J].Tohoku J Agric Res,1959,9(3):159-178.
[15]胡泗才,王立屏.動物生物學[M].北京:化學工業出版社,2010:96.
[16]Vevers H G.The biology ofAsteriasRubensL.:growth and reproduction[J].J Mar Biol Assoc UK,1949,28(1):165-187.
[17]Walker C W.Nutrition of gametes[C].//Jangoux M.Echinoderm nutrition.Rotterdam:Balkema,1982.
[18]Schoenmakers H J N,Colenbrander P H J M,Peute J,et al.A-natomy of the ovaries of the starfishAsteriasrubens(Echinodermata)[J].Cell Tissue Res,1981,217(3):577-597.
[19]Kasyanov V L.Reproductive strategies of sea stars from the Sea of Japan[C].Rotterdam:Balkema,1988.
[20]Beijnink F B,Walker C W,Voogt P A.An ultrastructural study of relationships between the ovarian haemal system,follicle cells,and primary oocytes in the sea star,Asteriasrubens[J].Cell Tissue Res,l984,238(2):339-347.
[21]Byrne M.Reproduction of sympatric population ofPatiriellagunii,P.calcarandP.exiguain New South Wales,asterinid seastars with direct development[J].Mar Biol,1992,114:297-316.
[22]Lawrence J M.A functional biology of echinoderms[M].London:Croom Helm,1987:17-96.
[23]Fuji A.Studies on the biology of the sea urchin:II.Size at first maturity and sexuality of two sea urchins,StrongylocentrotusnudusandS.intermedius[J].Bull Fac Fish Hokkaido Univ,1960,11(2):43-48.
[24]陳大剛.漁業資源生物學[M].北京:中國農業出版社,1997:72.
[25]Marion K R,Watts S A,McClintock J B,et al.Seasonal gonad maturation inAstropectenarticulatusfrom the Northern Gulf of Mexico[C].// Mooi R.Echinoderms.Rotterdam:Balkema,1998.
[26]Carvalho A L P S,Ventura C R R.The reproductive cycle ofAsterinastellifera(Mbius)(Echinodermata:Asteroidea)in the Cabo Frio region,southeastern Brazil[J].Mar Biol,2002,141:947-954.
[27]Chia F S,Walker C W.Echinodermata:Asteroidea[J].Reproduction of marine invertebrates,1991,6:301-353.
[28]Lawrence J M.Level,content and caloric equivalents of the lipid,carbohydrate and protein in the body components ofLuidiaclathrata(echinodermata:asteroidean:platyasterida)in Tampa bay[J].J Exp Mar Biol Ecol,1973,11(3):263-274.
[29]Lawrence J M,Ellwood A.Simultaneous allocation of resources to arm regeneration and to somatic and gonadal production inLuidiaclathrata(Say) Echinodermata: Asteroidea)[C].//Yanagisawa T.Biology of Echinodermata.Rotterdam:Balkema,1991.
[30]Pearse J S,Walker C W.Photoperiodic regulation of gametogenesis in a North Atlantic sea star,Asteriasvulgaris[J].Int J Invertebr Reprod Dev,1986,9(1):71-77.
[31]Pearse J S,Eernisse D J.Photoperiodic regulation of gametogenesis and gonadal growth in the sea starPisasterochraceus[J].Mar Biol,1982,67(2):121-125.
[32]Barker M,Xu R A.Population differences in gonad and pyloric caeca cycles of the New Zealand seastarSclerasteriasmollis(E-chinodermata:Asteroidea)[J].Mar Biol,1991,108(1):97-103.
[33]Alves S L S,Pereira A D,Ventura C R R.Sexual and asexual reproduction ofCoscinasteriastenuispina(Echinodermata:Aster-oidea)from Rio de Janeiro,Brazil[J].Mar Biol,2002,140(2):95-101.
[34]Eckelbarger K J.Ultrastructural features of gonads and gametes in deep-sea invertebrates[C].//Young C M,Eckelbarger K J.Reproduction,larval biology,and recruitment of the deep-sea benthos.New York:Col Univ Pre,1994.
[35]Catalina T,Ward P,Rubilar T,et al.Reproductive biology ofCosmasteriaslurida(Echinodermata:Asteroidea)an anthropogenically influenced substratum from Golfo Nuevo,Northern Patagonia(Argentina)[J].Mar Biol,2007,151(1):205-217.
[36]Jangoux M,van Impe E.The annual pyloric cycle ofAsteriasrubensL.(Echinodermata:Asteroidea)[J].J Exp Mar Biol Eco,1977,30(2):165-184.
[37]Ferguson J C.Fatty acid and carbohydrate storage in the annual reproductive cycle ofEchinaster[J].Comp Biochem Phys,1975,52(4):585-590.
[38]Crump R G.Annual reproductive cycles in three geographically separated populations ofPatiriellaregularis(Verrill),a common New Zeland asteroid[J].J Exp Mar Biol Ecol,1971,7(4):137-162.
[39]Rubilar T,Ward P C T,Vivar D M E.Sexual and asexual reproduction ofAllostichastercapensis(Echinodermata:Asteroidea)in Golfo Nuevo[J].Mar Biol,2005,146(6):1083-1090.

