制藥企業GMP文件生命周期管理調查Δ
丁 靜(浙江醫藥高等專科學校,浙江寧波 315100)
據國家食品藥品監督管理總局(CFDA)統計,截至2013年7月,我國通過2011年版《藥品生產質量管理規范》(GMP)認證的無菌藥品生產企業僅占25.9%,非無菌藥品生產企業僅占13.4%[1]。可見,我國制藥企業GMP整體認證通過率較低,認證壓力較大。國家食品藥品監督管理部門曾明確規定,全國所有無菌藥品生產企業應在2013年12月31日前達到2010年版GMP認證要求,而非無菌藥品生產企業應在2015年12月31日前達到2010年版GMP認證要求。屆時,那些未通過2010年版GMP認證的企業,將一律被要求停產,而先行通過2010年版GMP認證的企業可獲得多方面扶持。因此,所有制藥企業都應當抓住有利時機,積極應對挑戰,除開展硬件設施方面的改造外,還應建立一套系統、科學、實用的文件管理系統,并持續、有效地開展GMP文件生命周期管理,以順利通過2010年版GMP認證。本文擬就如何進行GMP文件生命周期管理以符合2010年版GMP要求等問題進行探討和分析。
1 GMP文件生命周期管理模型簡介
“文件生命周期”這一概念最早由美國檔案學者菲利普·布魯克斯提出。文件生命周期理論是指文件從產生直至因喪失作用被銷毀或因具有長遠歷史價值被檔案館永久保存的整體運動過程[2]。該理論為文件的全過程管理奠定了理論基礎,GMP文件管理在一定程度上體現了該理論的思想。但是,由于該理論主要是針對檔案館的文件管理,因此并不完全適用于制藥企業的GMP文件管理。為此,筆者在該理論的基礎上,結合GMP文件管理的特殊性,提出了GMP文件生命周期管理模型(見圖1)。該模型覆蓋了GMP文件整個生命運動的過程和形態,體現了文件的生命是“往復運動于起草到處置的連續的過程”,反映了GMP文件從起草、審核、批準、分發、培訓、生效、執行、保管、復審、變更、替換、撤銷、銷毀等完整的運動過程,強調GMP文件的整體性、系統性、連貫性和運動性。該模型對指導和解釋我國制藥企業文件管理中的一些實際問題具有重要的現實意義。開展GMP文件生命周期管理對提升制藥企業的質量管理水平、促進GMP的有效實施和推動我國制藥工業持續健康發展具有舉足輕重的作用。
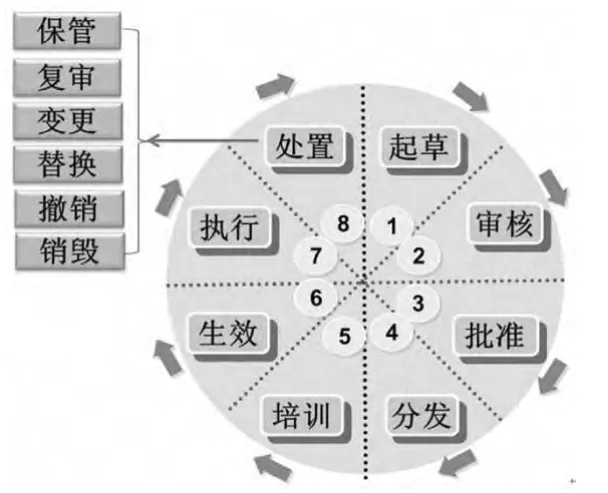
圖1 GMP文件生命周期管理模型Fig 1 GMPdocument lifecycle management model
2 對象與方法
2.1 調查目的
調查我國制藥企業的GMP文件管理情況,分析在GMP文件生命周期管理中存在的問題,從而有針對性地提出對策,提升其質量管理水平。
2.2 調查對象
選取浙江地區寧波4家、金華2家和嘉興、紹興、臺州各1家制藥企業作為調查對象,通過實地調研、專家訪談、企業資料查閱等相結合的方式展開調查。其中,訪談對象主要包括企業的質量管理負責人、質量管理員、辦公室人員、一線操作工和藥品監管部門人員。調查時間為2012年5月-2013年5月。
2.3 調查方法
按照制藥企業在GMP文件起草、審核、批準、分發、培訓、生效、執行、保管、復審、變更、替換、撤銷及銷毀等方面的情況進行分類調查,分析存在的問題,并采用Excel 2010軟件進行數據整理和分析。
3 制藥企業GMP文件生命周期管理中存在的問題
文件是確保信息有效傳遞和管理的工具[3]。GMP文件應該是貫穿于藥品生產管理全過程的系統全面、規范完整、相互協調、操作性強的有機體系。若缺少文件,企業的質量風險將會大大增加;相反,完善的文件系統能夠最大程度地降低風險[4]。筆者通過對以上9家制藥企業進行調研,發現其在GMP文件生命周期管理中存在一些普遍的問題。GMP文件生命周期各階段存在問題的企業數量統計見圖2;GMP文件生命周期管理問題魚骨圖見圖3。

圖2 GMP文件生命周期各階段存在問題的企業數量統計Fig 2 The number of enterprises existing problems at various stages of GMPdocument lifecycle
3.1 文件起草缺乏系統性、完整性、可操作性及擴展性
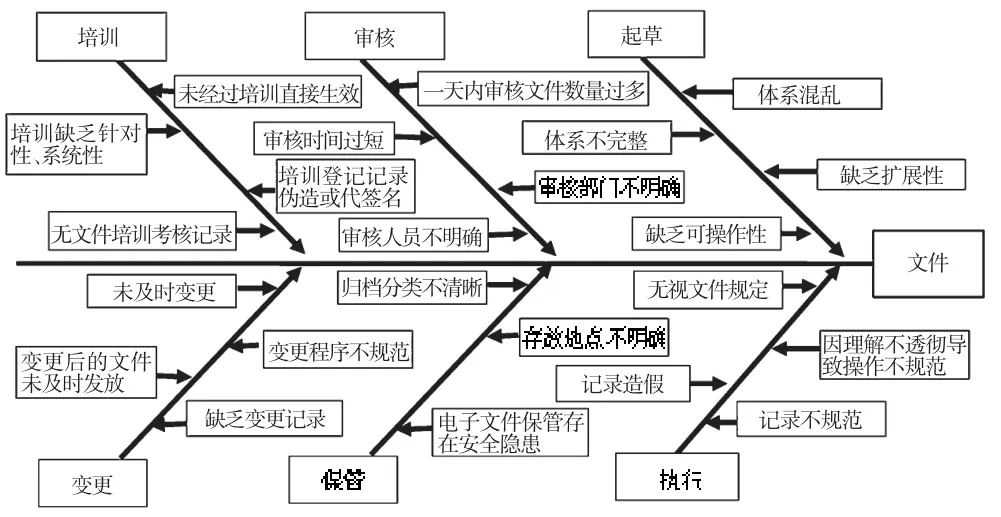
圖3 GMP文件生命周期管理問題魚骨圖Fig 3 Fishbone diagram of GMP document lifecycle management issues
文件起草是GMP文件生命周期管理的重要開端,直接關系到后續GMP文件審核、批準、執行等一系列活動。經筆者調研發現,不少制藥企業在起草文件時缺乏整體設計,具體表現在以下方面:(1)文件不成體系或體系混亂。部分企業的文件格式不統一,內容缺乏系統性、協調性;部分企業存在真假兩套文件,一套僅用于應付檢查,并無實際的指導意義。(2)文件體系不完整。部分企業的圖紙、標簽、貨位卡等無文件編號,為不可控文件;部分企業尚未制訂如風險管理、變更管理等2011年版GMP新增的文件。(3)所制訂文件缺乏可操作性。文件起草人員在起草文件時過多地依賴網絡資源,而對該企業的實際情況調查不足,導致起草的文件與企業實際生產環境、運行模式脫節。文件制訂不夠具體和細化,部分文件的操作參數不明確,有的參數范圍偏大,且不少參數的設定未經過充分驗證。(4)文件缺乏擴展性,不適應企業發展要求。
3.2 文件審核形式化
文件審核是GMP文件生命周期管理中的一個重要環節。通過審核,能夠發現文件在起草中存在的問題,確保文件的規范性、科學性和兼容性。在調研過程中,筆者查看了多家企業的GMP文件的審核記錄,發現存在以下問題:(1)同一審核人在一天內審核文件數量過多,審核時間過短,難以發現文件在起草中存在的諸如缺乏系統性、兼容性、可操作性等問題,文件審核成為應付監管部門檢查的一項形式性工作。(2)文件審核部門、審核人員不明確。部分企業的GMP文件未經質量管理部門審核,而部分企業的GMP文件審核人員多達十余個,審核基本只是簽名。
3.3 對相關人員的培訓效果不佳
依據GMP文件生命周期模型,文件批準后,將由文件起草人或審批人對相關部門的相關人員進行培訓后,文件才能夠正式生效。培訓的目的是使每個崗位的員工都能正確理解和掌握與本崗位有關的文件,能按照文件規定規范地、標準地開展工作。在調研中,筆者發現在文件生效前,某些企業存在未對相關人員進行培訓,培訓缺乏針對性、系統性,培訓登記記錄偽造或代簽名、無培訓考核記錄等問題。員工對文件內容或是一無所知,或是一知半解,直接影響到了文件的執行。
3.4 文件執行不到位
文件執行是GMP文件生命周期管理中最為重要的環節,是GMP管理的落腳點,直接關系到企業質量管理體系的有效性、真實性。從調查情況看,幾乎所有的企業在文件執行上都存在或多或少的問題,主要包括:(1)無視文件規定。如物料未經質量評價即批準放行。(2)對標準操作規程(SOP)理解不透徹,導致操作不規范。如某企業員工對潔凈區器具清洗SOP不理解,未嚴格按照SOP進行操作,造成器具清洗不徹底,引起交叉污染。(3)部分企業的偏差管理等文件雖然制訂完美,但并未能真正有效執行。如某生產批次的成品率僅為59%,而平均成品率是90%,被錯誤列為微小偏差,并未進行充分調查和詳細記錄。(4)記錄造假。如記錄中顯示某日已開啟使用某儀器,但實際當天并未開啟。(5)記錄不及時、不清晰、不完整,任意涂改和撕毀記錄,不按規定簽名和審核,直接影響到了產品質量的追溯和事故原因的調查。
3.5 文件處置不當
依據GMP文件生命周期管理模型,GMP文件生命周期管理的第八階段是文件處置,具體包括文件保管、復審、變更、替換、撤銷、銷毀等情況。調查發現,一些企業存在的主要問題包括:(1)文件歸檔分類不清晰,存放地點不明確,查找效率低下。(2)電子文件保管存在安全隱患。不少企業的電子文件可隨意更改、復制、刪除,且并未進行備份,難以保證其原始性、真實性、準確性和安全性。(3)文件變更控制不完善。一方面,文件未及時變更,如某企業的一臺設備已報廢3年,但相應的設備操作規程等文件并未進行變更;另一方面,文件變更程序不規范。部分企業變更文件只在原文件上劃改,或未經審批直接替換原文件;變更后的文件未及時發放到使用者手中,導致變更后的文件未能有效執行。
4 完善GMP文件生命周期管理的對策
4.1 頂層設計文件
4.1.1 工作流程科學化,文件體系統一化。企業可依據GMP文件生命周期管理思想,建立科學、合理的文件管理操作規程,實現工作流程科學化。質量管理部門明確文件分類和編號,確定本企業文件的統一格式,可避免隨意性和盲目性,實現文件體系統一化。調研發現,某些企業的文件表頭過于簡單,并不能充分反映該文件從起草到銷毀的完整的生命周期運動過程。為此,筆者設計了GMP文件表頭供企業參考,詳見圖4。

圖4 GMP文件表頭Fig 4 File header of GMP
4.1.2 文件起草團隊化。GMP文件起草團隊成員須經過GMP培訓并考核合格,全面掌握GMP的各項要求,熟悉本專業的技術和管理,實踐經驗豐富,并有較強的文件撰寫能力。文件起草需要在企業質量管理負責人的指導下進行,實行公司高層、工藝技術人員、管理人員和一線操作人員四方結合,明確責任分工,相互溝通協調。
4.1.3 文件內容專業化。①理解GMP要求,整體設計GMP文件。要做到文件目錄無遺漏、無重疊,文件系統內部互相協調一致,不得出現同一操作在不同的文件中相互矛盾的情況[5]。②符合企業實際,增強可操作性。文字表述準確、規范,不得模棱兩可,可量化的必須量化,相關參數需經過驗證,做到科學、嚴謹。③圖文并茂,清晰易懂。尤其是SOP,要盡量使用表格、清單和流程圖,以便于一線操作人員掌握。
4.2 明確職責,加強文件審批
文件審核人員需經過GMP培訓,具有較全面的專業知識,實踐經驗豐富,善于發現、糾正文件中的錯誤及不完善的地方,具有一定的決策、平衡和協調能力,具有嚴謹、認真、負責任的工作態度。建議企業預先設定具體文件的審核人,制訂文件審核職責對照表,明確審核部門和審核人,避免權責不清、相互推諉。文件審批職責應寫入部門職責、崗位職責中,并落實到人。此外,文件審核人員應控制單次審批的文件數量,留足充分的時間用于仔細審核文件,確保文件規范性、科學性和兼容性。GMP文件審核職責對照表見表1。

表1 GMP文件審核職責對照表Tab 1 GMP document audit responsibilities comparison table
4.3 強化培訓管理,提升培訓效果
依據GMP文件生命周期管理模型,在文件生效前,企業應對相關人員進行培訓。首先,企業高層必須充分認識到培訓的重要性,不得以各種理由取消或應付培訓。只有每個員工都系統學習、掌握崗位相關文件的有關要求,理解規范操作的重要性,認識到個體行為的偏差對整個藥品質量帶來的危害,GMP才能得到正確貫徹。
其次,培訓內容要有系統性、針對性。培訓師應該用通俗易懂的語言將起草背景、相關專業知識、文件內容、執行要點、檢查考核點以及執行文件時可能出現的問題、解決方法作系統而詳細的講解,幫助員工正確理解和使用文件,提高員工的質量意識和工作技能[6]。
再次,考核指標化,跟蹤常態化。培訓后應進行考核,與員工的待遇掛鉤,以確保培訓的效果[7]。要求真實填寫并保存培訓登記表、受訓人員簽名表、考核記錄、培訓效果評估表等資料。加強培訓后跟蹤,必要時對員工進行再培訓,保存再培訓的相關記錄。
4.4 完善獎懲機制,加強文件執行力度
一套科學、系統、嚴謹、可行的文件系統,只有切實落實到實際工作中才能真正發揮作用,才能確保企業質量管理體系的有效性,促進藥品生產過程科學化、規范化管理。針對當前許多企業存在的文件執行不到位的問題,筆者認為除了要強化培訓外,還應建立一套完善的獎懲機制,將各部門、各崗位的工作職責細化,制訂成具體、明確的評分項目,根據工作的落實完成情況進行評分;質管員、質量管理負責人、總經理等加強對實際生產操作過程的監督與糾正,并隨時進行現場監督評分;每月評分與獎金掛鉤,讓員工樹立起較強的質量意識和責任感,規范操作行為,并在日常工作中不斷強化,上升為一種真正的習慣。其次,有效溝通,形成良好的企業文化。在文件執行過程中遇到困難或出現問題時,管理者與執行者應及時溝通,及時發現問題,并盡快解決,確保文件有效性和先進性,鼓勵對GMP文件的創新改進。
4.5 科學存放,便于查閱
建立專門的GMP文件檔案室,按照GMP文件的類型進行科學分類、排列、編號,建立檔案存放位置索引,明確具體的存放位置,以便迅速存取檔案。鑒于GMP對不同的文件提出的保存期限不同,建議企業建立“文件保管期限表”,列出不同文件的保存期限,按時處理,防止遺忘和差錯。同時,定期檢查檔案保管情況,保證檔案的安全、完整。
不少制藥企業現有的電子文件管理方法較落后,需要升級改造或建立新的管理方法[8]。如建立電子文件流轉跟蹤登錄管理,限制對電子文件的操作權限,確保不出現任意篡改或者未經授權進入等情形[9]。任何更改和刪除記錄應在權限范圍內進行,其更改和刪除原因和過程應在記錄中得到體現。由于電子文件載體不穩定,應采用磁帶、縮微膠卷、紙質副本或其他方法進行備份,防止信息損失。此外,建立電子文件檢索目錄,可與相對應的紙質文件進行關聯,便于查找。
4.6 開展文件的變更控制
文件管理系統作為藥品生產質量管理體系的一個基本要素,要始終滿足藥品生產質量管理體系的有效運行。所有受變更影響的文件都應該按實際情況進行評估和修訂,并適時地進行控制。只有確保所有受影響的文件修訂完成之后,質量管理負責人才能核準實施變更[10]。任何人可提出文件變更申請,由文件原審核人、批準人評價變更的必要性。在已變更文件生效時,應收回所有相對應的舊文件,保證使用文件為批準的現行文本。文件管理部門應及時完成因某個文件的變更而引起的其他相關文件的變更。文件的任何變更必須進行詳細的記錄,以便追蹤檢查。
5 結語
GMP文件生命周期管理模型是一項重要的理論創新和突破,其對指導和解釋我國制藥企業文件管理中的一些實踐問題具有重要的現實意義。建議制藥企業可依據該模型全面剖析本企業在文件管理中存在的問題,制訂切實的整改措施和方案,提升質量管理水平,達到GMP認證要求。
[1]國家食品藥品監督管理總局.2013年7月各省新修訂藥品GMP認證企業進度情況[EB/OL].(2013-08-15)[2013-08-17].http://www.sda.gov.cn/WS01/CL0896/83294.html.
[2]敖津京.電子文件時代文件生命周期理論的生命力[J].企業導報,2013(9):296.
[3]汪達.淺談新版GMP文件系統編寫[J].機電信息,2012(5):26.
[4]Kashiwagi D,Kashiwagi J.A new risk management model[J].J Risk Analysis Crisis Response,2012,2(4):237.
[5]張煒,任銳龍.對藥品生產企業實施GMP的調查與思考[J].中國藥事,2011,25(2):187.
[6]王小衛.淺談新版GMP認證藥品生產企業的培訓管理[J].廣州化工,2013,41(17):263
[7]梁毅.論藥品生產企業GMP理念的建立[J].中國藥房,2011,22(45):4225.
[8]Stamatiadis D,Scribner S.A robust methodological approach for replacing global electronic document management[J].Drug Inf J,2009,43(3):243.
[9]金朝陽,何蕾.紙質文件與電子文件管理的相互關系[J].蘭臺內外,2010(5):59.
[10]Bland P.Assessing the impact of changes on GMP systems and documents[J].J GXP Compliance,2005,9(4):19.

