人真皮間充質干細胞對白癜風患者皮損周圍CD8+T淋巴細胞表達和分泌白介素13的影響
鮑華燁 周妙妮 許愛娥
人真皮間充質干細胞對白癜風患者皮損周圍CD8+T淋巴細胞表達和分泌白介素13的影響
鮑華燁 周妙妮 許愛娥
目的探討人真皮間充質干細胞(DMSC)對白癜風患者皮損周圍CD8+T淋巴細胞分泌表達白介素(IL)13的影響。方法細胞增殖檢測法(MTS)檢測重組IL-13(rIL-13)對黑素細胞增殖的影響。逆轉錄聚合酶鏈反應(RT-PCR)和Western印跡法分別檢測6例進展期尋常型白癜風患者皮損周圍及外周血中CD8+T淋巴細胞中IL-13基因和蛋白表達。實時熒光定量反轉錄聚合酶鏈反應(qRT-PCR)技術和酶聯免疫吸附試驗(ELISA)分別檢測DMSC與白癜風患者皮損周圍CD8+T淋巴細胞共培養前后細胞IL-13 mRNA水平和上清蛋白水平。結果不同濃度(10、50、100、250、500 μg/L)的 rIL-13 作用黑素細胞 24、48、72、96 h 后黑素細胞的增殖與對照組比較均未見明顯變化(均P>0.05)。白癜風患者皮損周圍及外周血中CD8+T淋巴細胞均可表達IL-13,但皮損周圍CD8+T淋巴細胞表達IL-13更顯著。將皮損周圍CD8+T淋巴細胞和DMSC共培養,CD8+T淋巴細胞IL-13 mRNA(0.100 0±0.002 4)和蛋白[(1 509.62±48.44)ng/L]的表達水平均顯著低于單獨培養的CD8+T淋巴細胞[mRNA:0.383 2±0.018 7,蛋白:(5 507.98±34.11)ng/L,均P<0.05]。結論白癜風患者皮損周圍CD8+T淋巴細胞高表達IL-13,DMSC能夠有效地抑制其表達IL-13,或許可作為白癜風的治療靶點之一。
白癜風;CD8陽性T淋巴細胞;間質干細胞;白細胞介素13
白癜風是一種獲得性色素脫失性疾病,該病發病機制不明,治療困難。研究表明,白癜風皮損周圍真皮淺層內存在大量的CD8+T淋巴細胞浸潤,浸潤的淋巴細胞具有黑素細胞抗原特異性,能選擇性殺傷黑素細胞并引起角質形成細胞凋亡,從而造成正常皮膚的色素減退[1],可能是白癜風的發病機制之一,因此抑制白癜風皮損部位CD8+T淋巴細胞的活性,調節皮損部位的免疫微環境,可能是治療白癜風的重要手段。間充質干細胞(mesenchymal stem cell,MSC)是一類能夠自我更新,具有多向分化能力的干細胞。有研究表明,MSC可誘導活化的T細胞凋亡[2]。我們前期[3]已經將人真皮來源的間充質干細胞(dermal mesenchymal stem cell,DMSC)和白癜風患者CD8+T淋巴細胞共同培養,發現DMSC抑制患者CD8+T淋巴細胞的活性和增殖,并促進其凋亡,而且患者皮損周圍CD8+T淋巴細胞和DMSC共同培養后,多種細胞因子分泌下降,其中白介素(IL)-13的下降較為顯著[3]。本研究以IL-13為靶點,旨在研究IL-13在DMSC和白癜風患者皮損周圍CD8+T淋巴細胞介導的免疫反應中可能發揮的作用。
材料與方法
一、材料
1.主要試劑和儀器:Trizol試劑購自美國Invitrogen公司,淋巴細胞分離液購自美國Sigma-Aldrich公司,MACS分選磁珠購自德國Miltenyi公司,SYBR? Premix Ex TaqTM購自日本TaKaRa公司,2×Taq Master Mix、細胞增殖與毒性檢測試劑盒(MTS)均購自美國Omega公司,重組IL-13和抗IL-13單克隆抗體及IL-13 ELISA試劑盒購自美國RD公司。梯度PCR儀購自德國Eppendorf公司,CFX96實時熒光定量PCR儀系美國Bio-Rad公司產品。
2.PCR引物序列:①IL-13,上游5'-ATTGCTC TCACTTGCCTTGG-3',下游5'-CAGGTTGATGCTCC ATACCA-3;②肌動蛋白,上游5'-GTCTTCCCCTCC ATCGTG-3',下游 5'-AGGGTGAGGATGCCTCT CTT-3'。
二、方法
1.CD8+T淋巴細胞的分離和培養:6例尋常型白癜風進展期患者中男4例,女2例,年齡18~50歲(平均29歲)。排除伴發甲狀腺功能亢進、糖尿病、紅斑狼瘡、特應性皮炎、斑禿等自身免疫性疾病者。試驗方案經醫院倫理委員會批準,患者均簽署知情同意書。皮損周圍CD8+T淋巴細胞的分離和培養:取患者白斑邊緣的皮膚組織0.5 cm×1.0 cm,去除皮下組織,切成小塊(0.1~0.2 cm2),置于含10%胎牛血清的RPMI1640完全培養基,添加抗CD3/CD28抗體磁珠,放入37℃,5%CO2的細胞培養箱內培養。外周血CD8+T淋巴細胞的分離和培養:抽取患者外周血,用淋巴細胞分離液分離獲得外周血單一核細胞(PBMC),將PBMC進行磁珠分選獲得CD8+T淋巴細胞,添加抗CD3/CD28抗體磁珠,置于RPMI1640完全培養基中,放入細胞培養箱內培養。取對數生長期細胞用于實驗。
2.DMSC的分離和培養:標本取自本院泌尿外科健康男性包皮環切術后表皮組織,剪成小片。用分離酶4℃消化分離表真皮,真皮用0.35%的膠原酶Ⅰ37℃振蕩消化,再加入DNA酶37℃消化后,獲得細胞懸液,接種于含DMSC培養基的培養皿中,置于5%CO2培養箱37℃孵育。經鑒定[4]此細胞符合間充質干細胞的特點,取對數生長期細胞用于實驗。
3.皮損周圍CD8+T淋巴細胞和DMSC共培養:參考之前的研究[4],將 DMSC(細胞濃度為 5×105/ml)接種于6孔板,培養24 h后,每孔加入新鮮分離純化的CD8+T淋巴細胞(細胞濃度為1×106/ml,1∶2)共培養,同時加入抗CD3/CD28抗體磁珠刺激生長,對照組為皮損周圍CD8+T淋巴細胞單獨培養,空白組為DMSC單獨培養。72 h后收集細胞和上清。
4.黑素細胞的分離和培養:標本取自我院泌尿外科健康男性包皮環切術后表皮組織,分離表真皮,表皮以胰蛋白酶和乙二胺四乙酸孵育10 min,離心,重懸細胞,培養3 d后加入基因素以去除角質形成細胞和成纖維細胞,繼續培養。取對數生長期細胞用于實驗。
5.重組IL-13(rIL-13)對黑素細胞增殖影響的測定:參考 Choi等[5]的方法,用 MTS 法,調節黑素細胞濃度至5×103/ml,以100 μl/孔接種于96孔板,培養24 h后,分別加入100 μl rIL-13濃度為10、50、100、250、500 μg/L 的黑素培養基, 對照組只加培養基,每組設6個復孔,實驗重復3次。分別培養24、48、72、96 h 后終止培養, 分別向對照組、rIL-13處理組每孔加入20 μl MTS溶液,孵育3 h,酶聯免疫分析儀490 nm處測吸光度值(A)。細胞增殖率=rIL-13處理組A490/對照組A490×100%。
6.反轉錄(RT)-PCR檢測IL-13基因的表達:按照Trizol說明書分別提取皮損周圍和外周血CD8+T淋巴細胞總RNA,紫外分光光度計測定RNA純度和濃度。反轉錄制備cDNA,RT反應條件:65℃ 10 min,55℃ 30 min,85℃ 5 min。PCR擴增體系包括 12.5 μl 2×Taq Master Mix,1.0 μl引物,2 μl cDNA 模板,9.5 μl無核酸水。反應條件:95℃預變性5 min;95℃變性40 s,60℃退火30 s,72℃延伸30 s,35個循環;72℃延伸7 min。反應結束后,取反應液進行電泳,確認PCR反應產物。
7.實時熒光定量反轉錄聚合酶鏈反應(qRT-PCR)檢測IL-13 mRNA的表達:提取并逆轉錄皮損周圍CD8+T淋巴細胞、DMSC及兩者共培養后的CD8+T淋巴細胞。PCR擴增體系包括cDNA模板2μl,引物 1.0 μl,SYBR Premix Ex TaqTM12.5 μl,dH2O 9.5 μl,擴增條件:預變性95℃ 30 s;95℃ 5 s,60℃30 s,共40個循環,在每個循環結束前用LightCycle系統自動檢測熒光產物的量。在實時熒光定量PCR儀上讀取擴增曲線、熔解曲線和Ct值。
8.Western印跡法檢測IL-13蛋白表達:提取皮損周圍和外周血CD8+T淋巴細胞總蛋白-70℃保存。蛋白定量,煮沸變性,電泳并濕轉轉膜,封閉,分別加入抗IL-13抗體及β肌動蛋白抗體,4℃搖床上過夜,洗膜,分別加二抗1 h,洗膜,曝光顯影。以β肌動蛋白作為內參照,用ImageJ圖像分析軟件分析目的蛋白灰度值。
9.酶聯免疫吸附試驗(ELISA)檢測IL-13蛋白的表達:收集皮損周圍CD8+T淋巴細胞、DMSC及兩者共培養后的CD8+T淋巴細胞的上清液,用雙抗體夾心ELISA法檢測上清液中IL-13的含量,實驗步驟嚴格按試劑盒說明書操作。
10.統計學方法:用SPSS 17.0統計軟件對實驗結果進行t檢驗,P<0.05為差異有統計學意義。
結 果
一、rIL-13對黑素細胞增殖的影響
通過MTS檢測發現,用濃度分別為10,50,100,250 μg/L 的 rIL-13 處理黑素細胞 24、48、72、96 h,各處理組黑素細胞的增殖與對照組相比,均P>0.05,差異無統計學意義,可見,rIL-13對黑素細胞的增殖無明顯影響(表1)。
表1 不同濃度重組白介素-13(rIL-13)對黑素細胞增殖的影響(±s)
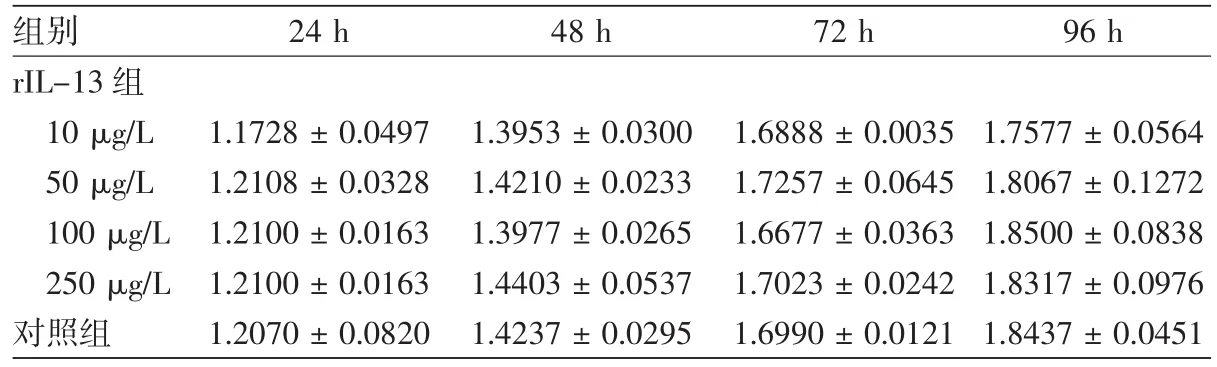
表1 不同濃度重組白介素-13(rIL-13)對黑素細胞增殖的影響(±s)
注:n=3,將不同時間點各濃度rIL-13組和對照組比較,均P>0.05
組別 24 h 48 h 72 h 96 h rIL-13組10 μg/L 1.1728±0.0497 1.3953±0.0300 1.6888±0.0035 1.7577±0.0564 50 μg/L 1.2108±0.0328 1.4210±0.0233 1.7257±0.0645 1.8067±0.1272 100 μg/L 1.2100±0.0163 1.3977±0.0265 1.6677±0.0363 1.8500±0.0838 250 μg/L 1.2100±0.0163 1.4403±0.0537 1.7023±0.0242 1.8317±0.0976對照組 1.2070±0.0820 1.4237±0.0295 1.6990±0.0121 1.8437±0.0451
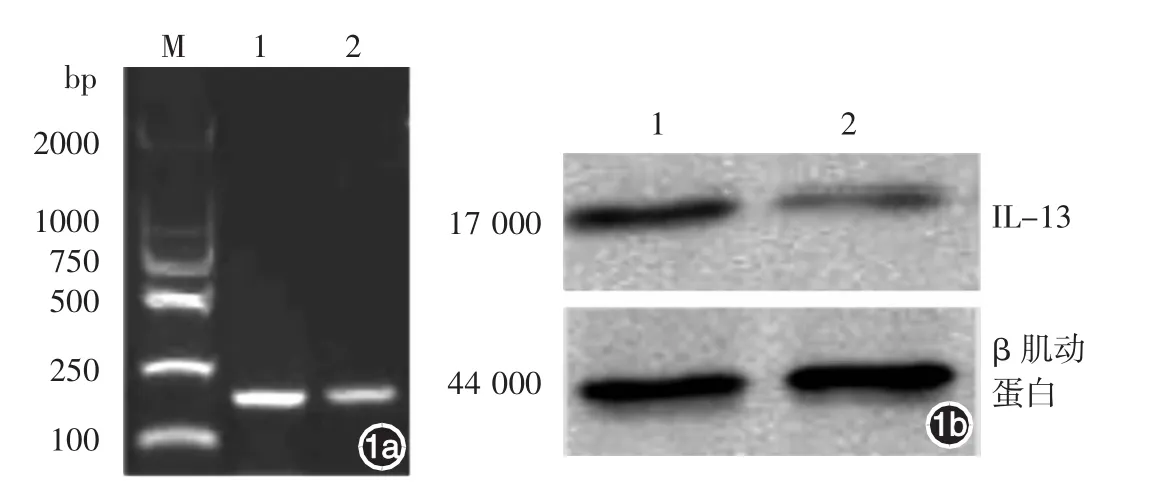
圖1 白介素(IL)-13在兩組CD8+T淋巴細胞的表達 1a:逆轉錄(RT)-PCR產物電泳圖;1b:Western印跡結果。M:標準參照物;1:患者皮損周圍CD8+T淋巴細胞;2:患者外周血CD8+T淋巴細胞
二、IL-13在白癜風患者皮損周圍及外周血CD8+T淋巴細胞中的表達
RT-PCR產物電泳示,白癜風患者皮損周圍及外周血CD8+T淋巴細胞均擴增出大小約為150 bp的IL-13基因條帶,提示兩種來源的CD8+T淋巴細胞均表達IL-13基因,并且皮損周圍CD8+T淋巴細胞條帶亮于外周血CD8+T淋巴細胞,表明皮損周圍CD8+T淋巴細胞表達IL-13 mRNA更顯著(圖1a)。Western印跡示,白癜風患者皮損周圍及外周血CD8+T淋巴細胞均可見到相對分子質量17 000的IL-13蛋白特異性條帶,且皮損周圍CD8+T淋巴細胞條帶更明顯,皮損周圍及外周血CD8+T淋巴細胞的IL-13蛋白/β肌動蛋白灰度值比值分別為0.712±0.035和0.225±0.023,兩組細胞相比,差異有統計學意義(t=16.223,P<0.05),結果表明,皮損周圍CD8+T淋巴細胞表達IL-13蛋白更顯著(圖1b)。
三、DMSC抑制患者皮損周圍CD8+T淋巴細胞IL-13基因和蛋白的表達
qRT-PCR結果顯示,和DMSC共培養后的患者皮損周圍CD8+T淋巴細胞IL-13 mRNA表達水平(0.1000±0.0024)明顯低于單獨培養的皮損周圍CD8+T淋巴細胞(0.3832±0.0187),t=37.654,P<0.05。DMSC抑制CD8+T淋巴細胞分泌IL-13,而其本身幾乎不表達IL-13(0.0064±0.0006)。ELISA結果顯示,患者皮損周圍CD8+T淋巴細胞與DMSC共培養后,IL-13的表達水平(1509.62±48.44)ng/L顯著低于單獨培養的皮損周圍CD8+T淋巴細胞(5507.98±34.11)ng/L(t=98.321,P<0.05)。DMSC很少表達IL-13蛋白[(316.57±1.99)ng/L]。
討 論
已經證實白癜風患者皮損周圍有大量黑素細胞抗原特異性CD8+T淋巴細胞浸潤,淋巴細胞的浸潤可導致黑素細胞的損害[6]。MSC是一類多潛能干細胞。研究表明,MSC可抑制絲裂原和抗原提呈細胞誘導的T細胞活化及淋巴細胞的增殖反應,并能調節淋巴細胞部分細胞因子的分泌[7-8]。人真皮來源的間充質干細胞可抑制皮膚歸巢CD8+T淋巴細胞的增殖,并誘導其凋亡,抑制CD8+T淋巴細胞產生細胞因子和趨化因子[9]。
IL-13為重要的Th2型細胞因子,于1993年第一次描述,在活化的人類T淋巴細胞的分子克隆中被識別[8]。其生物學功能主要包括參與IgE合成,在氣道的結構和炎癥細胞中起重要作用等。在本研究中,我們比較了白癜風患者皮損周圍及外周血CD8+T淋巴細胞表達IL-13的差異,發現患者皮損周圍CD8+T細胞分泌IL-13更為顯著。IL-13對T細胞的活化沒有直接的影響,但是可通過多種途徑影響Th2型反應,如誘導Th2型細胞募集的趨化因子的表達。本研究中,我們發現患者皮損周圍CD8+T淋巴細胞較外周血CD8+T淋巴細胞比較,分泌IL-13更顯著,提示IL-13和CD8+T淋巴細胞的活性可能相關。DMSC具有免疫抑制功能,以往研究[10]提示,不同來源的MSC可以抑制T細胞的活化、增殖以及遷移,進而抑制T細胞的免疫反應。我們將DMSC和患者CD8+T淋巴細胞共同培養后,發現CD8+T淋巴細胞分泌細胞因子IL-13水平明顯下降,由此推測DMSC抑制CD8+T淋巴細胞的活化、增殖或遷移,從而使CD8+T淋巴細胞分泌的細胞因子減少,包括IL-13。我們將不同濃度的rIL-13加入黑素細胞培養基中,觀察其對黑素細胞增殖的影響,結果發現培養72 h后,不同濃度rIL-13對黑素細胞的增殖無明顯影響,推測IL-13與黑素細胞的增殖無明顯相關,可能是CD8+T淋巴細胞的活性標志之一,有關IL-13的具體作用機制尚待進一步研究。
綜上所述,本研究提示白癜風患者皮損周圍CD8+T淋巴細胞分泌IL-13,而DMSC能夠免疫抑制CD8+T細胞的功能和活性,抑制CD8+T細胞分泌IL-13,IL-13可能與白癜風皮損周圍的微環境和CD8+T淋巴細胞的毒性和活性相關。
[1]Van den Boorn JG,Konijnenberg D,Dellemijn TA,et al.Autoimmune destruction of skin melanocytes by perilesional T cells from vitiligo patients[J].J Invest Dermatol,2009,129(9):2220-2232.
[2]Plumas J,Chaperot L,Richard MJ,et al.Mesenchymal stem cells induce apoptosis of activated T cells[J].Leukemia,2005,19(9):1597-1604.
[3]Wu J,Zhou M,Wan Y,et al.CD8+T cells from vitiligo perilesional margins induce autologous melanocyte apoptosis[J].Mol Med Rep,2013,7(1):237-241.
[4]Zhou MN,Zhang ZQ,Wu JL,et al.Dermal mesenchymal stem cells(DMSCs)inhibit skin-homing CD8+T cell activity,a determining factor of vitiligo patients'autologous melanocytes transplantation efficiency[J/OL].PLoS One,2013,8(4):e60254[2013-9-23]. http://www.plosone.org/article/info% 3Adoi%2F10.1371%2Fjournal.pone.0060254
[5]Choi H,Choi H,Han J,et al.IL-4 inhibits the melanogenesis of normal human melanocytes through the JAK2-STAT6 signaling pathway[J].J Invest Dermatol,2013,133(2):528-536.
[6]van den Wijngaard R,Wankowicz-Kalinska A,Le Poole C,et al.Local immune response in skin of generalized vitiligo patients.Destruction of melanocytes is associated with the prominent presence of CLA+T cells at the perilesional site[J].Lab Invest,2000,80(8):1299-1309.
[7]Le Blanc K,Rasmusson I,Sundberg B,et al.Treatment of severe acute graft-versus-host disease with third party haploidentical mesenchymal stem cells[J].Lancet,2004,363(9419):1439-1441.
[8]Le Blanc K,Tammik L,Sundberg B,et al.Mesenchymal stem cells inhibit and stimulate mixed lymphocyte cultures and mitogenic responses independently of the major histocompatibility complex[J].Scand J Immunol,2003,57(1):11-20.
[9]Minty A,Chalon P,Derocq JM,et al.Interleukin-13 is a new human lymphokine regulating inflammatory and immune responses[J].Natrue,1993,362(6417):248-250.
[10]Najar M,Raicevic G,Fayyad-Kazan H,et al.Impact of different mesenchymal stromal cell types on T-cell activation,proliferation and migration[J].Int Immunopharmacol,2013,15(4):693-702.
2013-02-07)
(本文編輯:尚淑賢)
Effect of human dermal mesenchymal stem cells on the expression and secretion of interleukin-13 by perilesional CD8+T lymphocytes from patients with vitiligo
Bao Huaye,Zhou Miaoni,Xu Aie.Hangzhou Clinical College Affiliated to Anhui Medical University,Department of Dermatology,Third People's Hospital of Hangzhou,Hangzhou 310009,China
Xu Aie,Email:xuaiehz@msn.com
ObjectiveTo evaluate the effect of human dermal mesenchymal stem cells(DMSCs)on the expression and secretion of interleukin(IL)-13 by perilesional CD8+T lymphocytes from patients with vitiligo.MethodsTissue specimens were obtained from the perilesional region of six patients with active vitiligo,and CD8+T lymphocytes were isolated from both the tissue specimens and peripheral blood of these patients.DMSCs and melanocytes were obtained from the foreskin tissue of healthy males.The 3-(4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium,inner salt(MTS)assay was performed to estimate the effect of different concentrations of recombinant IL-13 on the proliferation of melanocytes,reverse transcripition-PCR and Western blotting to detect the mRNA and protein expressions of IL-13 in perilesional and peripheral blood CD8+T lymphocytes respectively,real-time quantitative reverse transcription (RT)-PCR and enzyme-linked immunosorbent assay(ELISA)to detect the IL-13 mRNA expression in,and IL-13 protein expression in the culture supernatant of,CD8+T lymphocytes before and after coculture with DMSCs,respectively.Statistical analysis was done byttest.ResultsNo obvious changes were observed in the proliferation of melanocytes treated with different concentrations(10,50,100,250,500 μg/L)of recombinant IL-13 for various durations(24,48,72 and 96 hours)compared with untreated melanocytes(allP>0.05).Both perilesional and peripheral blood CD8+T lymphocytes expressed IL-13,and the expression was stronger in perilesional than in peripheral blood CD8+T lymphocytes.A significant decrease was noted in IL-13 mRNA expression(0.100 0±0.002 4 vs.0.383 2±0.018 7,P<0.05)and protein level in the culture supernatant((1 509.62±48.44)ng/L vs.(5 507.98±34.11)ng/L,P<0.05)of CD8+T lymphocytes cocultured with DMSCs compared with monocultured CD8+T lymphocytes.ConclusionsThere is a strong expression of IL-13 by perilesional CD8+T lymphocytes in patients with vitiligo,which may be inhibited by DMSCs and serve as a target for the treatment of vitiligo.
Vitiligo;CD8-positive T-lymphocytes;Mesenchymal stem cells;Interleukin-13
10.3760/cma.j.issn.0412-4030.2014.01.007
國家自然科學基金(81071294,81271758);浙江省自然科學基金(Z2100973)
310009杭州,安徽醫科大學附屬杭州臨床學院,杭州市第三人民醫院皮膚科
許愛娥,Email:xuaiehz@msn.com

