厭氧氨氧化耦合脫氮系統中反硝化細菌研究
王春香,劉常敬,鄭林雪,李 軍 (北京工業大學建筑工程學院,北京 100124)
厭氧氨氧化耦合脫氮系統中反硝化細菌研究
王春香,劉常敬,鄭林雪,李 軍*(北京工業大學建筑工程學院,北京 100124)
采用聚合酶鏈式反應、分子克隆等分子生物學方法,通過構建nirS克隆文庫研究了厭氧氨氧化耦合異養反硝化脫氮系統中的反硝化微生物.進行同源性分析和系統發育樹構建,結果表明,從nirS克隆文庫中隨機挑選的100個克隆子中有51個陽性克隆子,共分為12個操作單元.經比對發現這些微生物主要為變形菌門細菌和未知菌類,其中 β-proteobacteria占據絕對優勢且有較多種類,少部分屬于γ-proteobacteria.
厭氧氨氧化;反硝化菌;聚合酶鏈式反應(PCR);nirS克隆文庫
厭氧氨氧化(ANAMMOX)工藝是由荷蘭Delft大學開發的生物脫氮新技術[1],厭氧氨氧化反應器對氮的去除主要是利用厭氧氨氧化細菌作用,以氨氮為電子受體,將亞硝酸鹽氮還原為氮氣.反硝化作用的概念是由Gayon等[2]于 1882 年提出的,是指硝酸根和亞硝酸根通過微生物的異養還原作用,變成一氧化氮,一氧化二氮,或最終還原成氮氣的過程,在廢水處理系統中反硝化作用已經發展成為一個有效去除氮素的步驟.異養的反硝化過程需要碳源,研究發現,不但小分子的有機物,如甲醇、甲醛等可以作為反硝化過程的能量物質,一些復雜的大分子有機物也能夠被反硝化細菌所利用.根據這一特性,可以利用反硝化細菌來降解廢水中的復雜有機物.反硝化作用主要是由反硝化細菌引起的,反硝化細菌具有降解各種有機污染物的能力,包括芳香族和脂肪烴類[3].然而大部分細菌是不可培養或難以培養的,使得分離培養方法研究反硝化細菌往往不夠全面,利用分子生物學方法來認識反硝化菌將更具有科學性.
反應器以苯酚作為有機碳源,酚等有機物雖然對微生物有抑制作用,但可以作為電子供體用于反硝化[4-6],反硝化降解酚類有機物就會解除其毒性抑制作用.Toh等[7]在用ANAMMOX工藝處理焦化廢水的研究中證實了反硝化菌的存在.
本實驗利用PCR、分子克隆等分子生物學方法,研究了以苯酚為電子供體的厭氧氨氧化耦合異養脫氮系統內的反硝化菌的種類.
1 材料與方法
1.1 采樣
污泥取自厭氧氨氧化耦合異養反應器底部.試驗采用 UASB生物膜反應器,有效容積為10L,反應器內溫度維持在 25℃左右,水力停留時間為1.5h,進水pH值控制在7.8左右,反應器長期穩定運行.反應器的進出水指標如圖 1所示.-N、-N去除率高達 100%,TN去除率為 87.51%,異養反硝化對 TN去除貢獻率達到13.28%.
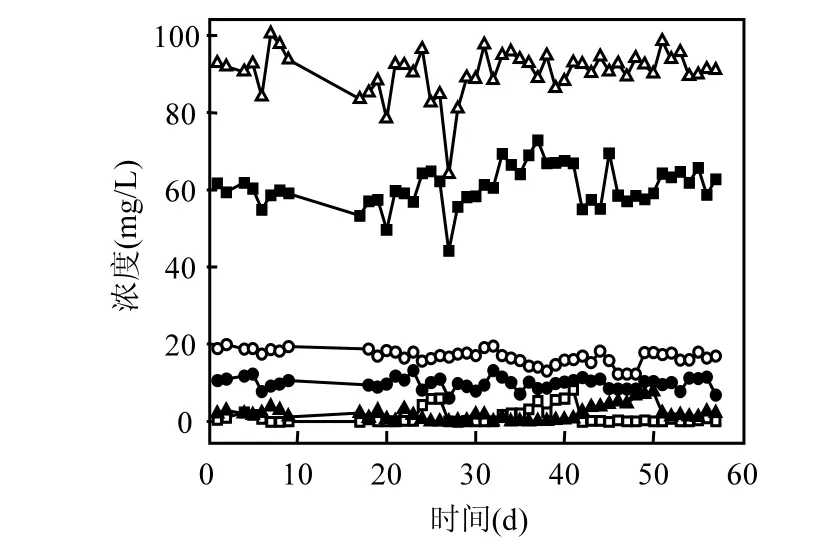
圖1 進、出水-N、-N和-N含量變化Fig.1 Variation of -N, -N and -N during the operation
1.2 細菌總DNA提取
泥樣在1.5mL離心管中靜沉10min后舍去上清液,15000r/min高速離心 5min后,去除上層清液,取0.3g用于總DNA提取,剩余污泥冷凍備用.采用Ezup柱式基因組DNA提取試劑盒(上海生工)提取后,取 5μL用 1.2%瓊脂糖凝膠檢測.其余置于-20℃儲存備用.
1.3 聚合酶鏈式反應(PCR)
將提取的細菌總 DNA作為 PCR的模板,PCR反應在 MyiQ Real-time PCR擴增儀(美國,Bio-Rad)上進行,采用反硝化菌特異性引物對nirS1F和nirS6R[8].nirS1F和nirS6R引物序列分別為:
nirS1F:5’-CCT A(C/T)T GGC CGC C (A/G)C A (A/G)T-3’
nirS6R:5’-CGT TGA ACT T (A/G)C CGG T-3’
采用25μL反應體系:10x PCR Buffer, 2.5μL;dNTPs (各 2.5mmol/L),1.0μL; MgCl2(25mmol/L),1.5μL;nirS1F(20μmol/L),0.5μL;nirS6R(20μmol/L),0.5μL;Taq酶(5U,Takara)0.3μL; DNA 1.0μL,加滅菌超純水到25μL.
PCR 反應條件:95℃預變性 6min;95℃變性30s,60℃退火40s,72℃延伸1min,10個循環;95℃變性 30s,55℃退火 40s,72℃延伸 1min,25個循環;72℃延伸7min;4℃保持.
1.4 克隆、轉化和nirS克隆文庫的建立
PCR產物采用 SanPrep 柱式 DNA 膠回收試劑盒(上海生工)進行純化后,與pMD18-T載體(Takara)連接.連接體系(總體積 10μL):PCR 產物3μL;pMD18-T Vector 1μL;Solution I 5μL;ddwater 1μL.將連接產物轉入 DH5α感受態細胞中,用含X-Gal、IPTG、Amp的LB培養基37℃培養16h后,進行藍白班篩選.從克隆文庫中隨機挑選 100個白斑,用pMD18-T載體引物RV-M和M13-47作為PCR引物,驗證篩選的克隆插入的片段大小是否正確.
M13-47:5’-GAGCGGATAACAATTTCAC ACAGG-3’;
RV-M:5’-CGCCAGGGTTTTCCCAGTCAC GAC-3’.
片段大小正確的PCR產物用 Hha I (Takara,Japan)限制性內切酶進行酶切.Hha I 酶切體系(10μL)為:Hha I,0.5μL;10×PCR Buffer,1μL;PCR產物5μL;ddwater,3.5μL.酶切反應于37℃進行4h,酶切產物用 3%的瓊脂糖凝膠電泳檢測,然后在凝膠成像系統中成像,并根據凝膠成像結果中的酶切帶型劃分操作單元(OTU).基因文庫中每個OTU選擇一個代表菌株送往上海生工生物公司測序.
2 結果與討論
2.1 細菌總DNA提取
污泥樣品提取的總 DNA經瓊脂糖凝膠電泳檢測,DNA提取電泳圖如圖 2,可見所提取的 DNA片段分子量大小在 23kbp左右,屬于比較完整的細菌總 DNA,適用于下一步PCR擴增.
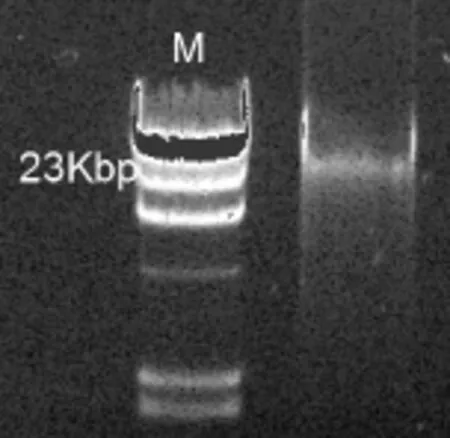
圖2 細菌總DNA提取電泳Fig.2 Electrophoresis of the DNA extracts
2.2 PCR擴增及產物純化
PCR擴增結果如圖 3所示.用反硝化細菌nirS基因特異性引物擴增所產生的DNA片段大小為890bp,符合預期的長度,但有非特異性擴增,需要進行切膠純化.圖4為PCR擴增產物切膠純化后的結果.
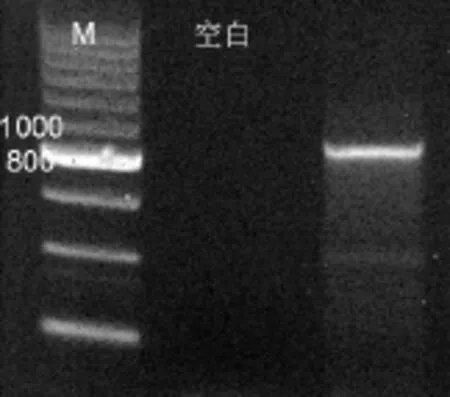
圖3 反硝化細菌PCR擴增電泳圖Fig.3 Electrophoresis of the PCR productions
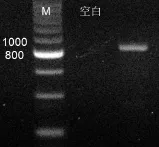
圖4 反硝化細菌PCR擴增產物純化Fig.4 Electrophoresis of the PCR productions after purification
2.3 反硝化細菌nirS克隆文庫
在構建的反硝化細菌nirS克隆文庫中,隨機挑選100個進行PCR,共得到51個陽性克隆子.圖5為部分結果.
圖5 克隆子的PCR電泳Fig.5 Electrophoresis of the PCR results of clones
2.4 反硝化菌的酶切和序列測定
采用Hha I限制性內切酶對51個陽性克隆子進行酶切分型,部分酶切結果如圖5所示.共得到12個OTUs,每個OUT所包含的克隆子數量不一樣,從1到21個不等.
圖6 HhaI酶切圖譜Fig.6 Restriction patterns of denitrifying bacteria digested by Hha I
對12個OUTs的代表性克隆子進行克隆測序,將測序所得基因序列輸入到NCBI網站,利用BLAST程序與數據庫中已有的序列進行比對鑒定,發現大部分克隆子比對后與最近物種的相似度為 77%~94%.這是由于 nirS基因序列較長(達900bp左右).因此比對到的與最相似物種的相似度并沒有像普通 16SrDNA比對結果那么高(200bp左右的16SrDNA比對的相似度一般都高達 99%左右.根據莫旭華等[9]的群落結構計算方法和系統學分析,該文庫的庫容大小為 90%,Shannon–Weiner指數為 2.02, Simpson指數為0.79,豐富度為3.05.
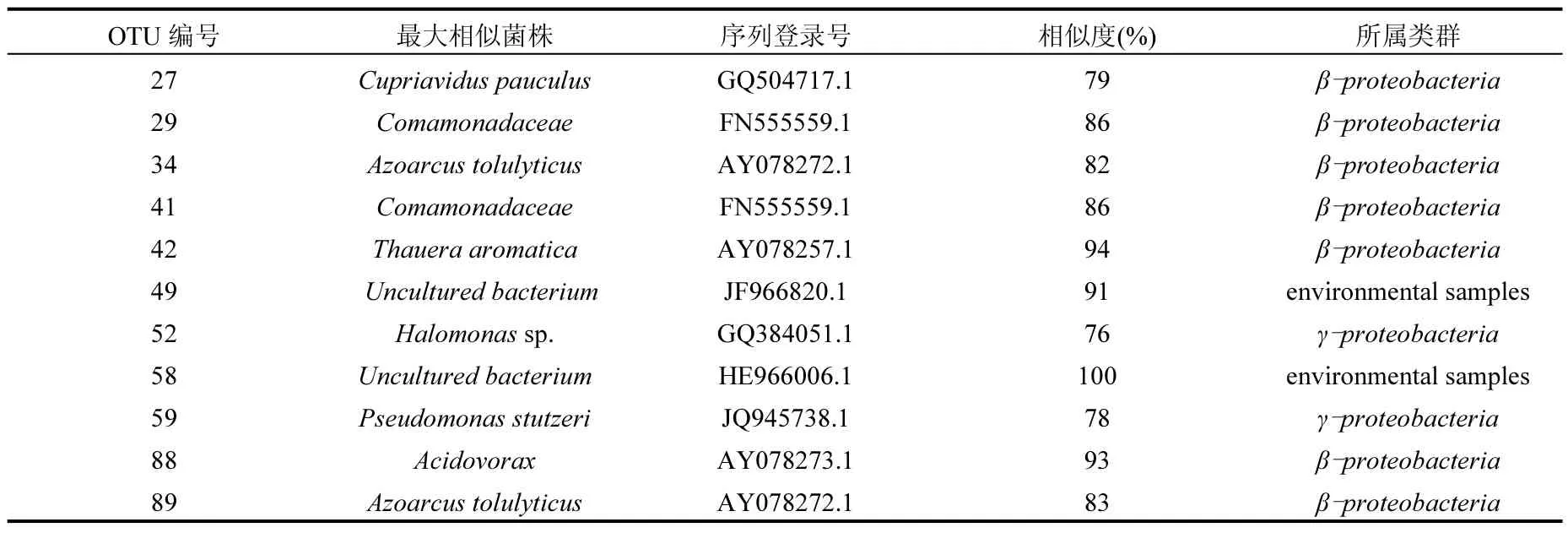
表1 樣品克隆測序比對結果Table 1 Results of the best march to known species of the clones
表1所示為克隆序列測序比對后的信息.從表中可以看出比對的結果主要為變形菌門細菌和未知菌類.其中β-proteobacteria占據絕對優勢且有較多種類,其 OTUs和克隆豐富度分別為58.3%和 62.7%.少部分屬于 γ-proteobacteria的Pseudomonas stutzeri(惡臭假單胞菌屬)和鹽單胞菌屬(Halomonas sp.),其 OTUs和克隆豐富度分別為16.7%和7.8%.說明變形桿菌在該脫氮系統中是最主要的菌群[10],還有部分未培養的環境樣品,其OTUs和克隆豐富度分別為16.7%和9.8%,證實了傳統純化分離、培養等微生物學分析測定技術難于真實準確的反映出反應器運行過程中微生物的群落構成及數量,分子生物學技術可以檢測出未培養菌屬和未知菌屬,優勢顯而易見.此外,還有一個克隆在數據庫中比對后沒有找到已知的相近物種,未能得到詳細信息,相關研究也得出類似結論[11-12].
鄭平等[13]和Heylen等[14-15]指出,各種環境中最常見的反硝化細菌都屬于變形菌綱.在污水中,nirS反硝化菌屬多是 β-proteobacteria和γ-proteobacteria[16].在本研究中,比對得到的菌屬大 部 分 歸 屬 于 Proteobacteria 門,βproteobacteria綱數量上占有絕對優勢,包括Comamonadaceae、Azoarcus tolulyticus、Thauera aromatica和 Cupriavidus.少部分屬于γ-proteobacteria,包括 Pseudomonas stutzeri 和Halomonas sp.,研究結果具有一致性.這些細菌不僅具有反硝化作用,而且為異養型細菌,對有機碳源苯酚的降解有重要作用.對于苯酚生物降解的研究,國外起步比較早,己經分離得到的許多苯酚降解菌中就包括 Pseudomonas[17-21].β-proteobacteria綱中的 Azoarcus和 Thauera屬的大多數成員都與反硝化條件下芳香族化合物[22-23]的降解有關.Anders等[24]在1995年發現,在厭氧條件下 Thauera aromatica能夠利用phenol、benzoate等作為唯一碳源生長來降解污染物.此外,Manefield等[25]使用RNA-SIP 技術證明 Thauera sp.和Acidovorax[26]是苯酚的主要降解菌.1997年,Hinteregger等[27]發現在鼓泡塔反應器中Halomonas sp.可完全降解鹽含酚廢水中的苯酚.Comamonadaceae屬細菌具有降解芳香族化合物的能力也已被報道[28-29].本研究中,苯酚濃度 18.82mg/L的條件下,耦合反應器能長期穩定運行.異養反硝化對 TN去除貢獻率達到13.28%,可以證明 Proteobacteria對于系統的脫氮和苯酚的降解有很大貢獻.
王弘宇等[30]發現生物陶粒脫氮反應區內假單胞菌(Pseudomonas sp.)對氮素的去除率達到 43.90%.李佳霖等[31]研究長江口鄰近海域沉積物中通過微生物的反硝化途徑去除的氮約為初級生產消耗無機氮量的1/3.以上數據說明,反硝化細菌對于污水生物處理系統內氮素的去除有很大的貢獻.本研究中,反硝化菌對 TN去除貢獻率達到 13.28%,與以上研究結果具有相似性.
2.5 構建系統發育樹
對獲得的克隆和相應的最相近已知物種構建系統發育樹,結果如圖7所示.從系統發育樹可以看出,大部分的陽性克隆子和已知的反硝化細菌具有較高的相似性,也就說明了在本研究中的反硝化菌基本由普通的反硝化菌構成.同時也有大量分離的克隆子不與目前已知的 nirS 基因相似,屬于未知菌屬,說明水處理中的反硝化群落需要進一步研究.
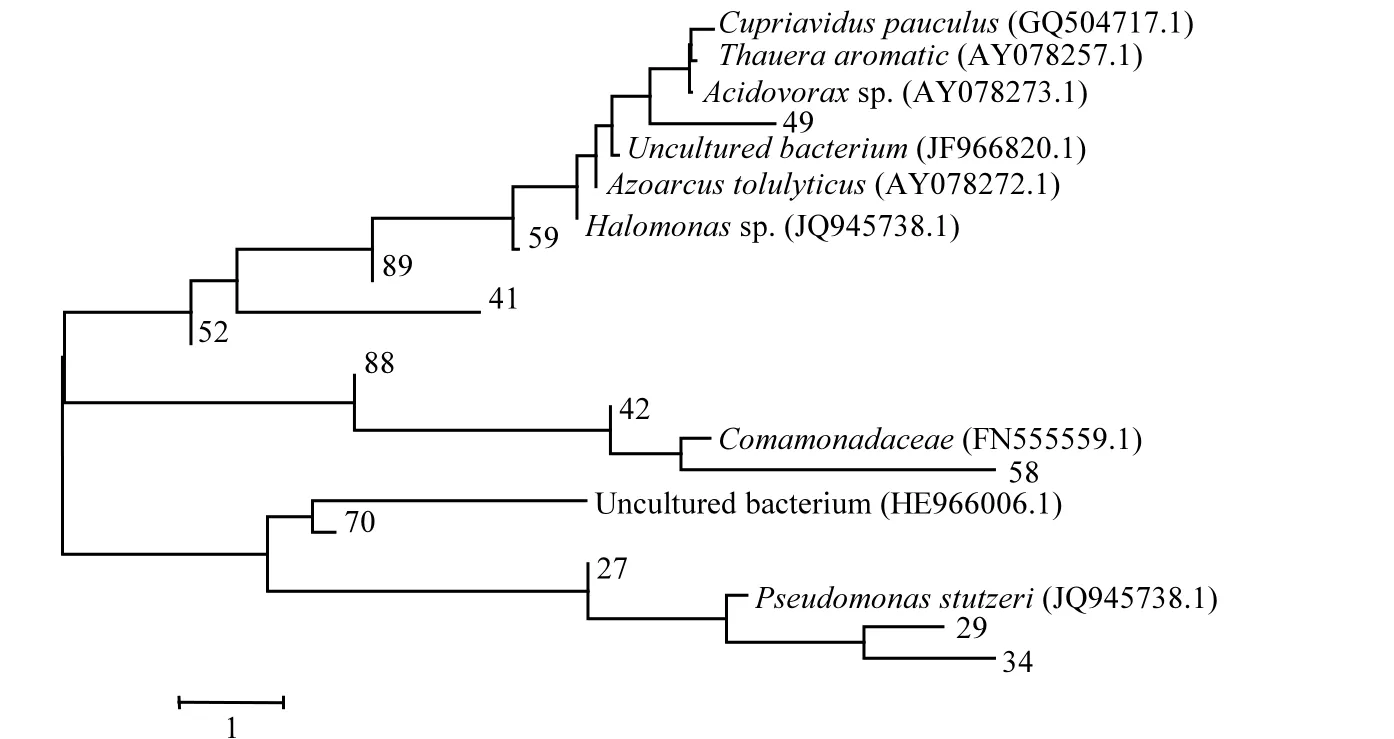
圖7 反硝化細菌系統發育分析Fig.7 The phylogenetic analysis results of the denitrifying bacteria
3 結論
3.1 反應器所得克隆子比照后菌屬主要為變形菌門細菌和未知菌類.其中 β-proteobacteria占據絕對優勢且有較多種類,其OTUs和克隆豐富度分別為58.3%和62.7%.少部分屬于 γ-proteobacteria,其OTUs和克隆豐富度分別為16.7%和7.8%.說明變形桿菌在該脫氮系統中是最主要的菌群.還有部分未培養的環境樣品,其OTUs和克隆豐富度分別為16.7%和9.8%.
3.2 反應器中的優勢反硝化菌為變形菌綱細菌,對于系統的氮的去除和苯酚的降解有很大貢獻,對TN去除貢獻率達到13.28%.
[1]Mulder A, Graaf A A, Robertson L A, et al. Anaerobic ammonium oxidation discovered in a denitrifying fluidized bed reactor [J].FEMS Microbiology Ecology, 1995,16(3):177-184.
[2]Gayon U, Dupetit G. Sur la fermentation des nitrates [J]. CR Acad.Sci., 1882,95:644-646.
[3]Holliger C, Zehnder A J B. Anaerobic biodegradation of hydrocarbons [J]. Current Opinion in Biotechnology, 1996,7(3):326-330.
[4]Zhu J H, Lin J P, Zhang B, et al. Simultaneous removal of phenol and nitrate in an anaerobic bioreactor [J]. Journal of Environmental Engineering, 2006,132(9):1073-1077.
[5]Maranon E, Vazquez I, Rodriguez J, et al. Coke wastewater treatment by a three-step activated sludge system [J]. Water, Air,and Soil Pollution, 2008,192(1-4):155-164.
[6]Ramos A F, Gomez M A, Hontoria E, et al. Biological nitrogen and phenol removal from saline industrial wastewater by submerged fixed-film reactor [J]. Journal of Hazardous Materials,2007,142(1):175-183.
[7]Toh S, Ashbolt N. Adaptation of anaerobic ammonium-oxidising consortium to synthetic coke-ovens wastewater [J]. Applied Microbiology and Biotechnology, 2002,59(2/3):344-352.
[8]Braker G, Zhou J, Wu L, et al. Nitrite reductase genes (nirK and nirS)as functional markers to investigate diversity of denitrifying bacteria in Pacific Northwest marine sediment communities [J].Applied and Environmental Microbiology, 2000,66(5):2096-2104.
[9]莫旭華,麻 威,史榮久,等.氮肥對小麥田土壤 nirS型反硝化細菌多樣性的影響 [J]. 微生物學報, 2009(9):1203-1208.
[10]Yu Z, Mohn W W. Bacterial diversity and community structure in an aerated lagoon revealed by ribosomal intergenic spacer analyses and 16S ribosomal DNA sequencing [J]. Applied and Environmental Microbiology, 2001,67(4):1565-1574.
[11]Chon K, Kim Y, Chang N I, et al. Evaluating wastewater stabilizing constructed wetland, through diversity and abundance of the nitrite reductase gene, with regard to nitrogen control [J]. Desalination, 2010,264(3):201-205.
[12]方 芳,王淑梅,馮翠杰,等.好氧條件下復合生物膜-活性污泥反應器中的反硝化菌群結構 [J]. 生態學雜志, 2011,30(3):430-437.
[13]鄭 平,徐向陽,胡寶蘭.新型生物脫氮理論與技術 [M]. 北京:科學出版社, 2004.
[14]Heylen K, Gevers D, Vanparys B, et al. The indicies of nirS and nirK and their genetic heterogeneity in cultivated denitrifiers [J].Environmental Microbiology, 2006,8:2012-2021.
[15]Heylen K, Vanparys B, Gevers D, et al. Nitric oxide reductase(norB)gene sequence analysis reveals discrepancies with nitrite reductase (nir)gene phylogeny in cultivated denitrifiers [J].Environmental Microbiology, 2007,9:1072-1077.
[16]Lee H W, Lee S Y, Lee J W, et al. Molecular characterization of microbial community in nitrate-removing activated sludge [J].FEMS Microbiology Ecology, 2002,41(2):85?94.
[17]Kotresha D, Vidyasagar G M. Isolation and characterisation of phenol-degrading Pseudomonas aeruginosa MTCC 4996 [J].World Journal of Microbiology and Biotechnology, 2008,24(4):541-547.
[18]Kukor J J, Olsen R H. Molecular cloning, characterization, and regulation of a Pseudomonas pickettii PKO1 gene encoding phenol hydroxylase and expression of the gene in Pseudomonas aeruginosa PAO1c [J]. Journal of Bacteriology, 1990,172(8):4624-4630.
[19]Pawlowski K, Kunze R, De Vries S, et al. Isolation of total, poly(A)and polysomal RNA from plant tissues [M]//Plant molecular biology manual. Springer Netherlands, 1994:231-243.
[20]Hamdy M K, Sherrer E L, Randles C I, et al. Some characteristics of a phenol-oxidizing Pseudomonas [J]. Appl. Microbiol.,1956,4(2):71.
[21]Feist C F, Hegeman G D. Phenol and benzoate metabolism by Pseudomonas putida: regulation of tangential pathways [J].Journal of Bacteriology, 1969,100(2):869-877.
[22]Mechichi T, Stackebrandt E, Gad'on N, et al. Phylogenetic and metabolic diversity of bacteria degrading aromatic compounds under denitrifying conditions, and description of Thauera phenylacetica sp. nov., Thauera aminoaromatica sp. nov., and Azoarcus buckelii sp. nov [J]. Archives of Microbiology, 2002,178(1):26-35.
[23]Zhou J, Fries M R, Chee-Sanford J C, et al. Phylogenetic analyses of a new group of denitrifiers capable of anaerobic growth on toluene and description of Azoarcus tolulyticus sp. nov[J]. International Journal of Systematic Bacteriology, 1995,45(3):500-506.
[24]Anders H J, Kaetzke A, K?MPFER P, et al. Taxonomic position of aromatic-degrading denitrifying pseudomonad strains K 172 and KB 740 and their description as new members of the genera Thauera, as Thauera aromatica sp. nov., and Azoarcus, as Azoarcus evansii sp. nov., respectively, members of the beta subclass of the Proteobacteria [J]. International Journal of Systematic Bacteriology, 1995,45(2):327-333.
[25]Manefield M, Whiteley A S, Griffiths R I, et al. RNA stable isotope probing, a novel means of linking microbial community function to phylogeny [J]. Applied and Environmental Microbiology, 2002,68(11):5367-5373.
[26]Manefield M, Griffiths R I, Leigh M B, et al. Functional and compositional comparison of two activated sludge communities remediating coking effluent [J]. Environmental Microbiology,2005,7(5):715-722.
[27]Hinteregger C, Streichsbier F. Halomonas sp., a moderately halophilic strain, for biotreatment of saline phenolic waste-water[J]. Biotechnology Letters, 1997,19(11):1099-1102.
[28]Boon N, Goris J, De Vos P, et al. Genetic diversity among 3-chloroaniline-and aniline-degrading strains of the Comamonadaceae [J]. Applied and Environmental Microbiology,2001,67(3):1107-1115.
[29]Khan S T, Horiba Y, Yamamoto M, et al. Members of the family Comamonadaceae as primary poly (3- hydroxybutyrate - co- 3 -hydroxyvalerate)-degrading denitrifiers in activated sludge as revealed by a polyphasic approach [J]. Applied and Environmental Microbiology, 2002, 68(7):3206-3214.
[30]王弘宇,馬 放,楊 開,等.兩株異養硝化細菌的氨氮去除特性[J]. 中國環境科學, 2009,29(1):47-52.
[31]李佳霖,白 潔,高會旺,等.長江口海域夏季沉積物反硝化細菌數量及反硝化作用 [J]. 中國環境科學, 2009,29(7):756-761.
Denitrifying bacteria of anaerobic ammonium-oxidizing denitrifying system.
WANG Chun-xiang, LIU Changjing, ZHENG Lin-xue, LI Jun*(Key Laboratory of Beijing for Water Quality Science and Water Environment Recovery Engineering, Beijing University of Technology, Beijing 100124, China). China Environmental Science,2014,24(7):1878~1883
Denitrifying microorganisms in the anaerobic ammonium oxidation coupling heterotrophic denitrification system were investigated. The methods used were PCR and molecular cloning. By building nirS clone libraries, homology analysis and constructing system Phylogenetic tree, 51clones were assigned to 12 OTUs. By BLAST alignment found these microbes were mainly proteobacteria and uncultured environment samples. Proteobacteria were mainly β-Proteobacteria and γ-Proteobacteria.
anaerobic ammonium-oxidizing (ANAMMOX);denitrifying bacteria;polymerase chain reaction (PCR);nirS clone libraries
X172
A
1000-6923(2014)07-1878-06
2013-10-25
國家自然科學基金(51078008);北京市自然科學基金(8122005);北京市教委重點項目(KZ201110005008)
* 責任作者, 教授, jglijun@bjut.edu.cn
王春香(1988-),女,山東菏澤人,北京工業大學碩士研究生,研究方向污水生物處理.

