米糠肽抗氧化活性研究
劉梁,孫維礦,趙玲,李赫宇,陳新,*
(1.武漢輕工大學生物與制藥工程學院,湖北武漢430023;2.天津市益倍建生物技術有限公司,天津300457)
近些年,功能活性肽因其健康安全等特點已成為食品領域研究最為熱門的課題之一,而從植物蛋白中提取活性肽更受人們青睞,其中抗氧化肽尤其受到人們的關注[1-2]。相關研究表明證明米糠蛋白水解提取物的抗氧化值為19.9 mg/g,約為VC的27倍,約為大豆肽的1.9倍[3]。由6~30個氨基酸組成,分子量在70 u~3600 u的米糠肽具有強抗氧化性[4]。張強等通過酶解米糠蛋白制備得到的米糠抗氧化肽,對常見的自由基如O2-·和·OH均具有良好的捕獲能力[5]。梅德軍等選用兩種蛋白酶木瓜和風味蛋白酶水解制備米糠制得抗氧化肽[6]。通過酶水解法制得的米糠抗氧化肽的水解度為23.67%,對DPPH自由基清除率可達64.26%[7]。從目前的研究看來,從米糠中提取單一抗氧化物質,利用率不高[8]。不同天然抗氧化成分之間存在著協同效應,復合組方抗氧化功能比單一組分更好[9]。目前,將米糠肽作為抗氧化成分的單方或復方商業化產品基本上沒有,但是鑒于大豆蛋白和活性肽產品的成功開發,米糠活性肽及其復合物又具有抗氧化的生理活性使得其將會是食品行業的研究熱點[10-11]。基于米糠總提取物及米糠肽水解前后抗氧化活性的變化,測定了不同濃度米糠總提取物及米糠蛋白抗氧化提取物清除羥自由基(·OH)和超氧陰離子自由基(O2-·)能力,研究酶解工藝對米糠多肽抗氧化活性的影響。
1 材料與方法
1.1 實驗材料與試劑
米糠提取物有本實驗提取所得;EDTA、H2O2、Tris、乙醇、鄰苯三酚:國藥集團;FeSO4、抗壞血酸、三氯乙酸、硫代巴比妥酸、鹽酸:科密歐公司;α-脫氧核糖,北京奧博星生物公司;乙酸,天大化學試劑廠。
1.2 儀器和設備
電子天平(AL204-01):梅特勒-托利多儀器有限公司;電子恒溫不銹鋼水浴鍋(HHS-2S):上海光地儀器設備有限公司;紫外-可見分光光度計(752N):上海光譜儀器有限公司。
1.3 方法
1.3.1 羥自由基(·OH)清除能力的測定方法
采用α-脫氧核糖氧化法測定。10 mmol/L的FeSO4-EDTA混和液取0.2 mL于具塞試管中,加入0.20 mL的α-脫氧核糖溶液(10 mmol/L),然后加入0.20 mL 的 2、4、6、8、10 mg/mL 的樣品(米糠總提取物或純化米糠肽)溶液,并用pH=7.4磷酸鹽緩沖液定容到1.8 mL,最后加入0.20 mL的10 mmol/L的雙氧水,混勻后于37℃水浴中保溫1 h,然后加入1 mL質量分數2.8%的三氯乙酸(TCA)溶液,加入質量分數1.0%硫代巴比妥酸(TBA)溶液1.00 mL,混勻后沸水浴加熱10 min;冷卻后,在532 nm波長下用紫外分光光度計檢測,以蒸餾水為參比,測得其吸光度為A1。同上操作處理,不加異黃酮溶液,測定其對比吸光度A2。其他處理同上,不加異黃酮溶液且不在37℃水浴中反應,測定空白吸光度A3。樣品的自由基清除能力(scavenging activity,SA)可表示為:SA(%)=[1-(A1-A3)/(A2-A3)]×100。
1.3.2 超氧陰離子自由基(O2-·)清除能力的測定方法
在pH8.2,2.8 mL 50 mmol/L的Tris-HCl緩沖液中加入0.1 mL蒸餾水,于25℃保溫10 min,加入25℃預溫的60 mmol/L的鄰苯三酚0.1 mL,總體積為3.0 mL,迅速混勻,轉移至比色杯中,在420 nm處,每隔30秒測一次吸光度,作為對比。測得吸光度記做A1。同上,在緩沖體系中加入0.1 mL米糠總提取物或純化米糠肽溶液,測得吸光度記做A2。其它條件相同,在同樣的緩沖體系中加入25℃預溫的10mmol/L的鹽酸0.1mL,測得吸光度記做A3。通過公式“清除率/%=A1-(A2-A3)/A1×100”計算超氧陰離子自由基清除率。
2 結果與討論
2.1 米糠酶解前后羥自由基(·OH)清除能力測定
利用芬頓(Fenton)反應體系產生·OH,通過考察和分析·OH對2-脫氧核糖分子的氧化及破壞情況,確定米糠肽、米糠提取物以及二者水解產物的存在是否對·OH具有清除能力,保護2-脫氧核糖分子不被氧化破壞。分別利用 2、4、6、8、10 mg/mL 的樣品溶液,測定相應的羥自由基清除率,實驗結果如圖1~圖2所示。
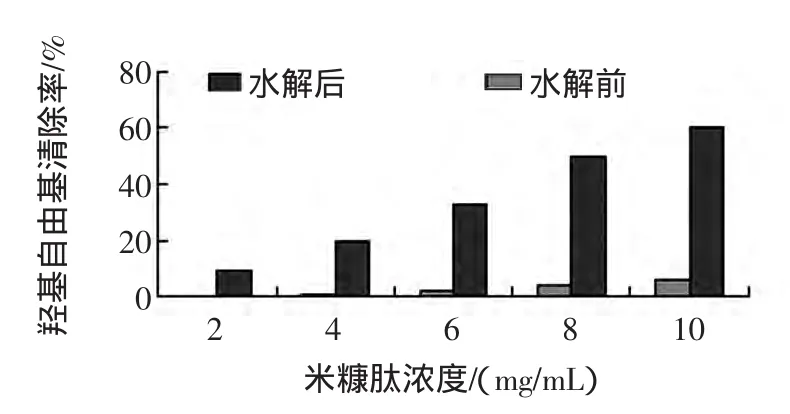
圖1 米糠肽水解前后羥自由基清除作用Fig.1 The scavenging capacity to hydroxyl free radical by rice bran peptide before and after hydrolysis
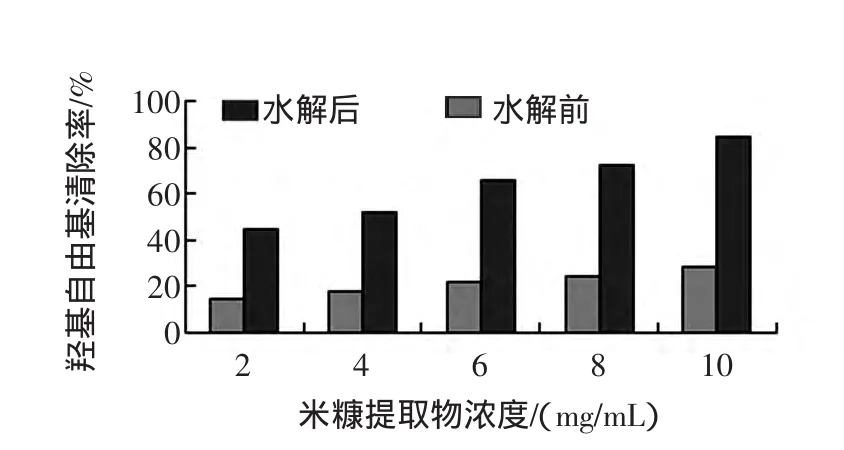
圖2 米糠水解前后提取物羥自由基清除作用Fig.2 The scavenging capacity to hydroxyl free radical by the total extract of rice bran before and after hydrolysis
在鄰苯三酚在自氧化反應中,隨著米糠提取物濃度的增大對鄰苯三酚自氧化抑制就越強,在420 nm處形成的有光吸收的中間產物越少,樣品吸光度A2相應數值也越低,從而清除率逐漸增大。實驗結果如圖1、2所示,米糠總提取物和米糠肽都具有一定的羥基自由基清除能力,且米糠總提取物的清除能力強于純化米糠肽;米糠總提取物和米糠肽在經過水解后對羥基自由基的清除能力均顯著增強;隨著受試樣品濃度的增大,受試樣品對羥自由基的清除能力逐漸增強。
2.2 米糠酶解前后超氧陰離子自由基清除能力測定
分別利用 2、4、6、8、10 mg/mL 的樣品溶液,測定相應的超氧自由基清除率,如圖3~圖4所示。
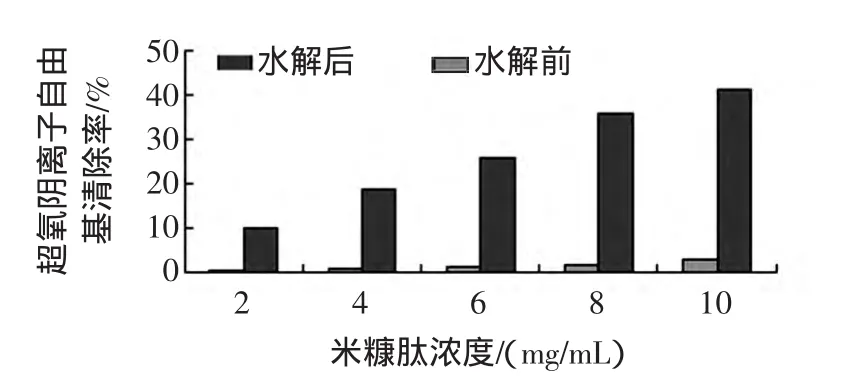
圖3 米糠肽水解前后超氧陰離子自由基清除能力比較Fig.3 The scavenging capacity to superoxide radical by rice bran peptide before and after hydrolysis
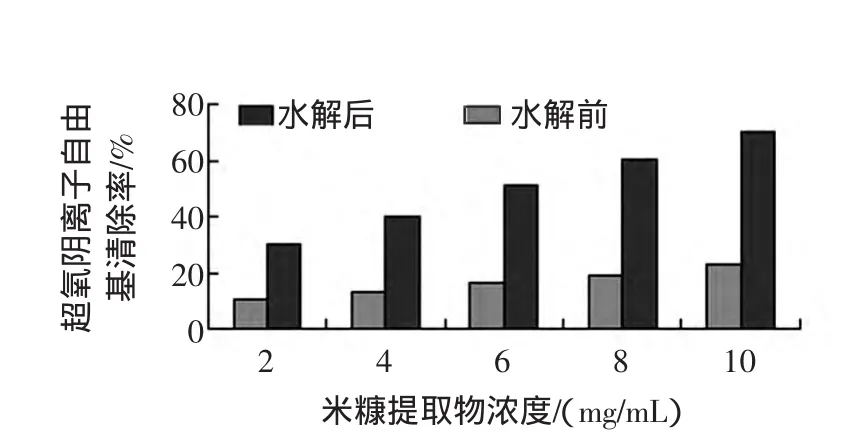
圖4 米糠酶解前后醇提物超氧陰離子自由基清除能力比較Fig.4 The scavenging capacity to superoxide radical by the total extract of rice bran before and after hydrolysis
實驗結果如圖3、4所示,超氧自由基清除率隨樣品濃度增大而增大。米糠酶解醇提物和米糠肽對超氧陰離子自由基的清除能力明顯大于酶解前超氧陰離子自由基清除能力。
3 結論
對米糠總提取物、純化米糠肽以及二者水解產物的抗氧化活性進行了比較研究,實驗結果證實,米糠總提取物、純化米糠肽以及二者水解產物均有對·OH和O2-·的清除能力,二者對·OH和O2-·的清除能力隨濃度增加而增強。進一步對比分析可得出以下結論,米糠總提取物的抗氧化活性強于純化米糠肽,二者的水解產物的抗氧化活性強于水解前。
[1] 周小理,李紅敏.植物抗氧化(活性)肽的研究進展[J].食品工業,2006(3):11-13
[2] 包斌,德力格爾桑,許勤.抗氧化肽的研究進展[J].內蒙古農業大學學報,2004,25(1):121-124
[3] 劉友明,趙思明,熊善柏,等.米糠的蛋白水解提取物抗氧化活性及分子量分布研究[J].中國糧油學報,2006,21(2):1-4
[4] 張強,周正義,馬玉涵,等.米糠抗氧化活性的研究[J].中國糧油學報,2008,23(5):9-12
[5] 李文林,黃鳳洪.天然抗氧化劑研究現狀[J].糧食與油脂,2003(10):10-13
[6] 金世合,陳正行.米糠蛋白提取和功能性質研究[J].糧食與油脂,2003(6):21-22
[7] 付巖松,羅霞,張心昱,等.米糠抗氧化肽對D-半乳糖致衰小鼠肝線粒體的保護[J].食品工業科技,2010,31(6):310-316
[8] 樊金娟,羅霞,董智.米糠抗氧化肽的提取和純化工藝研究[J].食品科技,2008,33(12):169-173
[9] 樊金娟,羅霞,付巖松.米糠抗氧化肽大鼠體外抗氧化作用研究[J].食品科學,2010,31(9):251-254
[10]趙東海,張建平,王云.米糠蛋白提取工藝和功能性質評價[J].食品工業,2005(5):9-11
[11]樊金娟,付巖松,宗立立.米糠抗氧化肽的抗衰老作用[J].食品科學,2010,31(23):40-43

