基于金磁微粒與酶標噬菌體抗體的磁分離免疫分析法
穆晞惠,童朝陽,黃啟斌,劉 冰,劉志偉,郝蘭群,張金平
(國民核生化災害防護國家重點實驗室,北京 102205)
金磁微粒(Gold-magnetic particle)是由納米金顆粒包被超順磁Fe3O4納米粒子后形成的磁性無機納米復合物,兼有納米金顆粒與磁微粒的雙重優勢。作為一種新型的磁性納米功能材料,金磁微粒憑借其良好的穩定性、分散性、生物相容性及磁性富集分離等特性,已被廣泛應用于核酸雜交、疾病診斷、生物檢測和生物傳感等方面,可起到簡化操作步驟,提高檢測的靈敏度、特異性和抗干擾能力的作用[1-7]。噬菌體抗體作為免疫檢測中一種非常有前景的識別分子,兼具特異的抗原結合特性和噬菌體結構特性,可與多個抗噬菌體衣殼蛋白pⅧ的酶標抗體結合,形成攜帶大量酶分子的酶標噬菌體抗體復合物。與傳統抗體與酶標二抗結合形成的酶標抗體復合物探針相比,噬菌體抗體可產生針對靶分子的特異信號放大效應[8]。蛋白A(Staphylococcus protein A,SPA)通過疏水作用與IgG分子Fc段特異結合,可實現分子的定向固定從而提高探針活性,現已在生物檢測領域得到廣泛應用[9-13]。
本課題組研究發現,蛋白A和酶標噬菌體抗體在磁免疫分析中具有信號放大效應[8,13],然而目前尚缺乏對金磁微粒功能化探針以及金磁微粒、蛋白A、酶標噬菌體抗體三者在磁免疫分析中的綜合放大效應的深入研究,也無針對相思子毒素(Abrin)的快速、靈敏、特異和抗干擾能力強的磁免疫分析法的文獻報道。本研究以蛋白A包被金磁微粒偶聯相思子毒素多抗作為功能化捕獲探針,酶標相思子毒素噬菌體抗體為特異信號檢測探針,采用“蛋白A包被金磁微粒功能化捕獲探針-相思子毒素 -酶標噬菌體抗體信號探針”的檢測模式,建立了檢測相思子毒素的磁免疫分析新方法。通過與其他免疫檢測方法的比較,重點探討了金磁微粒功能化探針在提高檢測靈敏度上的效果,以及金磁微粒、蛋白A與酶標噬菌體抗體三者產生的綜合信號放大效應。同時重點考察了該方法對以河水、施肥土壤、奶油餅干和兔全血作為基質的模擬樣品的檢測能力,為其在臨床診斷、環境監測、食品衛生檢驗及生物反恐等領域的應用提供技術基礎和參考依據。
1 實驗部分
1.1 試劑與儀器
相思子毒素標準品、相思子毒素多抗、相思子毒素噬菌體抗體、蓖麻毒素(Ricin)、超順磁Fe3O4納米粒子(粒徑15 nm)、金磁微粒(粒徑150 nm)均由本實驗室制備;金黃色葡萄球菌腸毒素B(SEB)、氯金酸(HAuCl4·4H2O)、鹽酸羥胺、蛋白A(SPA)、牛血清白蛋白(BSA)、3,3’,5,5’-四甲基聯苯胺(TMB)購自Sigma公司;辣根過氧化物酶標記的抗M13單克隆抗體(HRP-抗M13單抗)購自GE公司;BioMATE 3S型紫外-可見分光光度計(美國Thermo公司);680型酶標儀(美國BioRad公司);96孔磁架(德國Dynal公司)。
1.2 金磁微粒的制備
參照文獻[14]制備金磁微粒并稍加改動。取本課題組利用微波共沉淀法制備的超順磁Fe3O4納米粒子(磁微粒)0.2 g[15]溶于100 mL超純水中超聲15 min;加入1%HAuCl4·4H2O水溶液10 mL,攪拌速度為1 500 r/min,室溫反應1 h;加入50 mmol/L鹽酸羥胺40 mL,攪拌速度為2 000 r/min,室溫反應1 h;磁性分離棄上清液,加入1 mol/L HCl浸泡4 h后,超純水洗至中性并定容至50 mL備用,同時計算固形物含量。
1.3 金磁微粒功能化探針的制備
取1 mg金磁微粒,用0.01 mol/L pH 7.4的磷酸鹽緩沖液(PBS)清洗金磁微粒,磁分離棄去上清液;加入一定量1 mg/mL SPA,室溫旋轉反應3 h,PBST(0.01 mol/L pH 7.4 PBS緩沖液,含0.1%Tween-20)清洗金磁微粒,磁分離棄上清液;加入一定量1 mg/mL相思子毒素多抗,室溫旋轉反應2 h,PBST清洗金磁微粒并定容至1 mL,于4℃或-20℃貯存備用。
1.4 酶標相思子毒素噬菌體抗體探針的制備
將滴度為1.0×1013pfu/mL的相思子毒素噬菌體抗體1 mL與HRP-抗M13單抗1 μL混勻,37℃溫育1 h,以4℃ 9 000 g離心20 min,棄去上清液;0.01 mol/L PBS緩沖液(pH 7.4,含0.1%Tween-20)重懸沉淀后繼續離心,重復3次;最后以0.01 mol/L PBS緩沖液(pH 7.4,含3%BSA)重懸沉淀,4℃貯存備用。
1.5 基于金磁微粒與酶標噬菌體抗體的磁分離免疫分析法的建立
①加待測樣品:取金磁微粒功能化探針各100 μL,均加入用0.01 mol/L PBS緩沖液(pH 7.4)稀釋成100 μL的不同濃度的相思子毒素標準品,另取金磁微粒、金磁微粒功能化探針各100 μL分別作為空白和陰性對照管,加0.01 mol/L PBS緩沖液(pH 7.4,含1%BSA)各100 μL,37℃溫育1 h,PBST洗3次,磁分離棄去上清液。②加酶標噬菌體抗體探針:除空白管外,各加一定滴度的酶標相思子毒素噬菌體抗體100 μL,37℃溫育1 h,PBST洗3次,磁分離棄去上清液。③底物顯色:每管加100 μL TMB,37℃溫育15 min,加2 mol/L濃H2SO450 μL終止反應;④讀數:磁架收集上清液,采用酶標儀測A450nm值。檢測過程見圖1。
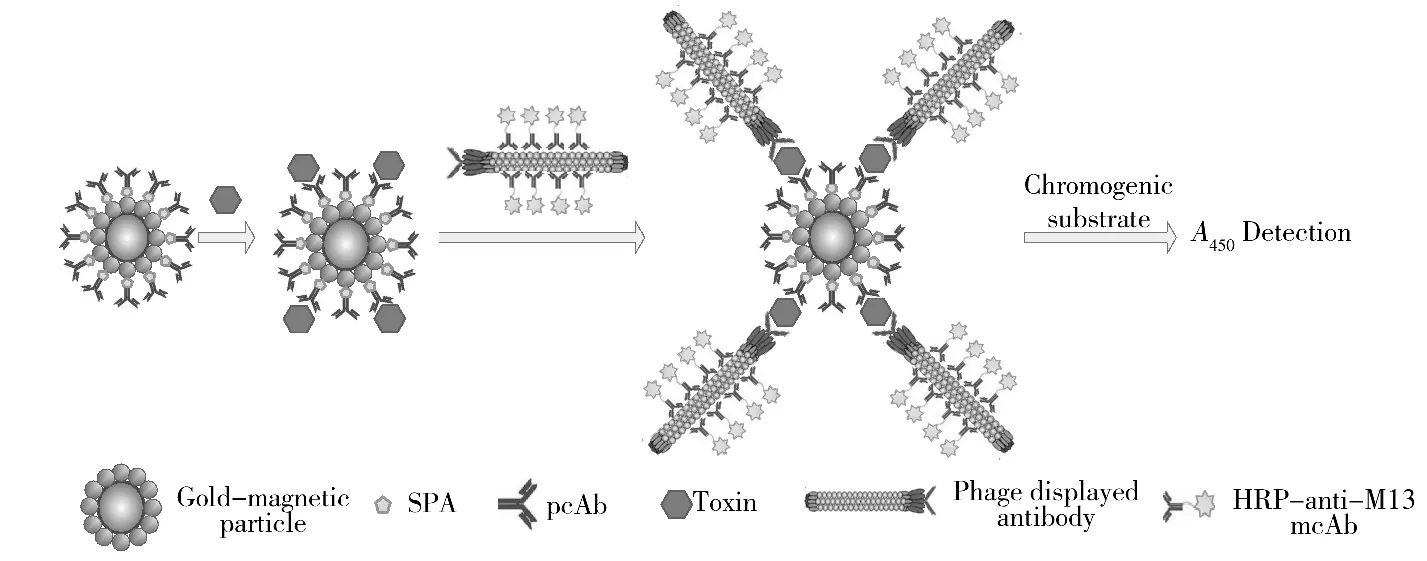
圖1 基于金磁微粒與酶標噬菌體抗體的磁分離免疫分析法檢測毒素原理示意圖Fig.1 Model of detection toxin by magnetic affinity immunoassay(MAIA)based on gold-magnetic particle and HRP-conjugated phage antibody
1.6 相思子毒素模擬樣品的測定
取1 g施肥土壤(有機質含量>5%)、1 g奶油餅干(脂肪含量>30%)、10 μL兔全血、1 mL河水,分別向各樣品中加入6.24 μL 10 mg/L的相思子毒素標準品,加稀釋液(0.01 mol/L pH 7.4 PBS緩沖液)混勻至8 mL,制成基質分別為施肥土壤、奶油餅干、兔全血和河水的相思子毒素模擬樣品(終濃度均為7.8 μg/L)。河水樣品直接取混合液測定,土壤樣品以5 000 g離心20 min,餅干、全血樣品以10 000 g分別離心15 min和10 min,取上清液測定相思子毒素濃度,計算回收率、相對標準偏差等指標。
2 結果與討論
2.1 金磁微粒的制備
本研究采用微波共沉淀法獲得了分散性較好、形貌呈球形、粒徑為15 nm、飽和磁化強度為78.875 emu/g的磁微粒(圖2A),與傳統共沉淀法相比,該法簡化了磁微粒制備過程,縮短了反應時間。在此基礎上采用鹽酸羥胺還原法獲得了分散性好、形貌呈球形、粒徑為150 nm、飽和磁化強度為63.151 emu/g的金磁微粒(圖2B),同時測得其固形物含量為3 mg/mL。

圖2 磁微粒(A)和金磁微粒(B)的透射電鏡照片Fig.2 TEM images of magnetic particle(A)and gold-magnetic particle(B)
2.2 金磁微粒功能化探針的制備
2.2.1 相思子毒素多抗最適固定量的確定 利用磁微粒、金磁微粒與蛋白間的物理吸附作用,分別將不同量SPA吸附至磁微粒和金磁微粒表面,通過測定固定前后SPA溶液的A280nm值,分別計算出每毫克磁微粒和金磁微粒上的SPA固定量。從表1可知,隨著SPA加入量的增加,磁微粒和金磁微粒表面固定的SPA量逐漸增加并趨于飽和,因此確定每毫克磁微粒和金磁微粒的SPA最適加入量分別為240 μg和320 μg,此時每毫克磁微粒和金磁微粒上SPA的固定量分別為111 μg和168 μg。
進一步利用SPA與IgG分子Fc段的結合特異性,加入不同量的相思子毒素多抗分別制備磁微粒功能化探針和金磁微粒功能化探針,測定固定前后相思子毒素多抗溶液的A280nm值,計算出兩種功能化探針上相思子毒素多抗的實際固定量分別為453 μg和958 μg(見圖3),理論最大量分別為845 μg和1 280 μg,實際固定量分別占理論最大量的53.6%和74.8%。

表1 磁微粒與金磁微粒固定前后蛋白A溶液的吸光度值變化Table 1 Absorbance value of SPA solution before and after binding to magnetic particle and gold-magnetic particle
通過比較SPA定向固定相思子毒素多抗制備的金磁微粒和磁微粒兩種功能化探針,發現金磁微粒功能化探針上SPA和相思子毒素多抗的固定量均最高,說明金磁微粒比磁微粒能提供更大的活性表面,從而固定更多的生物分子探針;同時SPA可使抗體在金磁微粒表面定向固定和有序排列,減少了分子間的空間位阻,從而進一步提高了功能化探針的活性和檢測靈敏度。
2.2.2 金磁微粒功能化探針磁學性質的鑒定 采用振動樣品磁強計對金磁微粒功能化探針的磁學性質進行鑒定,由圖4可知,金磁微粒功能化探針的飽和磁化強度為61.636 emu/g,與金磁微粒的飽和磁化強度基本相同,表明制備的金磁微粒功能化探針具有很好的磁學性質。

圖3 金磁微粒和磁微粒表面多抗最適固定量的確定Fig.3 Immobilization ability of monoclonal antibody on gold-magnetic particle and magnetic particle
2.3 酶標相思子毒素噬菌體抗體探針的制備
2.3.1 HRP-抗M13單抗最適用量的確定 分別取 0.2,0.4,0.6,0.8,1.0,1.2,1.4,1.6 μL HRP-抗M13單抗與1 mL(1.0×1013pfu/mL)相思子毒素噬菌體抗體混合,制得酶標相思子毒素噬菌體抗體探針。分別取上述探針100 μL與100 μL(1 000 μg/L)相思子毒素標準品、100 μL金磁微粒功能化探針反應進行磁分離免疫測定,根據A450nm值變化確定HRP-抗M13單抗的最適用量。結果顯示,隨著HRP-抗M13單抗加入量的增加,其吸光度值逐漸增大,當體積大于1 μL時,吸光度值基本不再增加,表明相思子毒素噬菌體抗體上結合的HRP-抗M13單抗趨于飽和,因此確定HRP-抗M13單抗最適用量為1 μL。
2.3.2 酶標相思子毒素噬菌體抗體最適滴度的確定 分別取金磁微粒功能化探針100 μL,加入1 000 μg/L相思子毒素標準品,清洗磁微粒分別加入滴度為1.0×107,1.0×108,1.0×109,1.0×1010,1.0×1011,1.0×1012,1.0×1013pfu/mL的酶標相思子毒素噬菌體抗體100 μL,相同條件下進行磁分離免疫測定,根據A450nm值變化選擇適合滴度的酶標相思子毒素噬菌體抗體。結果顯示,隨著酶標相思子毒素噬菌體抗體對數滴度的增大,其吸光度值逐漸增大,當對數滴度大于11時其吸光度值趨于飽和,因此確定酶標相思子毒素噬菌體抗體的最適滴度為1.0×1011pfu/mL。

圖4 金磁微粒功能化探針的磁滯回線圖Fig.4 Magnetic hysteresis loops curve of functionalized gold-magnetic particle probe
2.3.3 酶標相思子毒素噬菌體抗體探針的活性測定 為了驗證酶標相思子毒素噬菌體抗體信號探針的活性,分別用濃度為5,10,20,40,60,80,100,120 μg/L的相思子毒素標準品100 μL包被酶標板,封閉后加入滴度為1.0×1011pfu/mL的酶標相思子毒素噬菌體抗體100 μL,同等條件下采用間接ELISA法測定,根據A450nm值變化對酶標相思子毒素噬菌體抗體的活性進行鑒定。結果表明,隨著相思子毒素濃度的增大,其吸光度值逐漸增大,表明該探針可與目標物毒素結合且具有很好的量效關系,毒素的濃度(X,μg/L)與吸光度值(Y)呈顯著線性相關,回歸方程為Y=0.008X+0.524(r=0.995 5,P<0.000 1,n=9),因此制備的酶標相思子毒素噬菌體抗體探針具有很好的活性,可滿足本實驗的檢測需求。
2.4 標準曲線、檢出限與定量下限
用建立的磁分離免疫分析法對濃度范圍為0.008~250 μg/L的相思子毒素標準品進行檢測,以相思子毒素濃度為橫坐標,以吸光度值為縱坐標作圖(見圖5)。結果顯示,相思子毒素濃度的對數值(X)與其吸光度值(Y)之間呈線性相關(圖5插圖),回歸方程為Y=0.554X+1.289(r=0.991 0,P<0.000 1,n=16)。
分別以測定值>陰性對照A450nm值+3SD和測定值>陰性對照A450nm值+10SD作為判定檢出限、定量下限的標準,取20個陰性對照樣本測定A450nm值為0.121±0.01,相思子毒素濃度為0.008 μg/L時的 A450nm值為0.272,因此確定檢出限為0.008 μg/L,定量下限為0.008 μg/L。由于本研究中得出的標準差值很小,表明該方法具有很好的精確度,因此導致定量下限接近檢出限。
相同條件下,采用“蛋白A包被金磁微粒偶聯多抗捕獲探針-毒素-酶標噬菌體抗體信號探針”(方法1)、“蛋白A包被磁微粒偶聯多抗捕獲探針-毒素-酶標噬菌體抗體信號探針”(方法2)、“金磁微粒偶聯多抗捕獲探針-毒素-酶標噬菌體抗體信號探針”(方法3)、“蛋白A包被金磁微粒偶聯多抗捕獲探針-毒素-酶標單抗信號探針”(方法4)、“金磁微粒偶聯多抗捕獲探針-毒素-酶標單抗信號探針”(方法5)、“磁微粒偶聯多抗捕獲探針-毒素-酶標單抗信號探針”(方法6)6種檢測模式的雙抗體夾心磁分離免疫分析法(MAIA)及傳統雙抗體夾心ELISA法(方法7)對相思子毒素進行檢測與比較。由表2可知,該方法中金磁微粒、蛋白A和酶標噬菌體抗體的單獨放大效應可使檢測靈敏度分別提高5.2倍(方法5和7比較)、3倍(方法1和3比較)和4倍(方法1和4比較),三者產生的綜合放大效應使其檢測靈敏度比傳統雙抗體夾心ELISA法提高了62倍(方法1和7比較)。蛋白A-金磁微粒功能化探針與蛋白A-磁微粒功能化探針相比,具有更高的結合活性,使其檢測靈敏度提高了3倍(方法1和2比較),而與傳統磁微粒功能化探針相比檢測靈敏度提高了9倍(方法4和6比較)。證明金磁微粒較磁微粒具有更好的生物相容性,可提供更大的活性表面固定更多生物分子;蛋白A可使抗體在金磁微粒表面定向固定和有序排列,從而進一步提高了金磁微粒功能化探針的活性和檢測靈敏度;酶標噬菌體抗體和金磁微粒功能化探針在磁分離免疫中信號放大效應的存在,提高了檢測靈敏度,放大了檢測信號。

圖5 磁分離免疫分析法檢測相思子毒素的工作曲線Fig.5 Standard curve of abrin determined by magnetic affinity immunoassay(MAIA)
2.5 精密度與特異性
在檢測的線性濃度范圍內,選擇濃度分別為250,62.5,1.95,0.032 μg/L的相思子毒素標準品進行測定,每個濃度重復測定5次,得到吸光度值的相對標準偏差(RSD)分別為1.3%,1.3%,2.8%和6.1%,表明方法具有較好的精密度。

表2 6種磁分離免疫分析法與傳統ELISA方法的比較Table 2 Comparison of six MAIA and ELISA methods
采用磁分離免疫分析法分別對基質為稀釋液(pH 7.4,0.01 mol/L PBS緩沖液),濃度均為15.6 μg/L的相思子毒素(Abrin)和蓖麻毒素(Ricin)、金黃色葡萄球菌腸毒素(SEB)、牛血清白蛋白(BSA)樣品進行檢測,同時選用基質分別為稀釋液、河水、施肥土壤、奶油餅干和兔全血的無目標分子相思子毒素存在的模擬樣品作為陰性對照,結果見表3。當檢測 Ricin、SEB和 BSA等非目標蛋白時,其所得吸光度值基本接近陰性值,RSD為1.7%~9.0%,表明該法檢測相思子毒素具有很好的特異性。
2.6 相思子毒素模擬樣品的測定
對基質分別為河水、施肥土壤、奶油餅干和兔全血的相思子毒素模擬樣品進行測定,其回收率均大于90%,RSD為1.2%~2.1%(見表4),表明該法具有較好的回收率和重現性,能滿足水樣、土樣、食品及血液等人工模擬樣品的分析要求。

表3 特異性測定(n=5)Table 3 Detection specificity of MAIA(n=5)

表4 相思子毒素模擬樣品的測定(n=4)Table 4 Determination of abrin in the simulated samples(n=4)
3 結論
本文將蛋白A包被金磁微粒偶聯相思子毒素多抗作為功能化捕獲探針,酶標噬菌體抗體作為特異信號檢測探針,建立了基于金磁微粒與酶標噬菌體抗體的磁分離免疫分析法,實現了微量相思子毒素的檢測。該方法中金磁微粒、蛋白A及酶標噬菌體抗體三者產生的綜合放大效應使其檢測靈敏度比傳統雙抗體夾心ELISA法提高了62倍。蛋白A-金磁微粒功能化探針與蛋白A-磁微粒功能化探針相比,具有更高的結合活性,使其檢測靈敏度提高3倍,而與傳統磁微粒功能化探針相比可使檢測靈敏度提高9倍。
本研究中的蛋白A-金磁微粒功能化探針與傳統磁微粒功能化探針相比,在提高檢測靈敏度方面具有以下優勢:①金磁微粒具有更好的穩定性及生物相容性,可提供大的活性表面,從而提高生物分子固定量;②由于蛋白A可通過疏水作用與IgG分子的Fc段特異結合,使抗體分子探針定向固定至固相表面,這種固定抗體特性較直接物理吸附或共價結合更為有序且不影響抗體活性,從而進一步提高了功能化探針活性。因此,與傳統磁微粒功能化探針相比,將金磁微粒優勢與蛋白A定向固定抗體特性相結合制備的蛋白A-金磁微粒功能化探針具有更高的活性,且可提高檢測靈敏度。此外,這種將蛋白A-金磁微粒功能化捕獲探針、酶標噬菌體抗體信號檢測探針的信號放大效應及磁免疫分離技術等多重優勢結合的研究思路,在發展靈敏度高、特異性強的復雜生物樣品檢測領域具有廣闊的應用前景。
[1]Liu B,Tong Z Y,Liu W,Hao L Q,Mu X H,Huang Q B.J.Instrum.Anal.(劉冰,童朝陽,劉威,郝蘭群,穆晞惠,黃啟斌.分析測試學報),2013,32(8):998-1002.
[2]Zhou H J,Lee J W,Park T J,Lee S J,Parkd J Y,Lee J B.Sens.Actuators B,2012,163(1):224 -232.
[3]Masoomi L L,Sadeghi O,Banitaba M H,Shahrjerdi A,Davarani S S H.Sens.Actuators B,2013,177:1122-1127.
[4]Peng H P,Liang R P,Zhang L,Qiu J D.Biosens.Bioelectron.,2013,42:293 -299.
[5]Parshetti G K,Lin F H,Doong R A.Sens.Actuators B,2013,186:34-43.
[6]Chen M,Bi S,Jia X Q,He P.Anal.Chim.Acta,2014,837:44-51.
[7]Jayanthi S A,David T M,Jayashainy J,Nathan D M,Sagayaraj P.J.Alloys Compd.,2014,606:254 -261.
[8]Mu X H,Tong Z Y,Huang Q B,Liu B,Liu Z W,Hao L Q,Zhang J P.Chin.J.Anal.Chem.(穆晞惠,童朝陽,黃啟斌,劉冰,劉志偉,郝蘭群,張金平.分析化學),2014,42(6):785-790.
[9]Ding Y J,Wang H,Li J S,Shen G L,Yu R Q.Chem.J.Chin.Univ.(丁艷君,王樺,李繼山,沈國勵,俞汝勤.高等學校化學學報),2005,26(2):222-226.
[10]Li N,Yuan N,Chai Y Q,Chen S H,Tang D P,An H Z.J.Instrum.Anal.(李娜,袁若,柴雅琴,陳時洪,唐點平,安海珍.分析測試學報),2007,26(6):769-773.
[11]Ikeda T,Hata Y,Ninomiya K I.Anal.Biochem.,2009,385(1):132 -137.
[12]Shen G Y,Cai C B,Wang K,Lu J L.Anal.Biochem.,2011,409(1):22-27.
[13]Mu X H,Tong Z Y,Huang Q B,Liu B,Liu Z W,Hao L Q,Zhang J P,Gao C,Wang F W.Sensors,2015,15:3896-3910.
[14]Cui Y L,Hui W L,Wang H R,Wang L J,Chen C.Sci.China B(崔亞麗,惠文利,汪慧蓉,王利軍,陳超.中國科學:B輯),2003,33(6):482-488.
[15]Mu X H,Tong Z Y,Huang Q B,Liu Z W,Liu B,Hao L Q,Zhang J P.Chin.J.NBC Def.(穆晞惠,童朝陽,黃啟斌,劉志偉,劉冰,郝蘭群,張金平.防化學報),2014,2:24-27.

