超高效液相色譜-串聯質譜法測定水果中乙撐硫脲殘留
葉孟亮,聶繼云,徐國鋒,閆 震,鄭麗靜,李志霞
(中國農業科學院果樹研究所,農業部果品質量安全風險評估實驗室(興城),農業部果品及苗木質量監督檢驗測試中心(興城),遼寧 興城 125100)
隨著經濟的發展和生活水平的提高,人們對果品質量安全的要求也越來越高。農藥殘留是果品質量安全中比較敏感且備受關注的話題。二硫代氨基甲酸鹽(酯)類(DTCs)殺菌劑(如代森錳鋅、代森鋅、丙森鋅、福美雙等)因具有高效、廣譜殺菌的效果而在水果生產中廣泛使用[1-2],其主要代謝物為乙撐硫脲。國際癌癥研究機構(IARC)評估乙撐硫脲僅對動物存在致癌作用[3-4],但食用含有乙撐硫脲殘留的水果是否會對人體健康產生危害,已引起公眾關注[5-6]。準確高效的檢測方法是開展乙撐硫脲殘留風險監測與評估的基礎。目前關于乙撐硫脲殘留的檢測方法有氣相色譜法[7-10]、高效液相色譜法[3,11-12]、液相色譜-串聯質譜法[13-16]等,但這些方法存在前處理復雜、溶劑消耗量大、耗時、繁瑣、檢出限高、回收率偏低等不足,限制了其應用,因此建立快速、準確的測定水果中乙撐硫脲殘留的分析方法具有重要意義。
本文在前人研究的基礎之上,對乙撐硫脲的檢測方法進行了篩選和優化,建立了快速、準確、高效測定水果中乙撐硫脲殘留的檢測方法。采用堿性乙腈(1.5%氨水乙腈)兩次提取,弗羅里硅土進行凈化,利用超高效液相色譜-串聯質譜(UPLC-MS/MS)在多反應監測模式下進行檢測。該方法有效去除了干擾,提高了靈敏度,定性與定量準確,能夠很好地滿足水果中乙撐硫脲殘留的快速檢測和確證要求。
1 實驗部分
1.1 儀器與試劑
超高效液相色譜-串聯質譜儀(UPLC-MS/MS Xevo TQ,美國Waters公司);立式大容量高速離心機(日本Hitachi公司);Milli-Q全自動超純水制水機(美國Millipore公司)。
甲醇、乙腈、甲酸銨、乙酸銨、甲酸、乙酸、氨水(色譜純,美國Thermo Fisher Scientific公司);C18(ODS,50 μm,60)、石墨炭黑粉(GCB,Agela Technologies Inc);中性氧化鋁(Alumina-N)、弗羅里硅土(Florisil,200 μm,100 g)、PSA(40 μm,100 g)均購于美國Varian公司;無水MgSO4(優級純,天津市津科精細化工研究所);NaCl(優級純,天津市科密歐化學試劑有限公司);實驗用水為超純水。
乙撐硫脲(ETU)標準品(CAS No.96-45-7,德國Sigma-Aldrich公司),0.25 g,純度≥99%。
1.2 標準溶液的配制
準確稱取ETU標準品0.01 g于10 mL容量瓶中,用乙腈溶解并定容,配成1 000 mg/L的儲備液,置于-20℃冰箱保存。準確移取適量標準儲備液,按照梯度稀釋的原則,配成5,20,50,100,200 μg/L的ETU標準工作液系列。標準工作溶液現用現配。
1.3 樣品前處理
準確稱取5 g勻漿樣品于50 mL具塞離心管中,加入5 mL提取液(1.5%氨水乙腈),搖勻2 min,靜置10 min,9 000 r/min離心3 min,將上清液轉移至另一支離心管中,再向殘渣中加入5 mL提取液,重復以上操作,合并兩次上清液,加入1 g氯化鈉、2 g無水硫酸鎂,振蕩混勻2 min,9 000 r/min離心3 min,吸取上層有機相1 mL于10 mL離心管中,加入0.05 g弗羅里硅土,渦旋振蕩1 min,靜置2 min,上清液過0.22 μm有機系濾膜,待測。
1.4 UPLC-MS/MS條件
1.4.1 超高效液相色譜條件 HSS T3色譜柱(100 mm×2.1 mm,1.8 μm,美國Waters公司);柱溫:40℃;流動相:A為乙腈,B為0.2%甲酸水溶液;梯度洗脫程序:0~2 min,5%~95%A;2~4 min,95%~5%A;4~5.5 min,5%A;流速:0.4 mL/min;進樣體積:5 μL。
1.4.2 質譜條件 電噴霧離子源(ESI);掃描方式:正離子模式;毛細管電壓:3.0 kV;檢測方式:MRM(多反應監測);離子源溫度:150℃;去溶劑氣溫度:350℃;去溶劑氣和錐孔氣均為高純氮氣,流速分別為650 L/h和50 L/h;碰撞氣:高純氬氣,流速0.14 mL/min。質譜參數:錐孔電壓30 V,定量離子對m/z 103/44.1,碰撞能量16 V;定性離子對m/z 103/86,碰撞能量14 V。
2 結果與討論
2.1 樣品前處理的優化
2.1.1 提取溶劑的優化 乙撐硫脲的提取溶劑主要有乙腈[6,16]、甲醇[5,15,17-18]。本研究以蘋果為例,考察了這兩種提取溶劑對乙撐硫脲的回收率。結果表明,以乙腈作為提取溶劑時,乙撐硫脲的回收率在50%左右,比甲醇作為提取溶劑時的回收率高10%,但回收率仍較低。Ekman等[6]的研究表明,堿性環境可以提高乙撐硫脲在乙腈中的溶解性,二者存在共軛效應,且乙撐硫脲在pH 5.0~9.0的環境下較穩定[16]。因此,實驗嘗試在乙腈中添加適量氨水(0.5%,1.0%,1.5%和2.0%),考察提取液pH值對乙撐硫脲回收率的影響。結果表明,1.5%氨水乙腈(pH 8.7)的提取效果最好,加標回收率達90%以上,因此最終選擇1.5%氨水乙腈作為提取溶劑(圖1)。
2.1.2 凈化劑的優化 本研究以較復雜的柑橘和含色素較豐富的葡萄為例,采用分散固相萃取即 QuEChERS 方法[19-20],考察了 ODS、PSA、GCB、Alumina-N和Florisil 5種凈化劑對水果中色素、有機酸、脂肪等雜質的凈化效果以及對乙撐硫脲回收率的影響(見表1)。結果發現,除了ODS、Alumina-N對色素的吸附效果較差外(溶液顏色較深),其余3種凈化劑的凈化效果均良好;而經GCB凈化后,葡萄中乙撐硫脲的回收率偏低,為75.2%;經PSA凈化后目標信號附近有雜峰干擾。因此,綜合回收率、目標信號峰形、試劑成本等方面,最終選用Florisil為凈化劑。
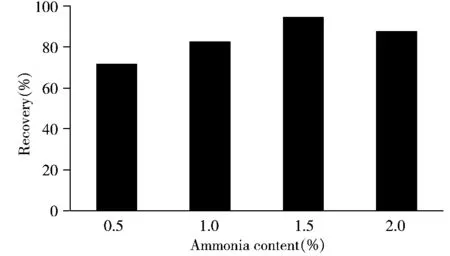
圖1 不同濃度的氨水乙腈對蘋果中乙撐硫脲回收率的影響Fig.1 Effect of different concentrations of acetonitrile and ammonia solution on recovery of ETU in apple
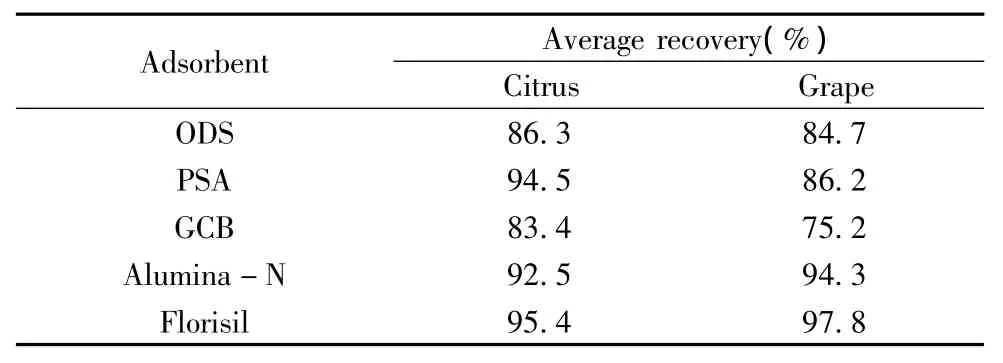
表1 經不同凈化劑吸附后乙撐硫脲的回收率Table 1 Recovery of ETU absorbed by different cleaning agents
2.2 色譜條件的優化
流動相中緩沖鹽的類型和離子強度對目標離子的色譜保留時間及質譜電噴霧離子的電離程度均有影響。甲酸、乙酸、甲酸銨和乙酸銨具有高揮發性和高溶解性,常用作液相色譜-串聯質譜分析的緩沖鹽。對比了乙腈-甲酸、乙腈-乙酸、乙腈-甲酸銨和乙腈-乙酸銨4種流動相體系對乙撐硫脲峰形及響應值的影響。結果表明,以乙腈-甲酸作為流動相時,乙撐硫脲的峰形較好,響應值較高(圖2)。為達到更高的檢測靈敏度,本研究進一步對甲酸濃度(0.05%,0.1%,0.2%和0.3%)進行優化。結果表明,當甲酸濃度為0.2%時,乙撐硫脲的信號響應值最高;當濃度超過0.2%后,乙撐硫脲的響應值反而下降,原因在于離子源中離子濃度過高時會抑制待測組分的電離,從而導致離子化效率下降[21]。因此,實驗確定以乙腈-0.2%甲酸作為最佳流動相。
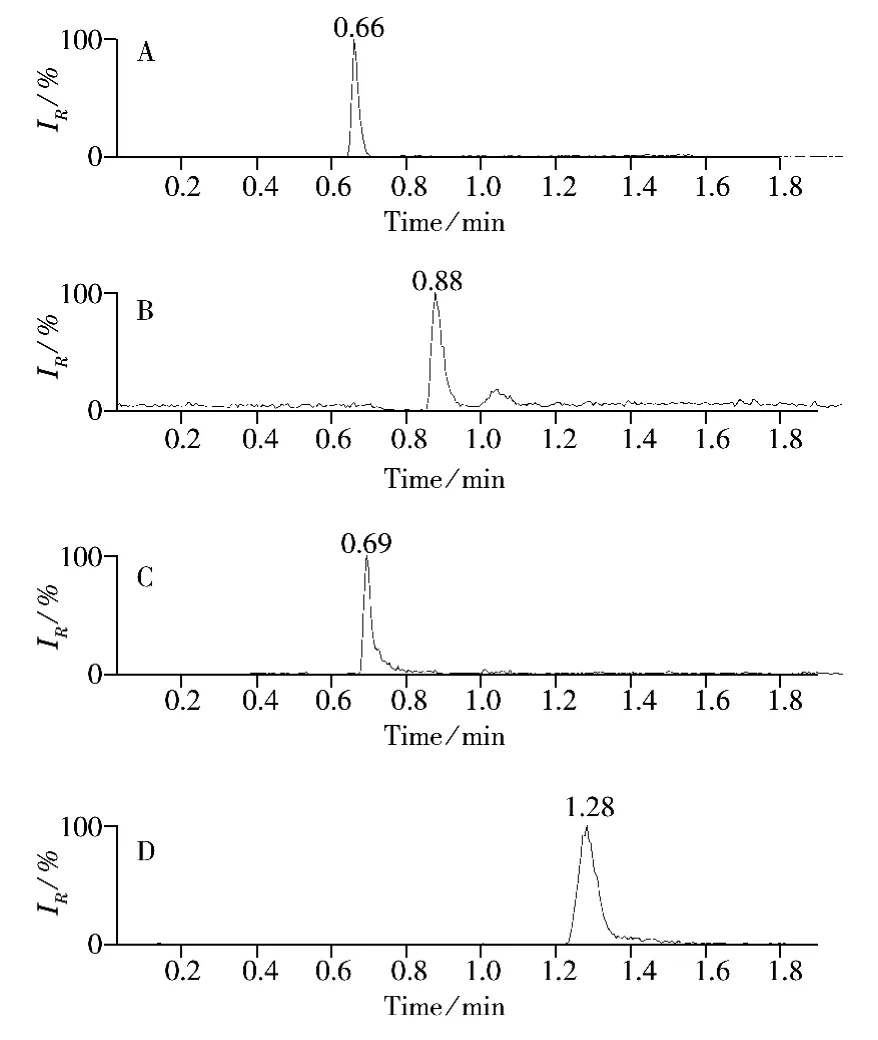
圖2 4種不同流動相條件下乙撐硫脲的總離子流色譜圖Fig.2 TIC chromatograms of ETU with four different kinds of mobile phase conditions
2.3 基質效應
基質效應(Matrix effects)是指色譜分離時共洗脫的物質改變了目標分析物的離子化效率,從而引起信號的抑制或增強[22]。基質效應影響大時將降低方法的靈敏度和準確性,進而影響儀器定性及定量分析。關于液相色譜-串聯質譜分析中的基質效應已有大量研究,通常認為色譜分離過程中共流出物質對目標組分的響應值有很大影響[23]。共流出物質主要指樣品前處理后仍保留在待測樣液中的各類有機物(如脂肪酸類、糖類、色素等)[18]。選取蘋果、桃、葡萄、柑橘和香蕉5種代表性水果進行研究,考察了乙撐硫脲在不同水果中的基質效應。分別篩選出不含乙撐硫脲殘留的5種水果作為空白基質,用溶劑標準樣液和5種水果空白基質匹配標準樣液,在相同前處理和色譜條件下分別進樣,按照公式Matrix effect(Me)=(A-B)/B×100%(A:基質匹配標準樣液響應值,B:溶劑標準樣液響應值)計算乙撐硫脲在不同水果中的基質效應[20]。結果表明,乙撐硫脲在5種水果中均表現出基質減弱效應,且在柑橘和香蕉中的基質減弱效應較大(表2)。這可能是由不同水果中有機酸和果膠的含量不同所致[23]。按照農藥殘留檢測結果相對偏差不超過10%的要求[24],當Me的絕對值大于10%時,即判定為有基質效應。因此,為保證方法的準確性和實用性,本研究采用基質匹配標準樣液對基質效應進行補償。

表2 乙撐硫脲在不同水果樣品中的基質效應Table 2 Matrix effects of ETU in different fruits
2.4 線性方程、相關系數、檢出限與定量下限
用不同水果空白基質分別配制5,20,50,100,200 μg/L質量濃度的基質匹配標準溶液。以乙撐硫脲的峰面積(y)對相應的質量濃度(x,μg/L)進行線性回歸,結果表明,乙撐硫脲在5~200 μg/L范圍內線性良好,相關系數均大于0.999。以3倍信噪比(S/N=3)計算方法的檢出限(LOD),以S/N=10計算方法的定量下限(LOQ)。5種水果基質中乙撐硫脲的LOD為0.08~0.26 μg/L,LOQ為0.28~0.86 μg/L(表3),均遠低于國家標準規定的殘留限量(目前國內尚未制定水果中乙撐硫脲最大殘留限量值,按照歐洲國家規定的植物性食品中乙撐硫脲的最大殘留限量為50 μg/L計[8]),方法的靈敏度可滿足農藥殘留檢測的要求。
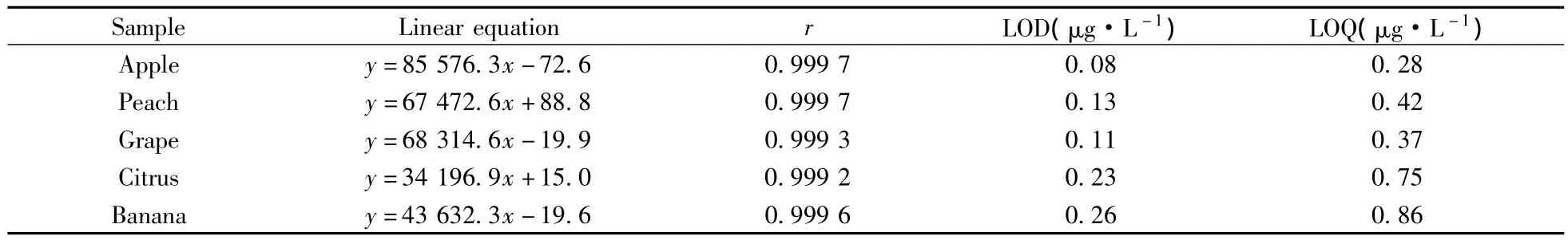
表3 乙撐硫脲在不同水果樣品中的標準方程、相關系數、檢出限及定量下限Table 3 Standard regression equations,correlation coefficients(r),LODs and LOQs of ETU obtained from different fruits
2.5 回收率與相對標準偏差
分別對5種不同水果基質進行5,20,50 μg/L 3個加標水平的回收率實驗。按照本方法進行提取、凈化及測定,結果見表4。經基質匹配標準樣液校正后,乙撐硫脲在5種水果中的平均回收率為79.5%~101.4%,相對標準偏差(RSD)為2.7%~9.4%,表明該方法具有良好的準確度和精密度,完全滿足水果中乙撐硫脲殘留分析的要求。
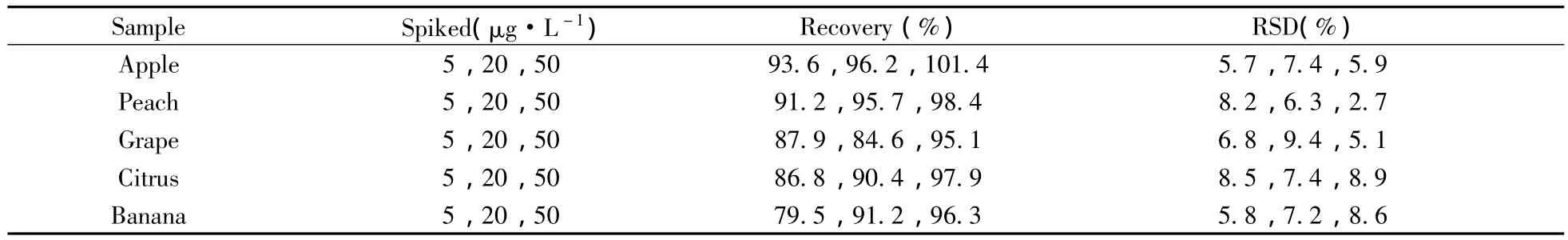
表4 乙撐硫脲在不同水果樣品中的加標回收率及相對標準偏差(n=6)Table 4 Recoveries and RSDs of ETU obtained from different fruits(n=6)
2.6 實際樣品的測定
采用本方法對當地農貿市場購買的蘋果、桃、葡萄、柑橘、香蕉5種水果各5個共25個樣品進行檢測。結果顯示,11個水果樣品(其中蘋果4個,桃3個,葡萄3個,柑橘1個)中檢出乙撐硫脲殘留,檢出率為44%,殘留量為0.36~5.74 μg/L。陽性蘋果樣品的色譜圖見圖3。
3 結論
本文建立了水果中乙撐硫脲殘留的液相色譜-串聯質譜檢測方法,采用1.5%氨水乙腈兩次提取,弗羅里硅土凈化后,超高效液相色譜-串聯質譜儀(UPLC-MS/MS)多反應監測模式檢測,方法的靈敏度、準確度和精密度均滿足國家規定的要求[25],可用于水果中乙撐硫脲殘留的快速檢測和確證分析。
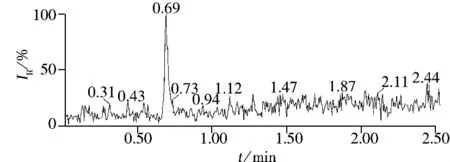
圖3 蘋果中乙撐硫脲殘留的總離子流色譜圖Fig.3 TIC chromatogram of ETU residue in an apple sample
[1]Chen L P,Li J X,Wu M,Lin L Y,Chen D J,Zhou Y,Xu D M.J.Instrum.Anal.(陳鷺平,李久興,吳敏,林立毅,陳達捷,周昱,徐敦明.分析測試學報),2013,32(3):287-292.
[2]Chen W Y,Dong F S,Liu X G,Qin D M,Liao X L,Cheng L,Wang C R,Zheng Y Q.Chin.J.Anal.Chem.(陳武瑛,董豐收,劉新剛,秦冬梅,廖曉蘭,程莉,王晨蕊,鄭永權.分析化學),2010,38(4):508-512.
[3]Garcinuφ1oa R M,Ramosb L,Fernández-Hernandoa P,Cámarac C.J.Chromatogr.A,2004,1041(1/2):35-41.
[4]Ripollés C,Sancho J V,López F J,Hernández F.J.Chromatogr.A,2012,1243:53 -61.
[5]Lemes V R R,Martins-Júnior H A,de Souza S V C,Colacioppo S.Food Control,2014,42:321 -328.
[6]Ekman E,Maxe M,Littorin M,J9nsson B A G,Lindh C H.J.Chromatogr.B,2013,(934):53-59.
[7]Feng X Q,Li H,Zhao Q X,Zhu C S.Agrochemicals(馮秀瓊,李琥,趙秋霞,朱昌壽.農藥),1997,36(5):31-33.
[8]Qin D M,Xu Y M,Huang Y C,Sun Y,He L L.Environ.Chem.(秦冬梅,徐應明,黃永春,孫揚,何麗麗.環境化學),2008,27(3):305-309.
[9]Shi L L,Shan Z J,Jin Y,Cai D J.J.Instrum.Anal.(石利利,單正軍,金怡,蔡道吉.分析測試學報),2005,24(2):92-94.
[10]Tan T Y,Cai L M,Wang L D,Guo P C,Li G L.Agrochemicals(譚頭云,蔡磊明,王立冬,郭鵬程,李國亮.農藥),2009,48(8):591-597.
[11]Fan Z X,Ye Z Q,Xu Y C,Chu L W.J.Jilin Agric.Univ.(范志先,葉志強,許允成,初麗偉.吉林農業大學學報),2001,23(1):69-71.
[12]Xu Y C,Wang C W,Han S,Gao J.J.North Agric.Univ.(許允成,王春偉,韓雙,高潔.東北農業大學學報),2012,43(3):77-80.
[13]López-Fernández O,Rial-Otero R,Cid A,Simal-Gándara J.Food Chem.,2014,145:1002 -1010.
[14]Berton T,Mayhoub F,Chardon K,Duca R C,Lestremau F,Bach V,Tack K.Environ.Res.,2014,132:311 -320.
[15]Tran K,Mactal L P,Cromer M R,Vocque R H,Smith R E.Food Chem.,2013,140(1/2):340-342.
[16]Zhou L,Liu X L,Kang S,Zhang F Z,Pan C P.Food Chem.,2013,138:1355 -1359.
[17]Bonnechère A,Hanot V,Van Loco J.J.Chromatogr.A,2011,1218(29):4627 -4631.
[18]Fernández-Fígares I,Rodríguez L C,González-Casado A.J.Chromatogr.B,2004,799(1):73 -79.
[19]He Z Y,Wang L,Peng Y,Luo M,Wang W W,Liu X W.Food Chem.,2015,169:372-380.
[20]Yan Z,Nie J Y,Xu G F,Li H F,Li J,Li Z X,Wu Y L,Kuang L X.J.Instrum.Anal.(閆震,聶繼云,徐國鋒,李海飛,李靜,李志霞,毋永龍,匡立學.分析測試學報),2014,33(9):1000-1009.
[21]Wu Y X,Lin F,Lin H D,Shao L Z,Jiao H,Li X.J.Instrum.Anal.(吳映璇,林峰,林海丹,邵琳智,焦紅,李荀.分析測試學報),2009,28(5):617-620.
[22]Wu J M,Qian X Q,Yang Z G,Zhang L F.J.Chromatogr.A,2010,1217(9):1471-1475.
[23]Mathias P C,Hayden J A,Laha T J,Hoofnagle A N.Clin.Chim.Acta,2014,437:38-42.
[24]Xu G F,Nie J Y,Li J,Li H F,Yan Z.Chin.J.Pestic.Sci.(徐國鋒,聶繼云,李靜,李海飛,閆震.農藥學學報),2014,16(3):307-312.
[25]Residues Analysis Quality Control Guide.General Administration of Quality Supervision,Inspection and Quarantine of the People’s Republic of China(殘留分析質量控制指南.中華人民共和國質量監督檢驗檢疫總局).

