Luminol-K3[Fe(CN)6]流動注射化學發光體系檢測頭孢吡肟
俞宏松,翟 倩,李曉璐,郭 晶,易 鋼
(重慶醫科大學 檢驗醫學院 臨床檢驗診斷學教育部重點實驗室,重慶 400016)
頭孢吡肟(Cefepime)為布邁-施貴寶公司(BMS)開發的新型第四代頭孢菌素,其抗菌譜廣,對多數革蘭陽性菌及革蘭陰性菌有抗菌活性,特別對產Ⅰ型β-內酰胺酶的革蘭陰性桿菌有很強的抗菌活性。其抗菌作用機制是通過與細菌細胞的1個或多個青霉素結合蛋白(PBPs)相結合,影響細菌細胞壁的合成與代謝,從而起到抗菌作用[1]。目前,頭孢吡肟的測定方法主要有高效液相色譜法[2]、離子交換色譜法[3-4]、熒光法[5]、分光光度法[6]等,而用流動注射化學發光法測定頭孢吡肟尚未見文獻報道[7-9]。
流動注射分析(FIA)是在熱力學非平衡條件下,通過載流驅動重現技術來處理試樣或試劑區帶的動態定量分析技術,具有分析速度快、準確度和精密度好、自動化程度高以及可與多種檢測手段相結合等優點[10-12]。化學發光具有靈敏度高、線性范圍寬、操作簡單等優點[13-15]。將流動注射技術與化學發光檢測聯用構成的流動注射化學發光檢測法已成為近年來藥物分析的新手段之一[16-18]。
1 實驗部分
1.1 儀器與試劑
MPI-B型多參數化學發光分析測試系統(西安瑞邁電子有限公司);KQ3200DB型數控超聲清洗器(昆山市超聲儀器公司);Milli-Q純水儀(密理博中國公司)。
頭孢吡肟標準品儲備液(1.0×10-4g/mL):準確稱取0.010 g頭孢吡肟標準品(中國食品藥品檢定研究所),用水溶解并定容至100 mL容量瓶(棕色),于4℃冰箱中儲存備用,使用時以水逐級稀釋至所需濃度;NaOH溶液(1 mol/L):稱取4 g氫氧化鈉用水溶解并定容至100 mL容量瓶(棕色)中備用,使用時以水逐級稀釋;魯米諾儲備溶液(2.0×10-3mol/L):準確稱取0.035 4 g魯米諾,用0.1 mol/L NaOH溶液溶解并定容于100 mL棕色容量瓶中,使用時以0.1 mol/L NaOH溶液逐級稀釋;K3[Fe(CN)6]儲備液(2.0×10-3mol/L):準確稱量0.065 9 g K3[Fe(CN)6],用水溶解并定容至100 mL棕色容量瓶中,使用時以水逐級稀釋。其他試劑均為分析純,實驗用水為去離子水(Milli-Q,≥18 MΩ·cm)。
1.2 實驗方法
流動注射化學發光分析裝置如圖1所示,各種實驗溶液被泵入,在六通閥充分混合后發生化學發光反應,產生的光信號經光電倍增管檢測。當注入水時檢測到的發光信號為空白信號(I0);當注入一定濃度的頭孢吡肟時檢測到的增強發光信號為Ia,用相對發光強度ΔI=Ia-I0進行定量分析。
2 結果與討論
本研究發現,在堿性介質中,頭孢吡肟對Luminol-K3[Fe(CN)6]體系的化學發光強度具有顯著增強作用(圖2),據此建立了流動注射化學發光測定頭孢吡肟的新方法,并對針劑中頭孢吡肟含量進行了測定。
2.1 反應物混合順序的影響
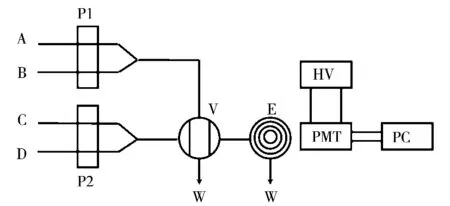
圖1 流動注射化學發光分析流路圖Fig.1 Schematic diagram of flow injection chemiluminescence(CL)analysis system
實驗發現,反應物混合順序對化學發光強度具有較大影響。分別按照以下混合順序進行實驗:①(頭孢吡肟 +魯米諾)+(K3[Fe(CN)6]+氫氧化鈉);②(頭孢吡肟+氫氧化鈉)+(魯米諾+K3[Fe(CN)6]);③(頭孢吡肟 +K3[Fe(CN)6])+(氫氧化鈉+魯米諾)。結果表明,進樣方式①所得ΔI最大且穩定,因此選擇此種方式進樣。
2.2 實驗條件的優化
2.2.1 堿性介質的選擇 本實驗發光效應需在堿性介質中進行,因此堿性介質種類的選擇對實驗有較大影響。分別在同濃度的NaOH,Na2CO3,NaHCO33種堿性介質中測定頭孢吡肟對Luminol-K3[Fe(CN)6]體系化學發光的增強能力。結果表明,在NaOH溶液中,頭孢吡肟對發光體系的增強能力最強。因此選用NaOH為實驗的堿性介質。
2.2.2 NaOH濃度的影響 在0.06~0.16 mol/L范圍內考察了NaOH濃度對化學發光強度的影響。如圖3A所示,NaOH溶液濃度為0.12 mol/L時ΔI較大,之后隨著NaOH濃度的增加其發光效應逐漸趨于穩定,因此實驗選擇NaOH的濃度為0.12 mol/L。
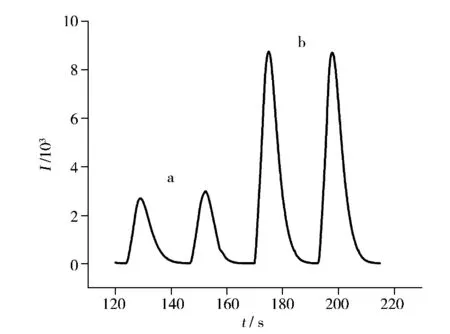
圖2 化學發光增強曲線圖Fig.2 Enhanced curve of the chemiluminescence system
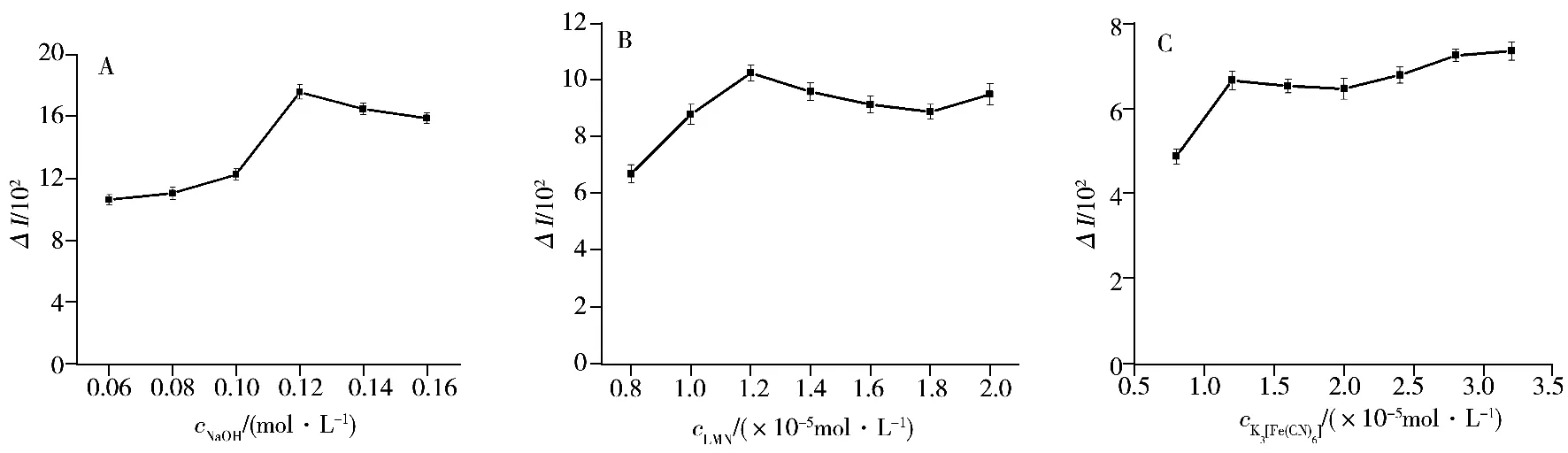
圖3 各化合物濃度對體系化學發光強度的影響Fig.3 Effect of compound concentrations on CL intensities of the system
2.2.3 魯米諾濃度的影響 魯米諾是本實驗體系的發光劑,其濃度會影響體系的發光強度、檢測靈敏度及線性范圍。在固定其他條件不變的情況下,考察了魯米諾濃度在8.0×10-6~2.0×10-5mol/L范圍內對化學發光強度的影響(圖3B)。結果發現,當魯米諾濃度為1.2×10-5mol/L時,實驗體系的發光效應較強且穩定;隨著魯米諾濃度的繼續增加,發光強度的變化趨于穩定,因此實驗選用魯米諾濃度為1.2×10-5mol/L。
2.2.4 K3[Fe(CN)6]濃度的影響 K3[Fe(CN)6]是本實驗體系的氧化劑,其濃度同樣影響體系的發光強度及檢測靈敏度。固定其他實驗條件不變,考察了K3[Fe(CN)6]濃度在8.0×10-6~3.2×10-5mol/L范圍內對發光強度的影響(如圖3C)。結果顯示,當K3[Fe(CN)6]濃度為1.2×10-5mol/L時ΔI較大;隨著K3[Fe(CN)6]濃度的繼續增加,體系的發光強度變化逐漸趨于穩定,因此實驗選用K3[Fe(CN)6]的最佳濃度為1.2 ×10-5mol/L。
2.3 儀器參數的選擇
研究發現,采樣時間、蠕動泵的泵速、光電倍增管負高壓值影響發光體系的穩定性、信噪比以及化學發光強度。通過實驗優化,儀器參數設定如下:采樣時間為5 s,蠕動泵的泵速為30 r/min,光電倍增管負高壓為700 V。
2.4 線性范圍與檢出限
在上述優化實驗條件下,頭孢吡肟在3.0×10-6~4.0×10-5g/mL濃度范圍內與相對發光強度ΔI呈良好的線性關系,線性方程為ΔI=434.58+76.26lgρ,相關系數為0.999 6。對2.0×10-5g/mL的頭孢吡肟標準溶液連續測定11次,其相對標準偏差(RSD)為1.5%。根據IUPAC建議,以3倍空白標準偏差計算出方法的檢出限為2.8×10-6g/mL。
2.5 干擾試驗
在優化實驗條件下,考察了頭孢吡肟針劑中主要添加劑(L-精氨酸)和實驗中可能的干擾物對頭孢吡肟含量測定的干擾。以相對誤差小于5%為允許量,對1.0×10-5g/mL頭孢吡肟進行多種物質的干擾實驗。結果表明,100倍的Na+、K+、Cl-、葡萄糖,50倍的PO3-4、Zn2+、SO2-4,20倍的L-精氨酸、淀粉、糊精、乳糖,以及等倍濃度的Ca2+與Mg2+均不干擾測定。由于頭孢吡肟針劑中上述干擾物質的實際含量均低于允許量,因此無須分離或其他處理,可直接測定。
2.6 實際樣品的測定
準確稱取頭孢吡肟針劑(悅康集團)0.010 g,加水溶解并定容至100 mL,使用時以水稀釋其濃度至工作曲線范圍。頭孢吡肟針劑溶液稀釋20倍后,頭孢吡肟的標記濃度為5.0×10-6g/mL。采用本方法對針劑中的頭孢吡肟含量平行測定9次,得平均值為5.03×10-6g/mL,RSD為1.3%。分別按照低、中、高3個濃度水平進行加標回收實驗,測得的回收率分別為97%,102.3%,98.5%,RSD分別為0.6%,1.1%,1.9%,結果如表1所示。

表1 樣品回收率試驗結果Table 1 Results of recovery test
3 結論
本文基于頭孢吡肟在堿性介質中對Luminol-K3[Fe(CN)6]化學發光體系具有明顯的增強作用,建立了測定頭孢吡肟的新方法。該方法靈敏度高,線性范圍寬,重復性好,用于頭孢吡肟針劑的檢測,結果滿意。該方法有望成為臨床檢測頭孢吡肟濃度的方法之一。
[1]Chen H Y,Lin Y,Dong P.Chin.Pharm.J.(陳華英,林陽,董平.中國藥學雜志),2009,2(4):67-71.
[2]Shi Y H.Chinese Medicine Guide(史玉紅.中國醫藥指南),2013,11(7):497-499.
[3]Guo J Z,Cui H,Zhou W,Wang W.J.Photochem.Photobiol.A,2008,193:89-96.
[4]Wang J Y,Song S J,Wu Q H,Wang C,Wang Z.Spectrosc.Spectral Anal.(王珺瑫,宋雙居,吳秋華,王春,王志.光譜學與光譜分析),2011,31(9):2517-2521.
[5]Boro R C,Kaushal J,Nangia Y,Wangoo N,Bhasin A,Suri C R.Analyst,2011,136:2125 -2130.
[6]Wang W,Duan M R,Zhai Y J,Bi S Y,Kang W J,Xu X D.Chin.J.Spectrosc.Lab.(王瑋,段夢茹,翟一靜,畢思遠,康維均,徐向東.光譜實驗室),2013,30(3):1488-1492.
[7]Ji Z P,Yu J D,Hu X Y.Univ.Chem.(嵇正平,郁金丹,胡效亞.大學化學),2012,27(6):65-68.
[8]Chen X L,Yang J,Xu S J,Xiao L J.Chin.J.Anal.Chem.(陳效蘭,楊娟,徐淑靜,肖柳婧.分析化學),2009,37(11):1622-1626.
[9]Ma M Y.Appl.Chem.Ind.(馬明陽.應用化工),2014,43(5):954-956.
[10]Li Y X,Yang P,Wang P,Wang L.Anal.Bioanal.Chem.,2007,387:585-592.
[11]Ji Z L,Zhang J K,Li J G.Chin.J.Anal.Chem.(汲中玲,張涇凱,李建國.分析化學),2009,16(1):128.
[12]Xiong H T,Tang Z H,Nie F,Zheng X W.J.Instrum.Anal.(熊海濤,唐志華,聶峰,鄭行望.分析測試學報),2013,32(2):244-248.
[13]Xiong X Y,Tang Y H,Yu C L,Han X N.Northewest Pharm.J.(熊迅宇,唐玉海,于春玲,韓小年.西北藥學雜志),2006,12(25):569-574.
[14]Yuan J,Wang W,Kang W J,Xu X D.J.Instrum.Anal.(苑潔,王瑋,康維鈞,徐向東.分析測試學報),2011,30(12):1436-1439.
[15]Li H S,Zhao M,Liang C,Zhao C J.China Pharm.(李海珊,趙曼,梁晨,趙春杰.中國藥業),2010,29(5):82-84.
[16]Li L J,Zhong Z H,Feng J,Chen Q F,Cheng H,Huang W Y,Kong H J,Wu J L.J.Instrum.Anal.(李利軍,鐘招亨,馮軍,陳其鋒,程昊,黃文藝,孔紅星,吳健玲.分析測試學報),2007,26(1):125-127.
[17]Fan X M,Wang S M,Yin Z M,Su Z K,Chen F Y,Wang X S,Cui F L.J.Instrum.Anal.(樊雪梅,王書民,尹治民,蘇智魁,陳鳳英,王憲生,崔鳳靈.分析測試學報),2012,31(7):873-876.
[18]Wang J,Qu J Y,Zhu L L,Wang J Z,Wang Y.J.Instrum.Anal.(王玨,屈建瑩,朱莉莉,王金中,王越.分析測試學報),2011,30(1):91-94.

