基于3D水凝膠微孔陣列芯片的肺癌細胞檢測
霍丹群郭明遺鄧艷楊眉法煥寶侯長軍(重慶大學生物工程學院;化學工程學院,重慶400044)
基于3D水凝膠微孔陣列芯片的肺癌細胞檢測
霍丹群1郭明遺1鄧艷1楊眉1法煥寶2侯長軍*1
(重慶大學生物工程學院1;化學工程學院2,重慶400044)
基于聚乙二醇雙丙烯酸酯(PEGDA)的紫外光聚合性能,引入甲基丙烯酸羥乙酯(HEMA)增加親水性,引入N-乙烯吡咯烷酮(NVP)加強材料的壓縮屈服應變力,在各功能單體體積比PEGDA∶HEMA∶NVP為5∶4∶1時,設計構建了一種模擬肺癌組織生理微環境的無毒、低免疫原性、高親水性的三維水凝膠微孔陣列芯片(60 mm×20 mm×3 mm)。通過紅外表征及溶脹率測試,證明此芯片可適用于肺癌細胞的培養檢測且穩定性好。集成16種特異性染料組成的卟啉可視傳感系統,實時在線檢測和分析肺癌細胞代謝物指紋圖譜。提取檢測差譜圖色度值數據,基于平方歐氏距離,主成分分析(PCA)結果表明,此芯片能對正常肺細胞和肺癌細胞代謝液正確區分;聚類分析(HCA)結果表明,能對30種肺細胞代謝液樣品正確歸類。本研究開發的基于微孔陣列的肺癌細胞培養代謝液檢測平臺為醫學研究提供了一種全新的可行性檢測方法。
微流控芯片;肺癌;代謝液檢測;可視化傳感陣列
1 引 言
肺癌是威脅人類健康的重大疾病之一,發病率逐年增加,低齡化趨勢明顯,預計10年后,我國肺癌患者將超過100萬人次[1]。傳統的肺癌檢測方法涉及胸部X線、CT成像及核磁共振成像等,設備復雜,操作專業技術要求高,儀器價格昂貴,故迫切需要行之有效且價廉普適的檢測方法[1]。
微流控芯片技術(Microfluidics chip)又稱芯片實驗室(Lab-on-a-chip),具有自動化、高度集成化、檢測成本低、便攜、試劑消耗少、所需樣本少等特點[3~5]。目前,微流控芯片系統在高通量篩選[6,7]、藥物研發[8]、免疫檢測[9]、食品安全[10]、環境監測[11]、疾病診斷和治療[12,13]、取證測試[14]、再生醫學[15,16]等領域都得到了廣泛應用,但用于細胞捕獲、培養、代謝物實時檢測的微流控芯片尚鮮有報道。具有優良生物相容性的甲基丙烯酸羥乙酯(HEMA)和聚乙二醇雙丙烯酸酯(PEGDA)構成的水凝膠微流控芯片是優良的細胞培養支架材料[14,17,18],具有無毒[19]、免疫原性低[15]、可操控性強[20]、高親水性[21],且可進行表面改性修飾[22,23]的特點;更重要的是由聚乙二醇雙丙烯酸酯(PEGDA)交聯形成的3D親水網絡結構在模擬人體內組織微環境和可控體外培養上皆遠優于傳統的2D培養模式。
基于此,本研究設計了一種模擬肺部組織分流結構且可重復使用的低成本、成型快、便攜式、加工工藝簡單的3D微孔陣列芯片[24]。利用PEGDA的紫外光聚合性能、HEMA的高親水性,引入N-乙烯吡咯烷酮(NVP)加強材料的壓縮應變力[25],改善PEGDA水凝膠材料的剛性[26],構建了一種集肺癌細胞的分離、捕獲、培養、觀察、檢測等功能性微單元于一體的水凝膠微流控芯片,可對細胞附著、生長、真實形態表達起促進作用。集成卟啉可視傳感系統可實時在線檢測和分析肺癌細胞代謝物特征,從而獲得肺癌細胞相關的生物應答和代謝等生理信息。
2 實驗部分
2.1 儀器與試劑
NICOLET 6700傅立葉變換紅外光譜儀、1300系列A2超凈工作臺(美國Thermo Fisher公司);便攜式紫外線UV固化燈(365 nm,100W,上海邁芯光電科技有限公司);DMI3000B倒置生物顯微鏡(德國Leica公司);Forma 370系列CO2培養箱(美國Thermo Fisher公司);LDZX-75KBS高壓蒸汽滅菌鍋(上海申安醫療器械廠)。高純氮氣(純度≥99.99%,重慶海格氣體公司)。
聚乙二醇雙丙烯酸酯(PEGDA,平均分子量575,Sigma-Aldrich公司);甲基丙烯酸羥乙酯(HEMA)、N-乙烯基吡咯酮(NVP)(Aladdin公司);PDMS預聚體及固化劑(美國Dow Corning公司);光引發劑Irgacure2959(上海長哲生物有限公司);肺癌細胞與正常肺細胞(中國人民解放軍第三軍醫大學西南醫院);1640細胞培養液、胎牛血清、胰酶、青霉素和鏈霉素均購自Gibco公司。
2.2 芯片設計及制作
2.2.1 微孔陣列芯片設計利用CorelDRAW軟件設計芯片掩膜結構(圖1),尺寸60 mm×20 mm,打印高精度掩膜用于后續紫外聚合反應。細胞培養層(a)設計有直徑為0.9 mm的60個細胞培養室陣列和代謝液收集池(12 mm×16 mm);微通道層(b)模擬人體肺部結構,進口支管內徑2 mm,分支支管內徑為4 mm,流體微通道內徑為0.6 mm,且在(a)層對應結構處同樣設有60個細胞室和代謝液收集池,形成十字交叉微孔結構;培養封蓋層(c)層設計有檢測窗口,內徑為0.8 mm的培養基出入口。三層結構可精確對接。
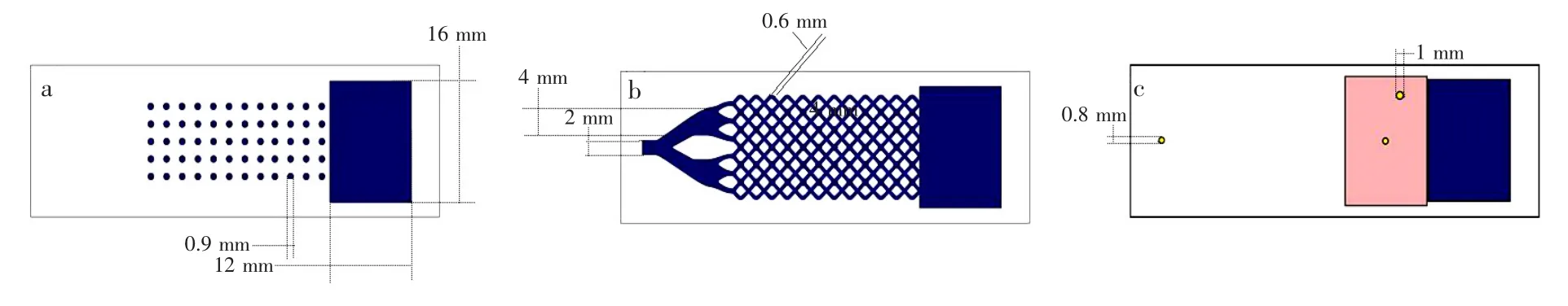
圖1 芯片掩膜設計圖,第一層的微孔陣列為細胞培養層(a),第二層結構為微通道層(b),第三層為氣密性結構封蓋層(c)Fig.1 Structure of the designed hydrogelmicrofluidic chip mask.1stmicropore layer for cell culture(a), 2ndhydrogel layer asmicrochannels(b)and 3rdairtight cover(c)
2.2.2 微孔陣列芯片加工過程按PEGDA∶HEMA∶NVP為5∶4∶1(V/V)加入各單體材料形成預聚物,避光加入預聚物總質量0.3%的光引發劑,混合均勻,注入以第一層掩膜密封的模具中,室溫下,用100 W紫外燈照射10min光聚合,脫模得到一層結構。整個反應過程在氮氣保護下進行。采用相同方法制得第二層芯片結構,圖2為芯片實物圖,模擬肺部組織分流特點及外型構成,成功制作出可用于肺癌細胞代謝物檢測的微孔陣列芯片,進樣分流支管及代謝液收集槽清晰可見,芯片微通道結構整齊陳列于芯片上。再以聚二甲基硅氧烷(PDMS)鍵合芯片,形成一個環境可控且可進行標準化培養的微流控芯片。

圖2 水凝膠微孔陣列芯片的實物圖Fig.2 Hydrogelmicro-well array chip(60 mm×20 mm)
2.3 傅立葉變換紅外光譜(FT-IR)表征
傅立葉變換紅外光譜測定波數范圍為400~4000 cm-1,其中微流控水凝膠芯片壓成粉末采用KBr壓片法測定,液體PEGDA單體、HEMA單體、NVP單體采用液膜法測定。
2.4 芯片溶脹率測試
分別取制作好的水凝膠微流控芯片,稱量其干重Wd,設置不同梯度的溫度及pH值,將芯片置于PBS磷酸鹽緩沖液中溶脹24 h至溶脹平衡,稱重得濕重Ww,材料的溶脹率Swelling ratio(SR), SR(%)=(Ww-Wd)/Wd,每組做5次平行測定。
2.5 細胞培養及代謝液檢測
2.5.1 細胞培養在超凈工作臺中,先將芯片依次置于75%乙醇中2 h、滅菌的PBS緩沖液中1 h,使芯片滅菌。使用微量注射器將細胞懸液(2×105個/mL)從芯片的入口緩慢勻速注入,于收集槽處收集多余的懸液,移入CO2培養箱孵育1 h,待微孔陣列中捕獲到足夠的肺癌細胞,吸取新鮮培養基從入口緩慢沖洗,將微通道內的殘留細胞和未被微孔捕獲的細胞沖至收集槽吸出芯片。移入孵箱進行培養,觀察,每隔8h記錄細胞形狀。培養36 h后細胞代謝液進行可視化傳感芯片的檢測。
2.5.2 檢測傳感芯片制作篩選出16種利用溶膠凝膠法制備的特異性卟啉和酸堿指示劑染料作為傳感陣列點,在點樣室中,用玻璃點樣毛細管取樣,點到裁剪好的12 mm×12 mm的PVDF(4×4)膜上,制備完成的芯片通氮氣干燥20min,密封避光保存以備后續檢測使用。
2.5.3 指紋圖譜的提取與分析應用所設計的傳感芯片,檢測細胞代謝液,選取檢測前和檢測后的差譜圖,提取特征RGB顏色標準值,計算歐氏距離,并進行主成分和系列聚類數據分析。
3 結果與討論
3.1 芯片共聚物水凝膠的紅外光譜分析
在芯片樣本(Chip)以及3種單體(PEGDA、HEMA、NVP)的FT-IR圖譜(圖3)中,可見共聚物芯片集合了 PEGDA、HEMA、NVP的FT-IR特征結構。3422.47 cm-1為末端-OH的伸縮振動峰,2980~2876.17 cm-1區域為CH3,CH2,CH中CH的伸縮振動峰,1731.55 cm-1為酯鍵 CO振動峰,1452.46 cm-1處為CH2和CH3的彎曲振動,1101.86 cm-1處為COOR酯鍵的伸縮振動峰,752.44 cm-1處為CH2的平面搖擺振動峰和OH 面外彎曲振動峰,且 2900 cm-1附近的CH上氫鍵所對應的特征吸收峰消失及1637 cm-1附近的雙鍵吸收峰大幅度減弱,說明雙鍵已被打開,各材料單體之間發生了共聚反應,形成了具備研究設計所需材料特征的水凝膠芯片。
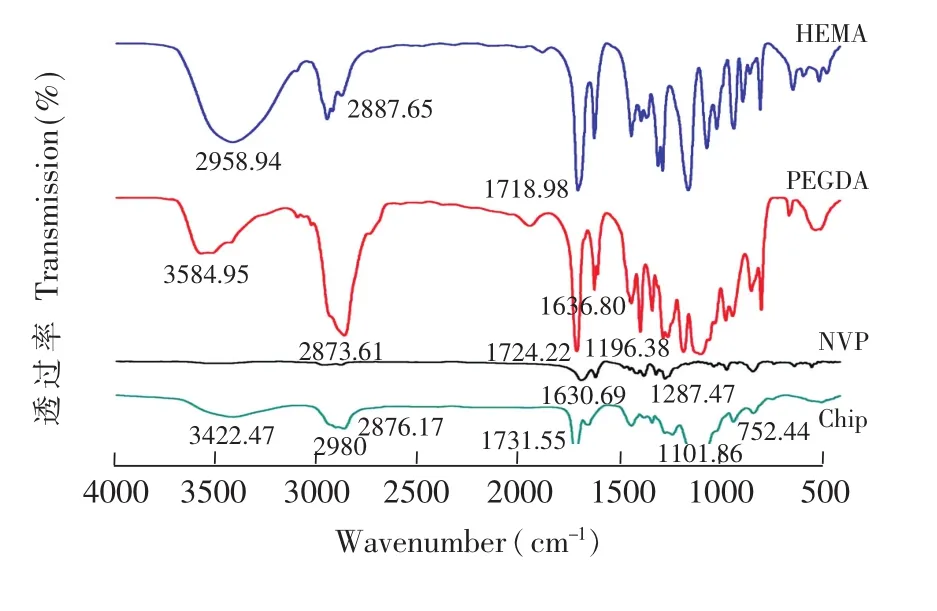
圖3 3種單體(甲基丙烯酸羥乙酯HEMA,聚乙二醇雙丙烯酸酯PEGDA,N-乙烯吡咯烷酮NVP)及芯片共聚物水凝膠的FT-IR譜Fig.3 FT-IR spectra of three monomer(2-hydroxyethyl methacrylate(HEMA),Poly(ethylene glycol)diacrylate (PEGDA),1-vinyl-2-pyrrolidone(NVP))and copolymer hydrogel
3.2 溫度及pH值對微流控芯片溶脹率的影響
圖4所示為水凝膠微流控芯片在不同溫度梯度及pH值下溶脹率的變化,隨著溫度和pH值升高,溶脹率皆呈現降低趨勢,但變化幅度小,表明此芯片可在正常的室溫和37℃生理溫度以及生理pH范圍內使用,且結構穩定性好,避免了芯片結構和性能的不穩定對后續實驗的影響。
3.3 微孔陣列芯片制備
利用PEGDA材料的紫外聚合功能,輔以高精度的掩膜,制作出了水凝膠微孔陣列芯片。圖5為顯微鏡下微流控芯片的部分結構示意圖,圖5a為十字交叉微孔結構,圖5b為芯片彎道結構。尺寸未發生偏差,且邊緣整齊,結構清晰,表面平整,加工精度滿足細胞培養要求。
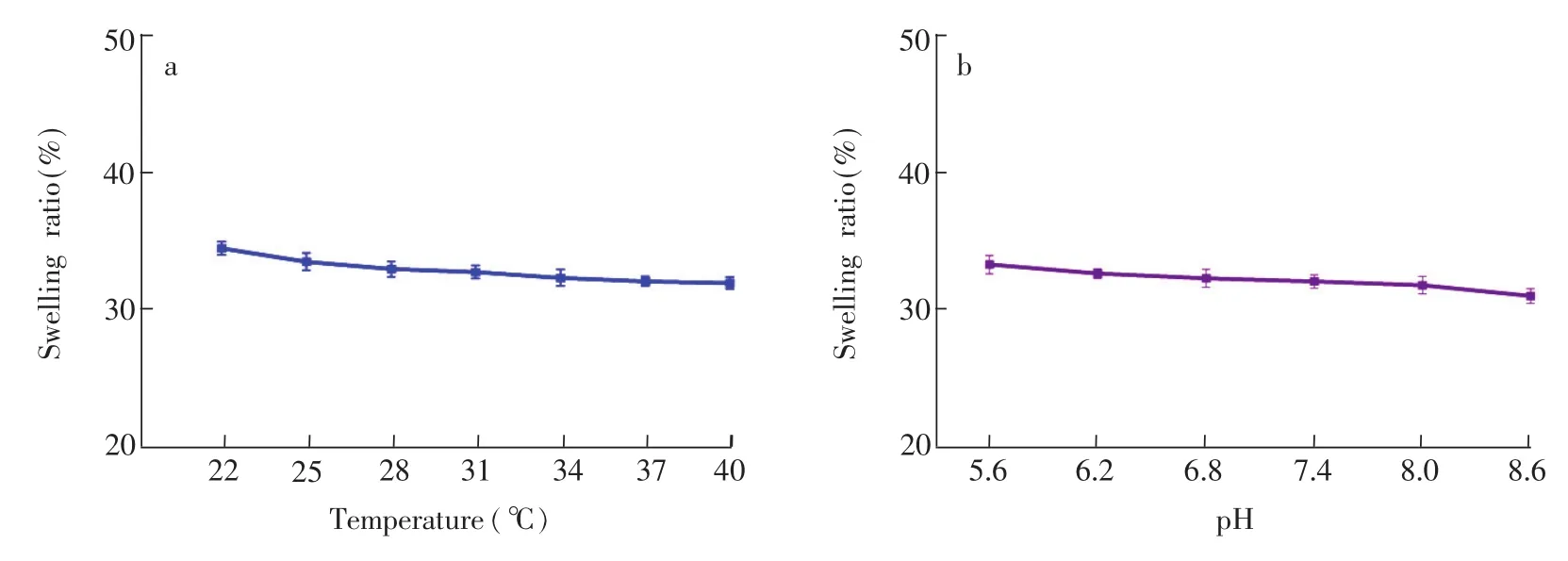
圖4 不同溫度梯度(a)及pH梯度(b)下水凝膠微流控芯片的溶脹率Fig.4 The swelling ratio of hydrogelmicrofluidic chip at different temperature(a)and pH(b)

圖5 顯微鏡下部分特征性芯片實物圖。十字交叉微孔通道結構(a),芯片彎道結構(b)Fig.5 Microscope image ofmicrofluidic chip′s characteristic structure.(a),Crossmicrochannel,(b)bend structure
3.4 細胞捕獲培養
當細胞懸液流體流經這些芯片微孔通道時,重力作用使微孔自動捕獲細胞,直至向下凹陷0.3 mm的微孔內充滿細胞混合液,通過微通道,細胞懸液繼續流向下一個微孔,多余的細胞懸液會自發的匯聚至檢測槽內被移出芯片內。孔道因其剪切力大,細胞很難附著。微孔陣列所捕獲的細胞在特定微孔中生長,便于原位細胞觀察和分析,有效地避免了流體剪切力對細胞的損傷,利于芯片細胞的平均分布和后期代謝物的表達。圖6可清晰觀察出微孔接種細胞前(a)和接種細胞后(b,c)對細胞的捕獲結果。

圖6 不同時間段顯微鏡下芯片微孔捕獲細胞培養圖,A為進樣前微孔結構顯微圖,B為進樣后細胞被捕獲孵育1 h后的顯微圖片,C為捕獲孵育后局部放大圖Fig.6 Microscope images ofmicro-well(a)before capture of cells and(b)after cell culture for 1 h in the hydrogel chip;(c)is themagnified image of(b)
3.5 代謝液檢測指紋圖譜
5種不同正常肺細胞(MRC-5,BEAS-2B,HFL1,HFL-I和IMR-90)及5種不同肺癌細胞(95C, 95D,A549,NCIH446和HCC827)的可視化指紋圖譜見圖7,肉眼可見對于不同的細胞代謝物傳感陣列表現出完全不同的特征性圖譜,且各樣本的響應程度不同。肺癌細胞與正常肺細胞圖譜響應差別很大,肺癌細胞代謝物起反應的特異性陣列點遠多于正常肺細胞,且正常肺細胞之間的指紋圖譜響應差別較小,響應點的位置也相對固定。
3.6 聚類分析
聚類分析(HCA)是對數據之間的相關程度進行分析,后進行分類的一種多元統計分析方法,可分析出實驗樣本間的相似度與差異性。平方歐氏距離越小,代謝物間差異就越小。圖8的聚類分析圖顯示了10組試樣的平行樣,在平方歐氏距離<5時,皆呈現明顯聚集現象,表明各平行樣之間差異較小且變化幅度穩定,且正常肺細胞與肺癌細胞都能進行組內聚類。尤其是在平方歐氏距離=6時,正常肺細胞全部聚類在一起,說明人正常肺細胞代謝液間差異較小。在平方歐氏距離=25時,兩大類細胞代謝液匯聚在一起,說明代謝物差異也在不斷增大。
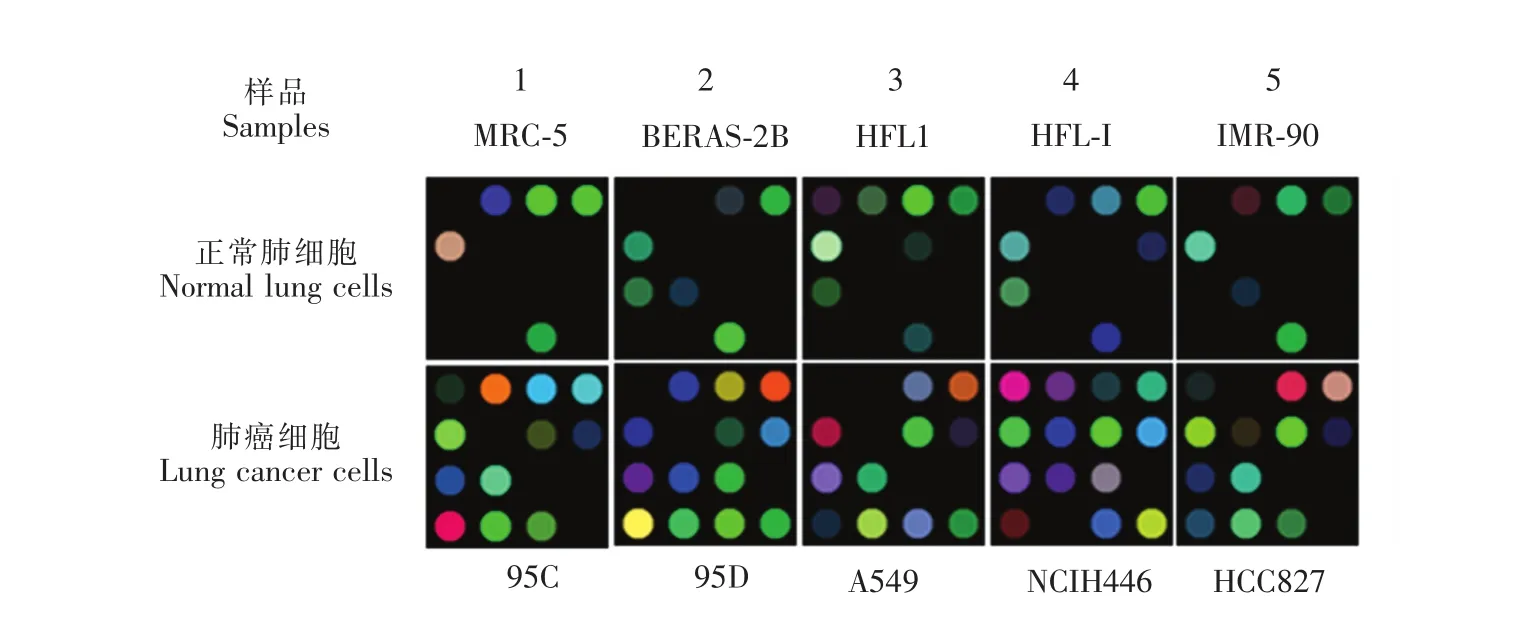
圖7 不同正常肺細胞和肺癌細胞的可視化指紋圖譜,每次實驗取3次平行樣結果Fig.7 Colorimetricmaps of pigment-based arrays for different lung cellmetabolites,and all experiments were run in triplicate
3.7 主成分分析
主成分分析(PCA)是一種分析、簡化數據集的分析手段,通過減少數據維度,保留低階主成分,忽略高階主成分,保持對方差貢獻最大的值,衡量數據的穩定度非常可靠。實驗選取16種特異性染料,取前10種累積方差貢獻較大的成分作為分析值,最主要的10維主成分包含了全部數據99.952%的信息量。如圖9所示,前兩種主成分占總信息量的78.8%。由圖10所示的二維主成分分析圖可見,在由64.6%和14.2%兩種主成分為軸的平面空間內同種細胞平行樣彼此的空間距離相距不遠,團簇狀況非常明顯,有些平行樣之間甚至發生重合現象。藍色圈內的正常肺細胞之間空間距離相聚較近,而紫色圈內的肺癌細胞在空間上距離較遠,直觀的表現出各試樣代謝物之間的差異性。肺癌細胞代謝物差異較大,是因為各個時期的癌細胞代謝物不同,尤其是人小細胞肺癌和人高轉移肺癌細胞等分裂繁殖都較快,惡化程度快,治愈難,與人肺腺癌細胞和人低轉移肺癌細胞等細胞代謝物有較大差異,其代謝物中特異性分泌物的種類和數量遠遠超過正常肺細胞和肺癌早期階段存在的肺癌細胞。由于這幾種肺癌細胞所對應的病變程度差異大,故它們代謝物之間也存在較大差異。但正常肺細胞與肺癌細胞所代表的分布區別明顯。檢測結果證明了在微孔陣列芯片上進行肺癌細胞培養及相關檢測的可行性,集成的傳感器檢測元件能夠直觀的對不同肺癌細胞代謝物進行準確區分。

圖8 5種肺癌細胞和5種正常細胞代謝物的聚類圖Fig.8 Hierarchical cluster analysis dendrogram of metabolites of 5 normal lung cells and 5 different lung cancer cells
4 結論
建立了一種精度高、加工快速、成本低廉的水凝膠芯片加工方法,設計制作出集細胞分離、捕獲、培養、觀察和檢測等功能性微結構單元于一體的微孔陣列芯片。通過溶脹率測試證明了此芯片在正常室溫和37℃體溫以及中性生理pH范圍下能保持結構的穩定性和適用性;紅外光譜表征證明了芯片各單體發生了有效的聚合反應,形成了設計所需的無毒、高親水性、生物相容性好材料特性的芯片。芯片設計盡量模擬了肺部組織結構特點,芯片上的微孔尺寸能調控細胞分布,均勻的分散細胞有利于觀察和數據的穩定性,有利于細胞真實形態及活性的表達,有效降低流體剪切力對細胞的損傷;交錯微通道實現了流體的均勻傳遞,從而減小流體剪切力。微流控芯片集成的卟啉傳感可視元件,可在芯片原位收集槽處進行收集、檢測,過程方便,快捷,迅速,且不涉及液相,液質等大型儀器的使用,費用低廉,該可視化分析系統可對肺細胞及肺癌細胞代謝液做出準確區分,結果具有穩定性和直觀性。故此基于微孔陣列的肺癌細胞培養的代謝液檢測芯片平臺為醫學研究提供了一種全新的可行性檢測方法。

圖9 前10種主成分的累計貢獻值柱狀圖Fig.9 Histogram of the cumulative variance contribution values of the first10 kinds of principal components

圖10 正常肺細胞與肺癌細胞代謝液基于前二主成分分析散點圖Fig.10 Plot of the first two principal components by principal component analysis(PCA)of metabolites of normal lung cells and lung cancer cells
1 Global Burden of Disease Cancer Collaboration.Jama Oncol.,2015,1(4):505-527
2 XU Yong-Hong,HUO Dan-Qun,FA Huan-Bao,YANG Mei,HOU Chang-Jun.Chem.J.Chinese.Universities,2015, 36(2):241-247
徐永紅,霍丹群,法煥寶,楊眉,侯長軍.高等學校化學學報,2015,36(2):241-247
3 GAO Jian,YIN Xue-Feng,FANG Zhao-Lun,XIA Fang-Quan.Chem.J.Chinese Universities,2003,24(9):1582-1584
高健,殷學鋒,方肇倫,夏方詮.高等學校化學學報,2003,24(9):1582-1584
4 FANG Zao-Lun,FANG Qun.Modern Scientific Instruments.,2001,65(4):3-6
方肇倫,方群.現代科學儀器,2001,(4):3-6
5 WEN Xiao-Xia,XU Bang-Lao,WANGWei-Xin,LIANGGuang-Tie,CHEN Bin,YANGYin-Mei,LIU Da-Yu.Chinese J.Anal.Chem.,2014,42(6):791-798
文小霞,徐邦牢,王偉鑫,梁廣鐵,陳斌,楊銀梅,劉大漁.分析化學,2014,42(6):791-798
6 Kwon S J,Lee D W,Shah D A,Ku B,Jeon S Y,Solanki K,Ryan JD,Clark D S,Dordick J S,Lee M Y.Nat.Commun.,2014,5:37-39
7 Garcia-Cordero JL,CNembrini A,Stano JA,Hubbell S J,Maerkl.Integr.Biol.,2013,5(4):650-658
8 Harink B,Le Gac S,Truckenmuller R,Van Blitterswijk C,Habibovic P,Lab Chip,2013,13(18):3512-3528
9 Han SW,Jang E J,Koh W G.Sens.Actuators,B,2015,209:242-251
10 Kim G,Moon JH,Moh C Y,Lim J.Biosens.Bioelectron.,2015,67:243-247
11 Lefevre F,Chalifour A,Yu L,Chodavarapu V,Juneau P,Izquierdo R.Lab Chip,2012,12(4):787-793
12 Zilberman Y,Sonkusale SR.Biosens.Bioelectron.,2015,67:465-471
13 Hirai Y,Takagi D,Anai S,Chihara Y,Tsuchiya T,Fujimoto K,Hirao Y,Tabata O.Sens.Actuators,B,2015,213:547-557
14 Ahmed E M.J.Adv.Res.,2015,6(2):105-121
15 Musumeci G,Loreto C,Castorina S,Imbesi R,Leonardi R,Castrogiovanni P,Italian J.Anato.Embryol.,2013, 118(2):204-210
16 Samorezov JE,Alsberg E.Adv.Drug Deliv Rev,2014,11:1-23
17 Zellander A,Zhao C,Kotecha M,Gemeinhart R,Wardlow M,Abiade J,Cho M.PloS one,2014,9(5):e96709
18 Ingavle G C,Gehrke SH.Detamore M S.Biomaterials,2014,35(11):3558-3570
19 Chen J,Chen D,Yuan T,Xie Y,Chen X.Biomicrofluidics,2013,7(3):34106
20 Fang K J,Hou C J,Huang CH,Luo X G,Zhang SY,Shen C H,Huo D Q.Key Eng.Mater.,2013,565:632-636
21 Xu B,Ye W,Zhang Y,Shi J,Chan C,Yao X,Yang M.Biosens.Bioelectron.,2014,53:187-192
22 Verhulsel M,Vignes M,Descroix S,Malaquin L,Vignjevic D M,Viovy JL.Biomaterials,2014,35(6):1816-1832
23 Schesny M K,Monaghan M,Bindermann A H,Freund D,SeifertM,Eble JA,Vogel S,GawazM P,Hinderer S.Biomaterials,2014,35(25):7180-7187
24 Billiet T,Vandenhaute M,Schelfhout J,Van Vlierberghe S,Dubruel P.Biomaterials,2012,33(26):6020-6041
25 González-Henríquez CM,Pizarro G C,Sarabia-Vallejos M A,Terraza CA,López-Caba?a Z E.Arabian J.Chem.,2014, available online
26 Browning M B,Cereceres SN,Luong PT,Cosgriff-Hernandez EM.J.Biomed.Mat.Res.,2014,102(12):4244-4251
(Received 23 April 2015;accepted 10 August2015)
This work was supported by the National Natural Science Foundation of China(Nos.81171414,81271930)and the Key Technologies R&D Program of China(No.2012BAI19B03)
Development of 3D Hydrogel M icrofluidic Chip for Lung Cancer Cells Capture and Detection
HUO Dan-Qun1,GUOMing-Yi1,DENG Yan1,YANG Mei1,FA Huan-Bao2,HOU Chang-Jun*11(College of Bioengineering,Chongqing University,Chongqing 400044,China)
2(College ofChemical Engineering,Chongqing University,Chongqing 400044,China)
Based on photopolymerization property of poly(ethylene glycol)diacrylate(PEGDA),a 3D nontoxic,hydrophilic and biocompatible hydrogelmicrofluidic chip(60 mm×20 mm×3 mm),was specifically designed and fabricated.2-Hydroxyethyl methacrylate(HEMA)was used to increase hydrophilicity of the chip,and 1-vinyl-2-pyrrolidone(NVP)was added to improve its toughness.The swelling ratio testing and the infrared spectrum characterization showed that the hydrogelmicrofluidic chip had excellent performance and stability.A colorimetric sensor array with 16 specific dyeswas integrated into the chip for real-time detection of themetabolites of lung cells.The colorimetric value of themaps was extracted for calculating the squared Euclidean distance.The results of principal componentanalysis(PCA)suggested that themetabolic liquids of different lung cells could be easily distinguished.Thirty normal lung cell and lung cancer cell samples could be accurately clustered by hierarchical cluster analysis(HCA).The fabricated hydrogel microfluidic chip provides a novelmethod for clinically diagnosing.
Microfluidic chip;Lung cancer;Metabolites detection;Visual sensor array
10.11895/j.issn.0253-3820.150333
2015-04-23收稿;2015-08-10接受
本文系國家自然科學基金(Nos.81171414,81271930)、國家科技支撐計劃項目(No.2012BAI19B03)、重慶市研究生科研創新項目(No.CYB14028)和重慶大學大型儀器設備開放基金資助
E-mail:houcj@cqu.edu.cn

