細胞外信號調節蛋白激酶1在缺氧后腦損傷中的表達模式
楊麗君 崔紅
首都醫科大學附屬北京友誼醫院兒科,北京100050
細胞外信號調節蛋白激酶1在缺氧后腦損傷中的表達模式
楊麗君 崔紅
首都醫科大學附屬北京友誼醫院兒科,北京100050
目的通過了解細胞外信號調節蛋白激酶1(ERK-1)在缺氧腦損傷大鼠腦中的表達,了解其參與缺氧腦損傷的過程。方法48只3 d齡新生SD大鼠,隨機分成2組:對照組和缺氧組,每組各24只,缺氧組SD大鼠置于自制密閉容器中,充以含8%氧氣的氧氮混合氣體,時間為90 min,對照組SD大鼠不進行處理。分別于造模后6個時間點——1、3、7、14、21 d和28 d后留取兩組SD大鼠腦組織,采用Western blot檢測ERK-1總蛋白在腦組織中的表達情況。結果缺氧組大鼠腦組織ERK-1呈現動態表達;變化規律:在缺氧早期(缺氧后1~7 d),ERK-1總蛋白的表達均有降低的趨勢,缺氧后第14天開始其表達具有升高的趨勢,缺氧后第21天和第28天ERK-1表達量又有所下降,差異無統計學意義(P>0.05)。結論缺氧造成新生大鼠腦損傷時,ERK-1總蛋白的表達譜沒有明顯變化的趨勢,提示在早產兒缺氧性腦損傷時ERK-1并不通過劑量的變化對缺氧后腦組織損傷進行調節。
早產兒;缺氧性腦損傷;細胞外調節蛋白激酶1;大鼠
早產兒的存活率和生命質量的改善是本世紀新生兒醫學重點攻克的目標之一。據WHO報道,全球每年有1500萬早產兒出生,且早產兒的發生率在逐年上升,我國人口眾多,每年出生的早產兒缺氧缺血性腦損傷的發病數目更為驚人,在早產兒中常常會發生學習困難,表現為閱讀、拼寫、計算或寫作困難。雖然近年來早產兒的預后有了很大的改善,但早產兒腦損傷所帶來的后遺癥等仍然是影響早產兒最終生命質量的嚴重問題。迄今為止,早產兒腦損傷的發病機制尚未完全明確。絲裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)是細胞內一類絲氨酸/蘇氨酸蛋白激酶,普遍存在于包括哺乳動物在內的多種生物細胞內,細胞外信號調節蛋白激酶1(extracellular signal regulated protein kinase 1,ERK-1)是所有絲裂原活化蛋白激酶家族最早被認識的成員,有文獻報道,它能夠調節細胞增殖和分化的重要細胞信號通路[1],近期有文獻報道,硫氫化鈉誘導的增殖也與ERK-1的磷酸化有關[2]。同時,ERK-1與凋亡也有比較密切的關系,有研究報道,其在腦缺血再灌注損傷發生過程發揮著重要作用[3-4]。近年來也有文獻報道,其在缺氧/復氧損傷發生過程中也發揮非常重要的作用[5]。Liu等[6]研究發現缺氧也能夠激活腎側群細胞的ERK的活性,但是在非側群細胞則不出現這種現象。近來有研究發現,在缺血性因素刺激下,ERK-1參與了血腦屏障的Na+/H+交換以及Na+-K+-Cl-共運輸的過程[7]。也有研究認為缺氧能夠在體外上調ERK-1的磷酸化[8],但是ERK-1在缺氧性腦損傷發生之后的動態表達譜尚不明確,本研究擬在缺氧發生后的多個時間點進行ERK-1的表達檢測,從而明確ERK-1在缺氧發生后的表達情況,從而更加有助于探討缺氧性腦損傷的發生、發展以及神經修復過程。
1 材料與方法
1.1 材料
實驗中用到的3 d齡SD大鼠(SPF級,雌雄不計,體重8~10 g)購自北京維通利華實驗動物技術有限公司[SCXK(京)2007-0001],充入的氮氧混合氣體(8%O2+92%N2)由首都醫科大學附屬北京友誼醫院(以下簡稱“我院”)提供,本實驗室自制封閉容器。
1.2 缺氧模型的建立
實驗所用到的3 d齡SPF級SD大鼠,日常在我院SPF級動物房飼養,條件如下,照明時間;黑暗時間=12 h∶12 h,溫度:23~25℃,濕度保持在40%。將乳鼠隨機分為兩組:對照組和缺氧組,每組各24只,對照組不做處理,缺氧組放入本實驗室自制容器,在37℃水浴中充以氮氧混合氣(O2占8%),持續時間為90 min,之后回籠,繼續行母乳喂養。
1.3 大鼠腦組織標本獲取
分別于缺氧模型建立后第1、3、7、14、21天和第28天6個時間點處死兩組大鼠,其中每個時間點對照組和缺氧組大鼠各4只,每組大鼠的左側腦組織立即放入10%的中性福爾馬林溶液固定,之后進行切片、備用,右側大腦立即放入液氮保存,用于進行Western blot檢測。
1.4 HE染色
將腦組織用10%的中性福爾馬林液中固定8 h,依次放入20%、30%蔗糖溶液分別過夜(24~48 h)沉底,組織沉底之后即可進行冰凍切片,切片厚度為12 μm,進行HE染色,參見既往發表文章[9],拍照保存。
1.5 Western blot檢測ERK-1表達量
預冷RIPA蛋白抽提試劑,加入蛋白酶抑制劑Protease inhibitor cocktail(Roche)。按組織重量9倍比例加入裂解液,冰上用組織勻漿器進行勻漿3次。冰上進行孵育20 min后,4℃15 000 r/min離心20 min,取上清,分裝深低溫冰箱保存,按照BCA蛋白定量試劑盒(cwbiotech)測定蛋白濃度。之后進行蛋白PAGE凝膠電泳,10%分離膠,5%濃縮膠(丙烯酰胺,雙丙烯酰胺,TEMED,Amresco)。電泳條件:濃縮膠恒壓90 V,約20 min;分離膠恒壓130 V,通過預染蛋白Marker(Biomed)來確定電泳停止時間。濕轉法,轉膜條件:300 mA恒流;0.45 μm孔徑PVDF膜(Millipore),轉膜時間1 h。轉膜完成后麗春紅染色試劑對膜進行染色,觀察轉膜效果。之后將膜完全浸沒TBST溶液中(含5%脫脂牛奶),室溫下搖床孵育1 h。將膜與ERK-1一抗(Santa cruz)或者β-actin一抗(Santa cruz,封閉液稀釋)一起孵育,ERK-1的一抗稀釋濃度1∶500,β-actin的一抗稀釋濃度1∶1000,4℃冰箱過夜。次日TBST洗膜3次。二抗孵育:羊抗兔IgG HRP(1∶20 000),孵育40 min(在室溫),洗膜。滴加ECL,反應3 min;曝光,顯影,定影。照相,用LabWorks軟件對圖像進行灰度分析,計算出每個樣本的ERK-1灰度值與相應的β-actin的灰度值,取其比值進行計算,并進行統計學分析。
1.6 統計學方法
采用SPSS 16.0統計學軟件進行數據分析,計量資料數據用均數±標準差(x±s)表示,兩組間比較采用t檢驗;計數資料用率表示,組間比較采用χ2檢驗,以P<0.05為差異有統計學意義。
2 結果
2.1 大鼠乳鼠缺氧后表現
缺氧后早期大鼠出現興奮癥狀的表現:躁動不安、翻滾,呼吸加深加快,45 min~1 h后逐漸出現抑制癥狀:反應遲緩淡漠、間斷發作的痙攣、抽搐等。最后進入比較穩定的反應淡漠期,此反應一直持續至缺氧完成,恢復氧供后乳鼠反應逐漸恢復正常。
2.2 HE染色結果
對照組大鼠腦組織結構清晰,海馬錐體細胞致密、完整,缺氧組大鼠海馬錐體細胞核淡染、甚至細胞核缺如,見圖1。
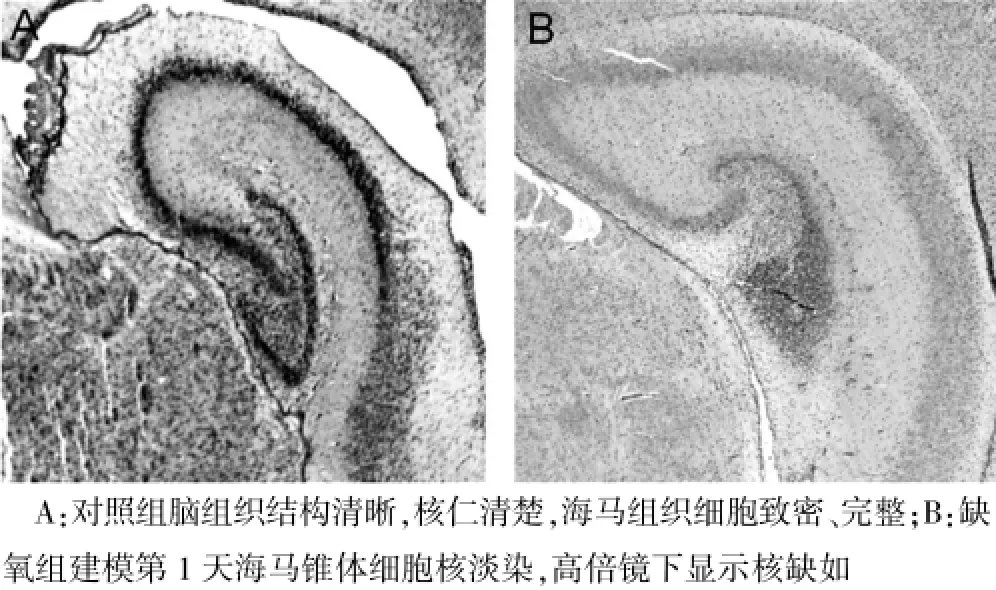
圖1 兩組大鼠腦組織病理結果(HE染色,40×)
2.3 兩組大鼠不同時間點細胞外信號調節蛋白激酶1表達情況比較
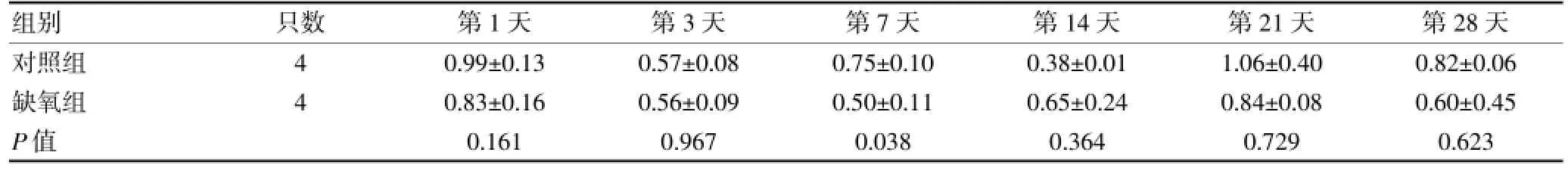
表1 兩組大鼠在6個不同時間點細胞外信號調節蛋白激酶1的表達情況比較(x±s)
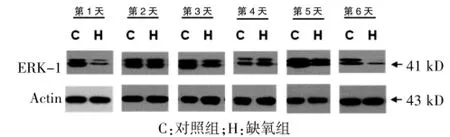
圖2 兩組不同時間點細胞外信號調節蛋白激酶1蛋白表達情況
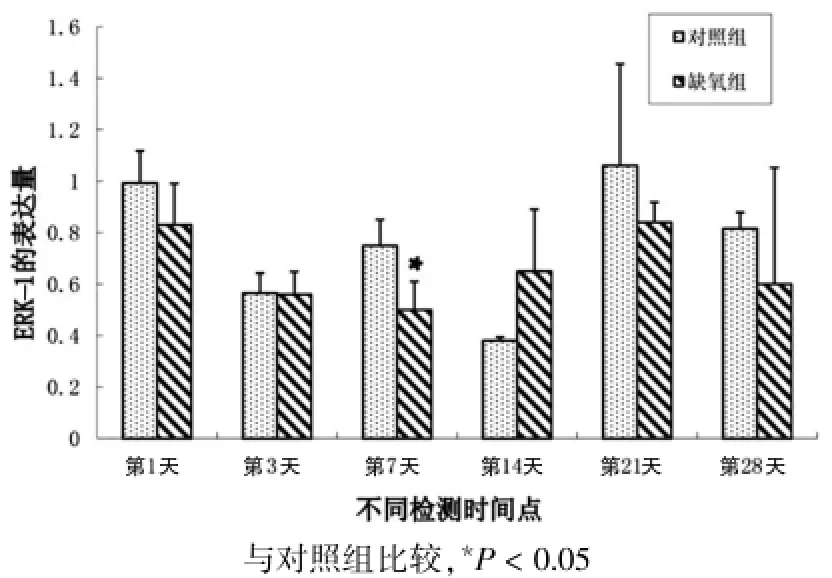
圖3 兩組大鼠缺氧處理后不同時間點細胞外信號調節蛋白激酶1蛋白表達情況
缺氧組ERK-1表達呈現動態性變化,與對照組目前仍存在很大爭議[11-13]。有文獻報道,自由基清除藥——依達拉奉可以通過激活ERK-1來減輕缺氧/復氧誘導的神經元損傷中毒[14]。Ban等[15]的研究發現抑制ERK-1能夠惡化腸缺血/再灌注損傷。缺氧發生之后ERK-1的表達模式如何尚不明確,本研究通過探討缺氧發生后ERK-1的動態表達模式來進一步明確缺氧發生過程中ERK-1的可能作用,研究發現,缺氧后腦組織ERK-1表達水平呈現動態變化,缺氧后相比,缺氧后ERK-1表達量基本處于低于正常對照的水平,但是與對照組的變化趨勢趨于一致,第14天時ERK-1的表達較對照組有所升高,到第21、28天時ERK-1的表達與對照組比較又有所降低。雖然有變化趨勢,但是經過統計學t檢驗分析,差異均無統計學意義(P>0.05),具體見表1,圖2、3。
3 討論
缺氧性腦損傷的病理發生是一個多因素的復雜過程,在此過程中,眾多分子參與其中,ERK-1蛋白在腦內廣泛存在,是腦功能活動中重要的信號轉導分子[10],ERK-1接受刺激信號后活化為磷酸化的ERK-1,從胞漿轉位至胞核,通過磷酸化轉錄因子等途徑發揮細胞調節作用。腦缺血再灌注損傷中有ERK-1廣泛參與,但其所發揮的是保護性作用還是損傷性作用,第1天開始ERK-1表達降低,一直到缺氧后第7天達到表達的最低值,之后出現表達情況的上升,缺氧后第14天時表達高于正常情況,表達情況一直持續到缺氧后第21天達到最高峰,但是低于正常情況,缺氧后第28天時表達又有所降低。根據折線圖可以看出,ERK-1在大鼠乳鼠發育過程中呈現一種動態模式的表達情況,存在一個表達高峰和一個表達低谷,提示ERK-1在細胞的正常發育過程中也發揮著重要作用,缺氧組的ERK-1的表達總體比正常情況低下,雖然經過分析差異無統計學意義(P>0.05),但是存在降低的趨勢,提示在大鼠乳鼠腦組織缺氧損傷過程中ERK-1也存在劑量的變化。需要進一步研究ERK-1基因與其他缺氧相關的基因,如缺氧誘導因子(hypoxia induced factor-1α,HIF-1α)等基因表達的相互關系,從而更加明確其參與缺氧腦損傷過程的作用機制。
[1]Ramos JW.The regulation of extracellular signal-regulated kinase(ERK)in mammalian cells[J].Biochem Cell Biol,2008,40(12):2707-2719.
[2]Liu D,Wang Z,Zhan J,et al.Hydrogen sulfide promotes proliferation and neuronal differentiation of neural stem cells and protects hypoxia-induced decrease in hippocampal neurogenesis[J].Pharmacol Biochem Behav,2014,116:55-63.
[3]Niimura M,Takagi N,Takagi K,et al.Effects of hepatocytegrowth factor on phosphorylation of extracellular signal regulated kinase and hippocampal cell death in rats with transient forebrain ischemia[J].Eur J Pharmacol,2006,535(1):114-124.
[4]Zhu Y,Yang GY,Ahlemeyer B,et al.Transforming growth factor-B1 increases bad phosphorylat ion and protects neurons against damage[J].Neuroscience,2002,22(10):3898-3909.
[5]Liu L,Liu H,Yang F,et al.Tissue kallikrein protects cortical neurons against hypoxia/reoxygenation injury via the ERK-1/2 pathway[J].Biochem Biophys Res Commun,2011,407(2):283-287.
[6]Liu WH,Liu HB,Gao DK,et al.ABCG2 protects kidney side population cells from hypoxia/reoxygenation injury through activation of the MEK/ERK pathway[J].Cell Transplant,2013,22(10):1859-1868.
[7]Yuen N,Lam TI,Wallace BK,et al.Ischemic factor-induced increases in cerebral microvascular endothelial cell Na/H exchange activity and abundance:evidence for involvement of ERK1/2 MAP kinase[J].Am J Physiol Cell Physiol,2014,306(10):C931-C942.
[8]Haddad JJ,Hanbali LB.Hypoxia upregulates MAPK(p38)/MAPK(ERK)phosphorylation in vitro:neuroimmunological differential time-dependent expression of MAPKs[J].Protein Pept Lett,2014,21(5):444-451.
[9]楊麗君,崔紅,楊愛君,等.大鼠全腦腦片培養及缺氧缺糖模型的建立[J].實驗動物與比較醫學雜志,2009,29(5):283-285.
[10]Thomas KL,Hunt SP.The regional distribution of extracellularly regulated kinase-1 and-2 messenger RNA in the adult rat central nervous system[J].Neuroscience,1993,56(3):741-757.
[11]Arany I,Megyesi JK,Kaneto H,et al.Cisplatin-induced cell death is EGFR/src/ERK signaling dependent in mouse proximal tubule cells[J].Am J Physiol,2004,287(3):F543-F549.
[12]Henriksson M,Stenman E,Vikman P,et al.MEK I/2 inhibition attenuates vascular ETA and ETB receptor alterations after cerebral ischemia[J].Exp B rain Res,2007,178(4):470-476.
[13]Lu K,Cho CL,Liang CL,et al.Inhibition of the MEK/ ERK pathway reduces microglial activation and interleukin-1-beta expression in spinal cord ischemia/reperfusion injury in rats[J].J Thorac Card iovasc Surq,2007,133(4):934-941.
[14]Wang G,Su J,Li L,et al.Edaravone alleviates hypoxiaacidosis/reoxygenation-induced neuronal injury by activating ERK1/2[J].Neurosci Lett,2013,543:72-77.
[15]Ban K,Peng Z,Kozar RA.Inhibition of ERK1/2 worsens intestinal ischemia/reperfusion injury[J].PLoS One,2013,8(9):e76790.
Expression profile of extracellular signal regulated kinase 1 of rat pups in response to hypoxia challenge
YANG LijunCUI Hong
Department of Pediatrics,the Affiliated Beijing Friendship Hospital of Capital Medical University,Beijing100050, China
ObjectiveTo understand the process of extracellular signal regulated protein kinase 1(ERK-1)involved in hypoxic brain injury through the understanding of its expression in hypoxic brain injury in rat brain.Methods48 3-day SD rats were randomly divided into two groups:control group and hypoxia group,24 rats in each group.Rats of hypoxia group were treated with mixed gas which included O2(8%)and N2for 90 minutes,and rat pups of the control group were treated with no treatment.Brain tissues of both groups were obtained at the 1st,3rd,7th,14th,21st day and the 28th day after hypoxia insult.Western blot was used to detect the expression of ERK-1 in brain tissues.ResultsThere were dynamic changes of ERK-1 in brain tissue of rats after hypoxia.It showed decreased expression of total protein of ERK-1 at 1-7 days after hypoxia,and on the 14th day of hypoxia,there seemed to exist a rising trend in the expression of ERK-1.And the expression of ERK-1 decreased again on the 21st and 28th day,with no significant difference (P>0.05).ConclusionWhen hypoxia happened,there is no significant change in the expression profile of ERK-1 protein,suggesting that ERK-1 may not affect brain tissue by dose regulation after hypoxia insult.
Preterm infant;Hypoxia brain injury;Extracellular-signal regulated kinase 1;Rat
R72
A
1673-7210(2015)02(a)-0008-04
2014-10-15本文編輯:任念)
國家自然科學基金項目(編號81370741);北京市自然科學基金項目(編號7122045);基礎臨床科研合作基金與李桓英醫學基金會聯合資助課題(編號11JL-L03)。
崔紅(1961.5-),女,主任醫師,教授;研究方向:早產兒腦損傷。

