碳源對出芽短梗霉發酵生產普魯蘭多糖的影響
劉 鑫,周文紅,韋 海,劉慧霞
(廣西大學輕工與食品工程學院,廣西南寧530004)
0 前言
普魯蘭多糖(Pullulan)是由多形態的真菌出芽短梗霉(Aureobasidium pullulans)利用蔗糖等作為碳源物質發酵產生的一種線性胞外多糖[1],它是由麥芽三糖通過α-1,6糖苷鍵連接而成的高分子多聚糖[2]。普魯蘭多糖無色無味,無毒無害,對人體無任何副作用,呈粉末狀,溶于水時散發出微微的甜味[3]。它含有豐富的羥基,極易溶于水,不溶于油脂、醇類、丙酮、醚和氯仿等有機溶劑[4],并具有極佳的成膜性、氧氣不滲透性、耐熱性、耐酸堿性、成纖維性、粘結性、可塑性和易自然降解性等許多獨特的物理化學和生物化學特性[5],可以廣泛地應用于醫藥制造行業、食品工業、煙草工業、化妝品工業、農業和污水處理等多種領域[6],是一種具有極大經濟利用價值和巨大開發潛力的多功能新型生物產品[7]。
廣西是中國的產糖大省,擁有豐富的用于微生物發酵的碳源,其中作為加工精糖的原料原糖,是石灰法糖廠的特有產品[8]。目前,國內外利用原糖進行普魯蘭多糖的發酵還未見相關報道。本實驗主要初步探討原糖、白砂糖、葡萄糖、淀粉等不同碳源作為底物對出芽短梗霉As.40239進行發酵合成并提取普魯蘭多糖,并進行了原糖發酵培養基的優化。
1 實驗材料
1.1 菌種和原料
出芽短梗霉(Aureobasidium pullulans 40329):工業微生物湖北省重點實驗室保藏菌株;實驗所用的原糖采自廣西某精煉糖廠,白砂糖采自某亞硫酸法糖廠。
1.2 培養基和培養條件
1.2.1 培養基
斜面培養基(g/L):蔗糖30,磷酸氫二鉀5,氯化鈉1,硫酸鎂0.2,硫酸銨0.6,酵母膏2.5,瓊脂20,氯霉素1,pH自然條件;種子培養基(g/L):磷酸氫二鉀6,磷酸二氫鉀2,硝酸鈉1.54,氯化鈉2,七水硫酸鎂0.04,四水氯化錳0.006,六水氯化鐵0.002,鹽酸硫胺素0.004,葡萄糖30,酵母膏1,pH自然條件;發酵培養基(g/L):磷酸氫二鉀6.5,硫酸銨0.4,氯化鈉1,硫酸鎂 0.1,酵母膏2.5,蔗糖50,搖瓶條件下初始pH為5.8。
1.2.2 培養條件
斜面培養:將保藏的斜面菌種接種至斜面培養基上,28℃條件下培養48 h,用于菌種活化;種子液培養:將活化的斜面菌種接入到裝有40 mL發酵液的250 mL三角瓶中,28℃、200 r/min搖瓶培養48 h;發酵培養:采用搖瓶發酵培養方式,將種子培養液按照2%(v/v)的接種量接入到裝有50 mL發酵液的250 mL三角瓶中,28℃、200 r/min搖瓶發酵培養96 h。
2 實驗方法
2.1 出芽短梗霉發酵
根據廣西制糖產業特色,選取精煉糖廠生產的原糖和亞硫酸法糖廠生產的白砂糖作為發酵底物碳源,另選擇葡萄糖和淀粉作為對比發酵的碳源,底物碳源采用5%反應量。將保存的出芽短梗霉菌種斜面活化,28℃下培養48 h,此時菌種處于對數生長期;隨后按照2%的接種量接入250 mL(裝液量40 mL)的液體種子培養基中,28℃,200 r/min,搖瓶發酵96 h。
2.2 普魯蘭多糖的提取
首先將搖瓶發酵96 h的發酵液4000 r/min下離心15 min,取離心后的上清液20 mL,加入2倍體積酒精,放置冰箱中 4℃過夜,使普魯蘭多糖盡可能全部析出于酒精中[9];然后用玻璃棒將充分析出的普魯蘭多糖挑出,殘留的普魯蘭多糖在4000 r/min下離心15 min后一并移出;最后將普魯蘭多糖置于真空干燥箱中低溫干燥,防止普魯蘭多糖高溫干燥過程中氧化變色,干燥后的普魯蘭多糖進行稱量。
2.3 普魯蘭多糖的純化
上述方法提取的為普魯蘭粗多糖,其中普魯蘭多糖的含量大約95%以上。粗普魯蘭多糖中存在一些雜質,例如蛋白質、菌體等[10],因此要進一步提純。
普魯蘭多糖提純[11]過程:首先進行熱處理,將發酵液4000 r/min離心15 min,取上清液,用碳酸氫鈉溶液調節pH值到中性,80℃下水浴20 min后再次離心;然后向熱處理后的上清液中加入0.6%的活性炭脫色,200 r/min振蕩20 min,脫色后4000 r/min離心15 min,除去活性炭;接著用 2倍體積的有機溶劑丙酮沉淀多糖,放置冰箱中 4℃過夜,使普魯蘭多糖盡可能全部析出;析出后的多糖再用95%乙醇洗滌多糖2次后離心;最后將普魯蘭多糖置于真空干燥箱中低溫干燥,干燥后的普魯蘭多糖粉碎即可獲得較純的普魯蘭多糖粉末。
2.4 發酵后期各糖分的測定
2.4.1 總糖的測定
硫酸-苯酚法[12]測定總糖含量:在濃硫酸的作用下,多糖能夠水解成單糖,并通過脫水反應生成糖醛衍生物,其與苯酚反應生成顏色穩定的橙黃色化合物,在分光光度計波長490 nm處,一定濃度范圍內,吸光度和糖的含量呈線性關系,利用葡萄糖標準曲線及其測定的吸光度值,即可計算出總糖的含量;
葡萄糖標準曲線的繪制需要配制100 μg/mL的葡萄糖標準溶液、6%苯酚溶液。
按照表1加入相應的葡萄糖溶液、蒸餾水,以及6%苯酚1 mL、濃硫酸1 mL,搖勻振蕩充分后靜置20 min,490 nm處測定吸光度,繪制葡萄糖標準曲線如圖1所示。

表1 標準曲線制定
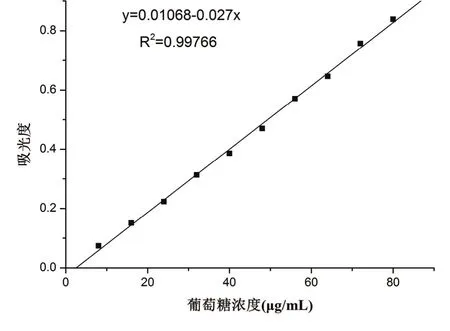
圖1 葡萄糖標準曲線
取發酵液1 mL,加入蒸餾水稀釋100倍。取稀釋液1 mL于試管中,加入蒸餾水1 mL,6%苯酚溶液1 mL,濃硫酸5 mL,搖勻振蕩充分后靜置20 min,490 nm處測定吸光度,根據葡萄糖標準曲線換算出總糖量。
總糖含量:
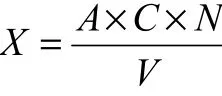
其中:X為發酵液總糖含量(g/L);A為標準曲線計算出樣品總糖含量(g/L);C為發酵液總體積(mL);N為稀釋倍數;V為測定時發酵液體積(mL)。本實驗中:N=1000,V=1 mL,C=1 mL,A=x/1000。
2.4.2 殘糖的測定[13]
發酵后培養基中殘糖量=總糖量-多糖量
2.4.3 菌體消耗糖的量[13]
菌體發酵過程中,糖分參與代謝并提供發酵所需的能量。
菌體消耗糖的量=碳源量-總糖量
2.4.4 多糖轉化率[13]
3 結果與分析
3.1 不同底物碳源對普魯蘭多糖產量的影響
采用原糖、白砂糖、葡萄糖、淀粉作為發酵底物碳源,經過發酵提取多糖后稱取多糖產量(每升發酵液產普魯蘭多糖的克數)和產物照片如圖2所示。
由圖2分析可知,在4種碳源添加量相同的情況下,原糖發酵生產的普魯蘭多糖產量要比蔗糖、葡萄糖和淀粉高出16%~53%,且原糖發酵合成普魯蘭多糖的過程中黑色素產生最少,多糖顏色較淺。分析原因應該從糖代謝角度進行,普魯蘭前體起源于尿苷二磷酸葡萄糖,而且在其生物合成的過程中,有3種關鍵性的代謝酶:α-磷酸葡萄糖變位酶、尿苷二磷酸葡萄糖焦磷酸化酶、葡萄糖基轉移酶[14],有些二價金屬元素又可以作為這幾種關鍵酶的激活劑,原糖中含有少量多酚類物質、還原糖、糖蜜、金屬元素形成的膠體物質等[8],原糖中含有的雜質以及二價金屬元素可能對菌種細胞中糖代謝關鍵酶的調控具有激活劑的作用,對菌種發酵后期黑色素產生也具有抑制作用。
淀粉發酵生產普魯蘭多糖產量最低,僅5.38 g/L,在發酵后期,搖瓶底部還殘留大量未參與反應的淀粉。分析原因可能是由于淀粉在參與出芽短梗霉代謝過程中,要先水解成小分子糖類,然后才能進入糖代謝過程,致使發酵過程緩慢,從而使得普魯蘭產量偏低。在發酵結束后,由于發酵液中殘留的淀粉,使得普魯蘭多糖分離困難,提純難度大。
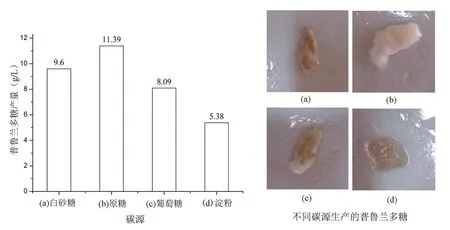
圖2 不同碳源對普魯蘭多糖產量的影響
3.2 發酵培養基的優化
影響普魯蘭多糖的產量的主要培養基成分有 3種,分別是磷酸氫二鉀、硫酸銨、酵母膏。現采用原糖作為碳源,通過正交試驗進行優化,確定最優發酵培養基配方。正交試驗因素水平如表2所示,正交試驗結果如表3和表4所示。
采用IBM SPSS Statistics軟件對表3和表4的正交試驗結果進行方差分析,結果如表5所示。可以看出,如果P<0.05,則為差異顯著。
再通過F檢驗分析判斷,給定顯著水平α=2.5%,查得F0.025(2,8)=6.06。對比F值,可以看出A不顯著,B、C極顯著。總之,通過方差分析得出,硫酸銨和酵母膏對多糖產量的影響極為顯著。說明氮源在提高多糖產量中具有重要的作用。
3.3 發酵液中各糖分的測定及分析
采用硫酸-苯酚法測定上述正交試驗中總糖含量,進一步計算出殘糖含量以及菌體發酵過程中參與代謝和維持能力所消耗的糖含量。最終計算結果見表6。

表2 正交試驗因素水平表
表3 正交試驗結果
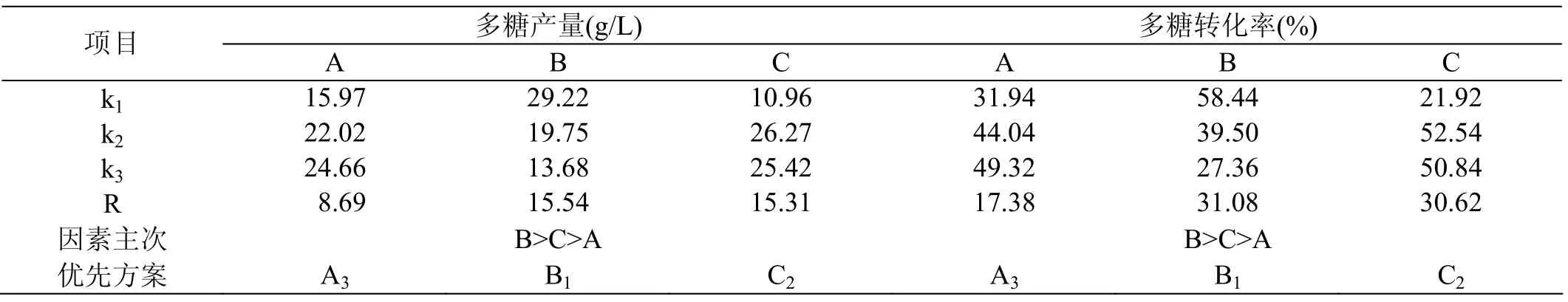
表4 試驗分析表
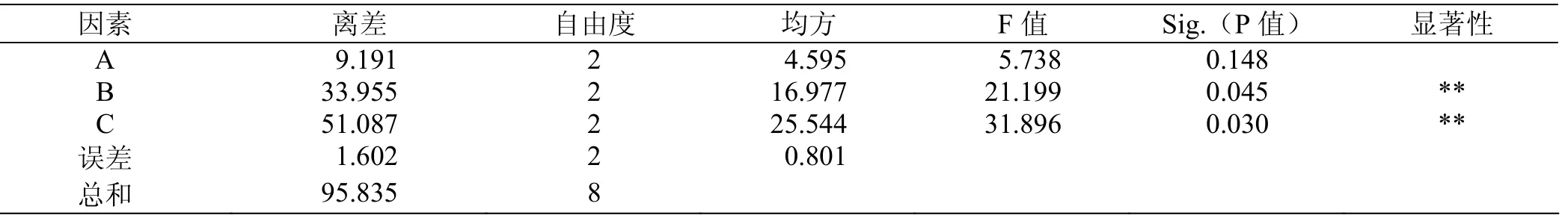
表5 各因素對多糖產量影響的方差分析表
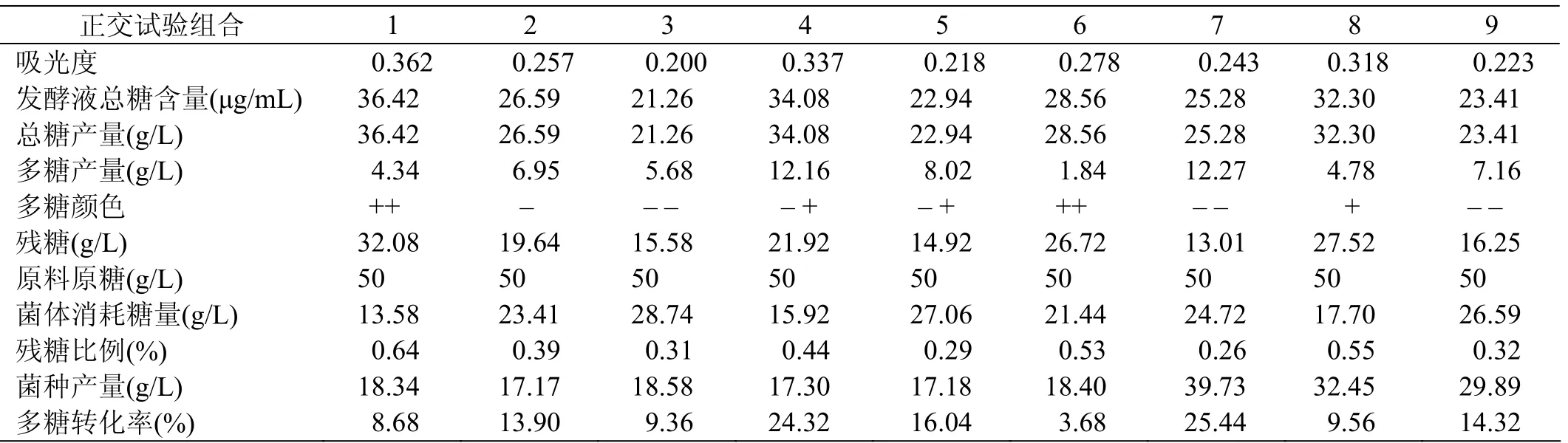
表6 普魯蘭多糖各項數據值
從表6以及正交實驗表3和表4可以看到,9組正交試驗的不同發酵條件的組合,除了第4組和第7組外,其他各組當菌種產量增加的同時,菌種消耗量也增加了。不僅抑制了多糖的轉化,同時菌種的代謝也會消耗多糖。只有第4組和第7組多糖產量相比其它各組要高一些,分別為12.16 g/L和12.27 g/L。通過第4組和第7組培養基對比可知,第7組殘糖量最低,為13.01 g/L,印證了第7組菌體代謝消耗糖的量較高,且菌種產量遠高于第4組。比較2組可知,第7組培養基的組合更利于菌體生長,說明磷酸二氫鉀和酵母膏含量高不僅有利于多糖生長,同時有利于菌體生長。在第4組和第7組產多糖差不多的條件下,優選第4組培養基配方。
根據各實驗組多糖顏色的比較,可以認為有機氮源酵母膏的含量對多糖顏色深淺影響較大。有機氮源添加量少,出芽短梗霉發酵后期產生色素多;反之,發酵后期產生色素少。尤其是第1、6、7組的結果更加印證了此結論。總之,酵母膏添加量不能太少也不宜過高,過高時有利于菌體的生長,卻導致多糖產量的降低;酵母膏添加量也不易過低,過低導致黑色素產生過多。綜上分析的結論與正交試驗得出的最優組合方案相一致。
驗證試驗:在正交試驗最佳組合 A3B1C2下進行發酵,做了3組平行實驗,發酵結果如表7所示:

表7 驗證試驗
4 結語
選擇原糖作為碳源發酵生產普魯蘭多糖可以節約經濟成本,發酵產生的普魯蘭多糖產量也相比其它碳源要高出16%~53%,同時原糖可以抑制菌體發酵后期黑色素的產生,使得產物普魯蘭多糖的色澤更白,更有利于普魯蘭多糖后期的提純。通過對發酵培養基成分磷酸二氫鉀、有機氮源酵母膏以及無機氮源硫酸銨進行正交優化,確定出最適發酵培養基配方,在最適培養基的條件下,發酵生成的普魯蘭多糖產量可以達到12.39 g/L,多糖轉化率可以達到26.65%。
在國內,普魯蘭多糖的開發與應用還處于實驗室研究階段,相比國外尤其是日本大規模的生產和壟斷還有較大的差距,使得普魯蘭多糖的市場價格在 150元/kg[15]。而普魯蘭多糖獨特的性質以及在食品、醫藥、日用化工、建材、環保等眾多領域上的應用,使其開發和生產的價值更具有較大的前景[16]。廣西作為中國的產糖大省,具有豐富的發酵普魯蘭多糖的原料,開發新型多功能普魯蘭多糖的產業鏈,對廣西制糖產業經濟轉型具有一定的指導意義。
[1] CATLEY B J, RAMSAY A, SERVIS C. Observations on the structure of the fungal extracellular polysaccharide,pullulan [J]. Carbohydrate Research, 1986(153): 79-86.
[2] SINGH R S, SAINI G K, KENNEDY J F. Pullulan:Microbial sources, production and applications[J].Carbohydrate Polymers, 2008, 73(4): 515-531.
[3] 曹飛,任俊,陳福生. 茁霉多糖在食品工業中的應用研究進展[J]. 中國食品與營養,2009(5):31-33.
[4] KUMAR A S, MODY J B. Bacteria exopolysaccharides a perception[J]. Basic Microbiol, 2008(47): 103-117.
[5] 馬霞,關鳳梅,王瑞明. 新型高分子材料——普魯蘭多糖[J]. 中國釀造,2005(2):9-11.
[6] RAJEEVA G, RANJAN S, MONIKA G, et al.Aureobasidium pullulans, an economically important polymorphic yeast with special reference to pullulan[J].African Journal of Biotechnology, 2010, 9(47):7989-7997.
[7] CHENG K C, DEMIRCI A, CATCHMARK J M..Pullulan: biosynthesis, production, and applications[J].Appl Microbiol Biotechnol, 2011(92): 29-44.
[8] 何鳳儀. 原糖的質量與加工[J]. 甘蔗糖業,2007(2):37-44.
[9] HEALD P J, KRISTIANSEN B. Synthesis of polysaccharide by yeast-like forms of Aureobasidium pullulans [J]. Biotechnology and Bioengineering, 1985,27: 1516-1519.
[10] RAM S S, GAGANPREET K S, JOHN F K. Pullulan:Microbial sources, production and applications [J].Carbohydrate Polymers, 2008(73): 515-531.
[11] 焦莎莎,付湘晉,童群義. 短梗霉多糖發酵液后處理工藝研究[J]. 食品與生物技術學報,2007,7(4):93-96.[12] 楊勇杰,姜瑞芝,陳英紅,等. 苯酚-硫酸法測定雜多糖含量的研究[J]. 中成藥,2005,6(6):706-708.
[13] 馮印,蘇安祥,王玉華. 復合誘變選育茁霉多糖高產菌株[J]. 中國釀造,2011,30(8):84-86.
[14] DUAN X H, CHI Z M, WANG L, et al. Influence of different sugars of pullulan production and activities of α-phosphogucose mutase, UDPG-pyrophosphorylase and glucosyltransferase involved in pullulan synthesis in Aureobasidium pullulans Y68[J]. Carbohydrate Polymers,2008(73): 587-593.
[15] 安超,常帆,馬賽箭,等. 出芽短梗霉發酵生產普魯蘭多糖研究進展[J]. 陜西農業科學,2012(3):121-124.
[16] REKHA M R, SHARMA C P. Pullulan as a promising biomaterial for biomedical applications: a perspective [J].Trends in Biomaterials Artificial Organs, 2007(20):116-121.

