XpertMTB/RIF實驗在結核病診斷中的應用
劉慧梅 顏學兵
1.徐州醫學院臨床醫學系,江蘇徐州 221000;2.江蘇省徐州市傳染病醫院結核科,江蘇徐州 221000;3.徐州醫學院附屬醫院感染科,江蘇徐州 221000
結核病的有效控制關鍵在于對結核患者的快速檢測及治療。 傳統的實驗室診斷方法存在諸多不足,如抗酸菌涂片鏡檢方法操作簡便、快速、特異、經濟,但靈敏性較低[1-2];固體培養法價格較低廉,敏感性較涂片鏡檢法高,但耗時達數周;液體培養法雖然可以提高敏感度、縮短報告時間,但經濟成本非常高[3-4]。因此尋找一種可以快速診斷結核病的實驗室方法顯得非常重要[5]。近年來,利福平耐藥實時熒光定量核酸擴增技術(Xpert MTB/RIF)實驗逐漸受到國內外廣泛關注。 該檢測方法國內臨床應用剛剛起步,缺乏對其診斷性能的報道。 本研究旨在對Xpert MTB/RIF 實驗與T-spot 實驗等檢測方法在結核病診斷中的臨床價值進行對比研究。
1 資料與方法
1.1 一般資料
收集2014 年10 月~2015 年5 月徐州市傳染病醫院結核科收治的237 例患者,分為結核組和非結核組,分別為195 例和42 例,診斷均符合中華結核病診治指南診斷標準。 結核組包括: 肺結核組160 例,男77 例,女83 例,年齡5~78 歲;肺外結核組35 例,男22 例,女13 例,年齡3~72 歲,主要包括結核性腹膜炎10 例、結核性腦膜炎3 例、骨結核3 例、淋巴結核6 例、腸結核7 例、腎結核3 例、女性生殖系統結核3 例。 非結核組42 例,主要是肺炎、肺癌等患者,男26 例,女16 例,年齡22~83 歲。
1.2 方法
囑咐患者清晨嗽口后用力咳出深部濃痰,一式3 份,一份用于結核分枝桿菌(MTB)培養,一份用于痰涂片檢查,一份用于XpertMTB/RIF 檢測。標本收集的注意事項:①痰液標本收集以清晨為最佳,因為該時間段患者痰量多,含菌量多;②在醫生或護士指導下取樣,不得私自取樣;③囑咐患者漱口3 遍以上,以除去淺表固有細菌。 如果患者昏迷或無力咳嗽,不宜收集樣本,醫護人員應該協助患者采取合適體位,叩背以使痰液松動,再用吸痰器吸引,在吸痰器吸管中段搜集痰液,按吸痰法將痰液吸入集痰器內。
1.3 結核感染T 細胞斑點(T-spot)、液體培養、Xpert MTB/RIF 及藥敏實驗
T-spot 實驗:采集肝素抗凝外周血5 mL,分離外周單個核細胞(PBMC)放入包被γ-INF 抗體的微孔板,加入結核特異性抗原早期分泌靶向抗原(early se creting antigen target 6,ESAT-6)和培養濾過蛋白(culture filtrate protein 10,CFP-10)作為刺激原,溫箱培養24 h 后,洗去抗原致敏效應T 淋巴細胞,加入生物素標記的二抗,再經酶聯顯色,在細胞因子分泌的地方形成斑點,通過記錄斑點讀數檢測結核特異抗原致敏效應T 淋巴細胞數量。 結果判定:當空白對照孔內斑點數為0~5 個時,任一實驗孔斑點數減去空白孔斑點數≥6 個,結果為陽性;如果空白對照孔斑點數>6 個時, 任一實驗孔斑點數≥空白孔斑點數的2 倍,結果同樣表明陽性結果;如果上述標準不符合且陽性質控對照孔正常時,檢測結果為陰性。
液體培養及藥敏試驗:在Ⅱ級生物安全操作柜中接種環刮取菌落,涂抹至羅氏培養基斜面,旋緊螺旋蓋,在渦旋振蕩器上振蕩10~20 s,制成均勻的菌液。靜置10 min 后,用吸管接種約0.1 mL 至中性羅氏培養及斜面上。 傳代后的培養基放置在36℃培養,每周觀察菌落生長情況,于肉眼可見菌落出現后1~2 周進行藥敏試驗。 制備菌液:在磨菌瓶中加入1~2 滴10%吐溫-80℃水溶液,用無菌吸管尖端刮取2~3 周新鮮菌落,置于磨菌瓶中。旋緊瓶蓋,在渦旋振蕩器上振蕩10~20 s。 靜置5 min,小心打開瓶蓋,加入約2 mL 滅菌生理鹽水,靜置片刻,使菌液中的大塊物質沉淀。用無菌吸管吸取上部的菌液,約1 mL,轉移到另一無菌試管中,與標準買時比濁管比濁。 逐漸滴加滅菌生理鹽水,直至菌液濁與標準麥氏比濁管一致,即得到1 mg/mL的菌液。 接種:在無菌帶有螺旋蓋的試管中以無菌手法加入2mL 滅菌生理鹽水備用,每株待測菌準備2 管。菌液靜置,帶顆粒或菌塊沉淀。 用22 SWG 標準接種環2 滿環1 mg/mL 的菌液,平移至2 mL 滅菌生理鹽水中,即稀釋成1×10-2mg/mL 菌液。 用同樣方法再進行100 倍稀釋,即成1×10-4mg/mL 菌液。 用22 SWG標準接種環分別取1 滿環1×10-2mg/mL 和1×10-4mg/mL的菌液,用劃線法均勻接種菌量為1×10-4mg 和1×10-6mg。接種后的培養基直立放置于恒溫培養內,36℃培養,培養4 周后報告結果。
標本符合以下特點可直接用于藥敏試驗:①出現肉眼可見菌落后1~2 周的新鮮菌落;②沒有其他污染菌共存;③涂片確認為抗酸菌。
Xpert MTB/RIF 實驗:以1:2 的比例,往痰液標本中加入處理液,在渦旋振蕩器上渦旋振蕩15~30 s,室溫靜置15 min,使痰標本充分液化。 再將混合液轉移至反應盒中,將反應試劑盒放入Gene Xpert 儀器(美國Cepheid 公司生產)中,按說明書進行檢測,約2 h即可讀取結果。 結果判斷: 依照探針的循環閾值(Ct值),當內對照探針Ct 值≤38 時為陽性,反之則為無效, 提示標本的DNA 提取不合格或含有PCR 抑制物。 5 個探針中至少2 個探針Ct 值≤38 即為檢測到MTB,可進一步按照Ct 值對MTB 進行半定量。Ct 值<16 為高含量,Ct 值為16~22 為中等含量,Ct 值為22~28 為低含量,Ct 值>28 為極低含量。 檢測利福平耐藥的基礎在于MTB 特異性分子信標早期Ct 值和晚期Ct 值之差。 即△Ct 值。 系統設置的結果判斷標準為△Ct>3.5 提示對利福平耐藥,△Ct<3.5 提示對利福平敏感。由于終止循環數為38 個循環,因此當早期探針Ct 值>34.5 或晚期探針Ct 值>38 時,利福平耐藥結果為不確定。 目前研究表明95%的利福平耐藥菌株在rpoB 基因81 bp 區域(RRDR)存在基因突變。
1.4 結果判定
1.4.1 痰涂片結果判定 按照中國防癆協會基礎專業委員會制訂的實驗室檢查規程進行[6-7]。①抗酸桿菌陰性(-):連續觀察300 個不同視野,未發現抗酸桿菌。②報告抗酸桿菌菌素:1~8 條/300 個視野。③抗酸桿菌陽性(+):每100 個視野發現3~9 條抗酸桿菌。④抗酸桿菌陽性(++):每10 個視野發現1~9 條抗酸桿菌。⑤抗酸桿菌陽性(+++):每個視野發現1~9 條抗酸桿菌。 ⑥抗酸桿菌陽性(++++):每個視野發現平均10 條抗酸桿菌。
1.4.2 藥敏結果判定 (-):無菌落生長;報告實際菌落數:<50 個菌落;(+):50~100 個菌落;(++):100~200 個菌落;(+++):大部分融合(200~500 個菌落);(++++):融合(>500 個菌落)。
1.5 統計學方法
采用SPSS 18.0 統計學軟件進行數據分析,計數資料用率表示,組間比較采用χ2檢驗或Fisher 確切概率法。 Kappa>0.4,表示兩種實驗檢驗一致性結果較好;Kappa<0.4,表示檢驗結果一致性較差。以P <0.05為差異有統計學意義。
2 結果
2.1 Xpert MTB/RIF 實驗與其他結核檢測方法的結果比較
結核組患者Xpert MTB/RIF 實驗檢測敏感性顯著高于液體培養(χ2=36.691,P = 0.000)和痰涂片(χ2=6.934,P = 0.008),與T-spot 比較差異無統計學意義(χ2=0.347,P=0.541)。非結核組4 種方法特異性均較高且差異無統計學意義(χ2=0.346、0.346、1.012,P=0.557、0.557、0.314)。基于入組情況將患者分為肺結核、肺外結核進行分析,4 種檢測方法均表明肺結核組結核分枝桿菌檢測敏感性(Xpert MTB/RIF、T-spot 痰涂片、液體培養)明顯高于肺外結核組(χ2=8.915、5.880、7.142、7.457,P = 0.003、0.015、0.008、0.006)。 見表1。
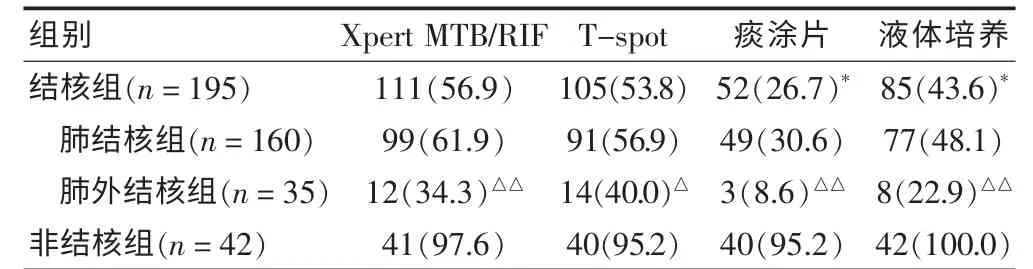
表1 結核敏感性及非結核特異性比較[n(%)]
2.2 Xpert MTB/RIF 實驗與其他幾種檢測結果一致性的比較
Xpert MTB/RIF 實驗與T-spot 實驗檢出結果符合率為86.9%,一致性Kappa=0.737,一致性結果較好;Xpert MTB/RIF 實驗與痰涂片檢出結果符合率為61.2%,一致性Kappa=0.200,一致性結果較差;Xpert MTB/RIF 實驗與液體培養檢測結果符合率為78.5%,一致性Kappa=0.563,一致性結果較好。 見表2。
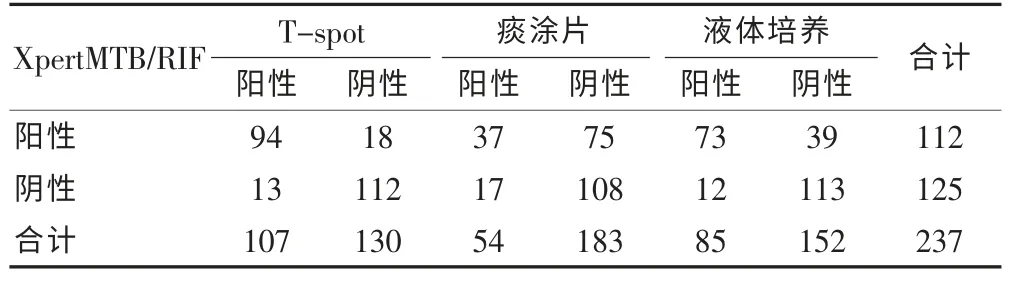
表2 Xpert MTB/RIF 實驗與痰涂片和液體培養檢測結果一致性的比較(例,n=237)
2.3 利福平耐藥檢測結果
在237 例可疑結核患者中,液體培養陽性有85 例,9 例Xpert MTB/RIF 實驗檢測失敗,共76 例可進行利福平耐藥檢測效能分析。傳統比例法藥敏實驗檢測出耐藥菌9 株,耐藥率為11.8%(9/76)。比例法耐藥的的患者標本中,XpertX 系統檢測出8 株為耐藥菌,敏感性為88.9%,比例法藥敏實驗檢測敏感菌67 例中,有1 例Xpert 系統檢測出為耐藥菌,特異性為98.5%(66/67)。 見表3。
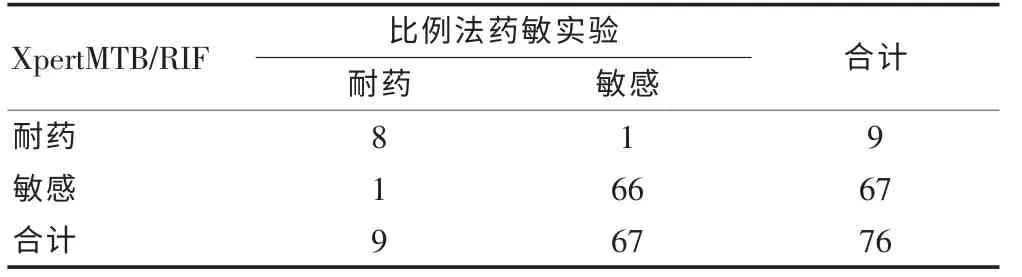
表3 利福平耐藥檢測結果(例,n=76)
3 討論
我國是世界上22 個結核病高負擔國家之一,結核病患者數量約500 萬例,居世界第二位,每年新增患者130 萬,死亡病例約13 萬例[8-11]。《2011 年中國衛生統計年鑒》資料顯示,在甲乙類法定報告傳染病中,我國現階段結核病發病率為74.27/10 萬,僅次于病毒性肝炎,位居第二,其死亡率為0.22/10 萬,僅次于艾滋病,亦位居第二,而且發病人群以青壯年為主[12]。 結核病的疫情控制與結核病的早期發現、合理規范治療、管理密切相關。 盡管結核病的診斷水平有了很大提高,但傳統的結核病診斷方法依舊存在很多不足之處,嚴重影響結核病的診斷工作開展。 Xpert MTB/RIF實驗是針對結核分枝桿菌rpoB 基因利福平耐藥決定區設計引物、探針,檢測其是否發生突變[13-14],2 h 內即可診斷患者是否感染結核分枝桿菌以及耐藥性情況[15-16]。 本次研究旨在比較Xpert MTB/RIF 實驗與其他3 種檢測方法檢測結核分枝桿菌的效能,并以藥敏實驗為金標準,分析其檢測利福平耐藥的應用價值。
本研究采用可疑結核患者血液、痰標本分別進行T-spot 實驗、Xpert MTB/RIF 實驗、涂片鏡檢、液體培養以及傳統比例法藥敏實驗檢測患者是否感染結核分枝桿菌及其對利福平耐藥情況。 結果顯示,以臨床診斷為金標準,Xpert MTB/RIF 實驗檢測結核分枝桿菌敏感性為56.9%,與國內趙冰等[17]研究結果基本一致。 Xpert MTB/RIF 實驗檢測結核分枝桿菌敏感性略高于T-spot 實驗,明顯高于痰涂片鏡檢、液體培養。一致性檢驗結果表明,Xpert MTB/RIF 實驗與液體培養、T-spot 實驗檢測結果一致性較好。
研究表明將Xpert MTB/RIF 實驗檢測利福平耐藥情況應用于耐藥高危人群(耐藥率>20%)中開展,檢測結果更具有價值[17]。 以比例法藥敏實驗作為金標準,Xpert MTB/RIF 實驗檢測利福平耐藥的敏感性為88.9%,特異性為98.5%,與既往的研究[18-19]結果基本一致。但敏感性低于Boehme 等[20]研究結果。由于本次研究中76 例培養陽性標本進行藥敏實驗, 耐藥率僅為11.8%,目標人群利福平耐藥率較低,敏感性過低可能是由于利福平耐藥患者過少所致。因此世界衛生組織建議如果在利福平耐藥率較低人群中應用Xpert MTB/RIF 檢測技術檢測利福平耐藥情況,檢測結果為耐藥,樣本仍需采用藥敏實驗進一步驗證Xpert檢測結果。
綜上所述,Xpert MTB/RIF 實驗操作簡單、檢測快速、敏感性高并且對實驗室要求較低,因此可以很好的輔助臨床醫生及時診斷目標疾病,具有一定的使用前景。
[1] 王永忠,柳龍銀,張宏宇,等.結核分枝桿菌實時熒光核酸恒溫擴增檢測方法的建立及應用[J].江蘇醫藥,2011,37(23):2820-2822.
[2] 鄭強,李朝金,茍莉,等.多種肺結核臨床實驗室診斷方法的比較分析[J].國際檢驗醫學雜志,2014,35(21):2941-2942.
[3] 雷云.熒光PCR 診斷肺結核的臨床應用研究[J].臨床肺科雜志,2014,19(7):1278-1279.
[4] 張玉平,丁顯平,張麗嬡,等.T-SPOT、TB、痰涂片和TBDNA 檢測在肺結核診斷中的比較研究[J].成都醫學院學報,2013,8(1):49-51.
[5] 楊新明,鄒文瑋.不同方法檢查痰中結核桿菌的結果及分析[J].實驗與檢驗醫學,2010,2(3):303-304.
[6] 劉建君.中國結核病防治規劃痰涂片鏡檢質量保證手冊[M].北京:中國協和醫科大學出版社,2004:5-19.
[7] 趙雁林,王黎霞.分枝桿菌分離培養標準化操作程序及質量保證手冊[M].北京:人民衛生出版社,2013:3-12.
[8] WHO. The stop TB strategy,case reports,treatment outcomes and estimates of TB burden [R]. Geneva,2009.
[9] 王黎霞.中國結核病防治工作現狀分析[J].中國公共衛生,2012,(4):413-414.
[10] WHO.Global tuberculosis control[R].WHO report,2011.
[11] WHO. The global plan to stop TB 2011-2015:transforming the fight towards elimination of tuberculosis [R].Geneva:World health Organization,2010.
[12] Zhao YL,Xu SF,Wang LX,et al. National survey of drugresistant tuberculosis in china [J]. N IngI J Med,2012,366(23):2161-2170.
[13] Nicol MP,Workman L,Isaacs W,et al. Accuracy of the Xpert MTB/RIF test for the diagnosis of pulmonary tuberculosis in children admitted to hospital in Cape Town,South Africa:a descriptive study [J]. Lancet Infect Dis,2011,11(11):819-824.
[14] Marlowe EM,Novak-Weekley SM,Cumpio J,et al. Evaluation of the Cepheid Xpert MTB/RIF assay for direct detection of Mycobacterium tuberculosis complex in respiratory specimens [J]. J Clin Microbiol,2011,49(32):1621-1623.
[15] 夏輝,趙雁林.Xpert MTB/RIF 在我國的應用前景[J].實用醫學雜志,2013,29(23):3799-3800.
[16] 李力韜,李洪敏,馬遠征,等.應用XpertMTB/RIF 對脊柱結核臨床標本行結核分枝桿菌與利福平耐藥性檢測的驗證性研究[J].中華骨科雜志,2014,34(2):211-215.
[17] 趙冰,歐喜超,夏輝,等.Xpert MTB/RIF 檢測技術在結核病診斷中的應用評價[J].中國防癆雜志,2014,36(6):462-466.
[18] 張治國,歐喜超,孫倩,等.利福平耐藥實時熒光定量核酸擴增技術檢測痰標本中結核分枝桿菌及其耐藥性的研究[J].中國防癆雜志,2013,35(1):13-15.
[19] 伊惠霞,侯新月,王泉,等.Xpert MTB/RIF 系統快速檢測結核分枝桿菌及利福平耐藥性研究[J].新疆醫科大學學報,2014,37(12):1643-1646.
[20] Boehme CC,Nabeta P,Hillemann D,et al. Rapid molecular detection of tuberculosis and rifampin resistance [J].N Eng J Med,2010,363(11):1005-1015.

