多重調(diào)理吞噬試驗(yàn)方法的重復(fù)性和再現(xiàn)性研究
李江姣等
[摘要] 目的 研究中國食品藥品檢定研究院(以下簡稱“我院”)建立的多重調(diào)理吞噬試驗(yàn)方法(MOPA)的重復(fù)性和再現(xiàn)性。 方法 采用MOPA方法對(duì)19份血清樣本,針對(duì)13個(gè)血清型肺炎球菌的體外調(diào)理吞噬試驗(yàn)(OPA)滴度在我院及美國阿拉巴馬大學(xué)肺炎鏈球菌血清學(xué)參比實(shí)驗(yàn)室分別進(jìn)行兩輪檢測,對(duì)兩個(gè)實(shí)驗(yàn)室間檢測結(jié)果及本室的兩輪試驗(yàn)結(jié)果進(jìn)行比較分析。 結(jié)果 總體上,13個(gè)血清型的總的OPA滴度比較比較顯示,兩個(gè)實(shí)驗(yàn)室間相關(guān)系數(shù)為0.94,本室內(nèi)部則可達(dá)到0.96,均呈現(xiàn)出良好的相關(guān)性。另一方面,各血清型的兩實(shí)驗(yàn)室間和我院內(nèi)相關(guān)系數(shù)范圍分別為0.87~0.99和0.68~0.99。 結(jié)論 我院建立的MOPA方法具有良好的重復(fù)性和再現(xiàn)性,為我國開展肺炎鏈球菌疫苗的免疫保護(hù)效力評(píng)價(jià)工作奠定了良好的基礎(chǔ)。
[關(guān)鍵詞] 調(diào)理吞噬試驗(yàn);肺炎鏈球菌疫苗;功能抗體;重復(fù)性;再現(xiàn)性
[中圖分類號(hào)] R392 [文獻(xiàn)標(biāo)識(shí)碼] A [文章編號(hào)] 1673-7210(2015)10(a)-0014-04
Study on repeatability and reproducibility of multiplexed opsonophagocytic killing assay
LI Jiangjiao DU Huijing SHI Jichun CHEN Cuiping XU Miao YE Qiang
National Institutes for Food and Drug Control Key Laboratory for Standardization of Methods for Quality Control of Biotechnical Products, Ministry of Health, Beijing 100050, China
[Abstract] Objective To analyze repeatability and reproducibility of multiplexed opsonophagocytic killing assay (MOPA) established by National Institutes for Food and Drug Control ("our institute" for short). Methods opsonophagocytic titers of 19 sera against 13 pneumococcal serotypes were measured in two run by our institute and the WHO Reference Laboratory for Pneumococcal Serology in University of Alabama at Birmingham using MOPA method. The OPA titers between two laboratories (repeatability) and within our institute (reproducibility) were compared and analyzed. Results The overall correlation coefficients were high for the whole of 13 serotypes between two laboratories and within our institute, with 0.94 and 0.96 respectively. The correlation coefficients of individual serotypes between two laboratories and within our institute were 0.87-0.99 and 0.68-0.99 respectively. Conclusion The MOPA method established by our institute can detect functional antibody titers with a high degree of intralaboratory repeatability and interlaboratory reproducibility, and can be used for evaluation of potency of pneumococcal vaccine in our country.
[Key words] Opsonophagocytic assay; Pneumococcal vaccine; Functional antibody; Repeatability; Reproducibility
肺炎球菌疫苗的保護(hù)力可以通過臨床效力試驗(yàn)來確定[1],但由于需要的樣本量大、費(fèi)用高、周期長等原因臨床效力試驗(yàn)往往不易實(shí)施。建立與肺炎球菌疫苗保護(hù)力相關(guān)聯(lián)的實(shí)驗(yàn)室檢測手段,使用血清學(xué)檢測結(jié)果作為觀察終點(diǎn),能夠協(xié)助疫苗效力試驗(yàn)評(píng)估肺炎球菌疫苗的保護(hù)力,大大縮短周期。通過酶聯(lián)免疫吸附試驗(yàn)(enzyme-linked immunosorbent assay,ELISA)進(jìn)行的莢膜多糖特異性IgG抗體的定量測定,是目前比較成熟的在嬰幼兒新型肺炎球菌疫苗審批中使用的臨床效力評(píng)價(jià)方法[2]。而由于成人存在交叉反應(yīng)抗體,用ELISA法檢測的IgG抗體特異性較低[3],因此人們試圖尋找特異性高并與疫苗保護(hù)力相關(guān)性更高的替代試驗(yàn)。
相比ELISA方法,體外調(diào)理吞噬試驗(yàn)(Opsonop-hagocytic assay,OPA)可以反映機(jī)體抵御肺炎球菌感染的體內(nèi)機(jī)制[4-5],其結(jié)果能更加真實(shí)地反映肺炎球菌疫苗的保護(hù)效力[6-7],因此OPA技術(shù)在國際疫苗監(jiān)管體系中受到越來越多的重視,并得到了不斷的發(fā)展和優(yōu)化。隨著OPA技術(shù)的發(fā)展,一些實(shí)驗(yàn)室改用HL-60細(xì)胞作為效應(yīng)細(xì)胞,代替外周血淋巴細(xì)胞,并對(duì)試劑和試驗(yàn)步驟進(jìn)行優(yōu)化。在此基礎(chǔ)上,美國阿拉巴馬大學(xué)肺炎鏈球菌血清學(xué)參比實(shí)驗(yàn)室研發(fā)的多重調(diào)理吞噬實(shí)驗(yàn)技術(shù)(multiplexed opsonophagocytic killing assay,MOPA)能夠同時(shí)進(jìn)行4個(gè)血清型的功能抗體檢測,極大提高了多價(jià)疫苗的檢測效率,促進(jìn)了該項(xiàng)技術(shù)的推廣應(yīng)用[8]。然而由于操作相對(duì)復(fù)雜,技術(shù)要求高,我國長期以來對(duì)該方法的研究和應(yīng)用均較缺乏。為了提升我國藥檢機(jī)構(gòu)對(duì)肺炎球菌疫苗的免疫效果評(píng)價(jià)水平,本研究組前期已經(jīng)成功建立起MOPA技術(shù)[9],利用該技術(shù)對(duì)13價(jià)肺炎球菌結(jié)合疫苗免疫后的12份嬰兒血清樣本進(jìn)行了OPA滴度檢測,并與相應(yīng)的ELISA結(jié)果進(jìn)行了比較分析,結(jié)果顯示,OPA法與ELISA法測定的血清抗體效價(jià)的相關(guān)性較高,二者結(jié)果具有良好的一致性[10]。
為了進(jìn)一步對(duì)所建立的MOPA技術(shù)進(jìn)行驗(yàn)證,本研究在兩個(gè)不同實(shí)驗(yàn)室[中國食品藥品檢定研究院(以下簡稱“我院”)及該技術(shù)的發(fā)明單位美國阿拉巴馬大學(xué)肺炎球菌血清學(xué)參比實(shí)驗(yàn)室]利用MOPA技術(shù)對(duì)同一組血清樣本(19份血清)針對(duì)13個(gè)血清型肺炎球菌的OPA滴度分別進(jìn)行了兩輪MOPA檢測,并對(duì)兩實(shí)驗(yàn)室間結(jié)果及我院內(nèi)的兩輪結(jié)果進(jìn)行了比較分析,旨在通過與國際參比實(shí)驗(yàn)室的比較來檢驗(yàn)我們建立的MOPA方法的重復(fù)性(我院內(nèi)比較)和再現(xiàn)性(兩個(gè)實(shí)驗(yàn)室間比較),進(jìn)而為我國藥檢機(jī)構(gòu)應(yīng)用該技術(shù)進(jìn)行肺炎球菌疫苗免疫效力評(píng)價(jià)的可靠性提供依據(jù)。
1 材料與方法
1.1 實(shí)驗(yàn)材料
HL-60細(xì)胞系購自美國ATCC(CCL-240);13種血清型的肺炎鏈球菌靶菌、19份血清樣本、以及乳兔補(bǔ)體來源于美國阿拉巴馬大學(xué)肺炎鏈球菌血清學(xué)參比實(shí)驗(yàn)室。
1.2 試劑及儀器
1.2.1 我院使用的試劑及儀器 二甲基甲酰胺(DMF)(批號(hào):3345C432)、2,3,5-氯化三苯基四氮唑(TTC)(批號(hào):2532B313)、鏈霉素(Streptomycin,批號(hào):2036B318)購自美國梭倫Amresco公司;奧普脫欣(Optochin,批號(hào):051M1257V)、奇霉素(Spectinomycin,批號(hào):102K05 447V)、甲氧芐氨嘧啶(Trimethoprim,批號(hào):BCBC9232V)購于美國圣路易斯Sigma公司;菌落計(jì)數(shù)器(型號(hào):ProtoCOL 3)購自英國劍橋Synbiosis公司。
1.2.2 美國阿拉巴馬大學(xué)肺炎鏈球菌血清學(xué)參比實(shí)驗(yàn)室使用的試劑及儀器 DMF(批號(hào):107575)購自美國匹茲堡Fisher Scientific公司;TTC(批號(hào):BCBP3272V)、鏈霉素(Streptomycin,批號(hào):SLBH9702V)、奧普脫欣(Optochin,批號(hào):051M1269V)、奇霉素(Spectinomycin,批號(hào):102K05782V)、甲氧芐氨嘧啶(Trimethoprim,批號(hào):BCBN2518V)購于美國圣路易斯Sigma公司;菌落計(jì)數(shù)器(型號(hào):ProtoCOL 3)購自英國劍橋Synbiosis公司。
1.3 OPA滴度檢測
OPA滴度檢測采用可同時(shí)檢測4種血清型的多重調(diào)理吞噬實(shí)驗(yàn)方法(MOPA法)。具體操作步驟見參考文獻(xiàn)[9-10]。我院及美國阿拉巴馬大學(xué)肺炎鏈球菌血清學(xué)參比實(shí)驗(yàn)室對(duì)19份血清樣本的13個(gè)血清型分別進(jìn)行兩輪MOPA檢測,每輪MOPA試驗(yàn)中的每個(gè)血清樣本均平行測定2次,取平均值作為每輪試驗(yàn)的結(jié)果值。
1.4 結(jié)果分析
進(jìn)行兩實(shí)驗(yàn)室間的結(jié)果比較時(shí),取各自實(shí)驗(yàn)室兩輪MOPA試驗(yàn)結(jié)果的平均值作為各自實(shí)驗(yàn)室的最終結(jié)果值。將OPA滴度值轉(zhuǎn)換為以10為底的對(duì)數(shù),進(jìn)行線性回歸分析,計(jì)算相關(guān)系數(shù)。
2 結(jié)果
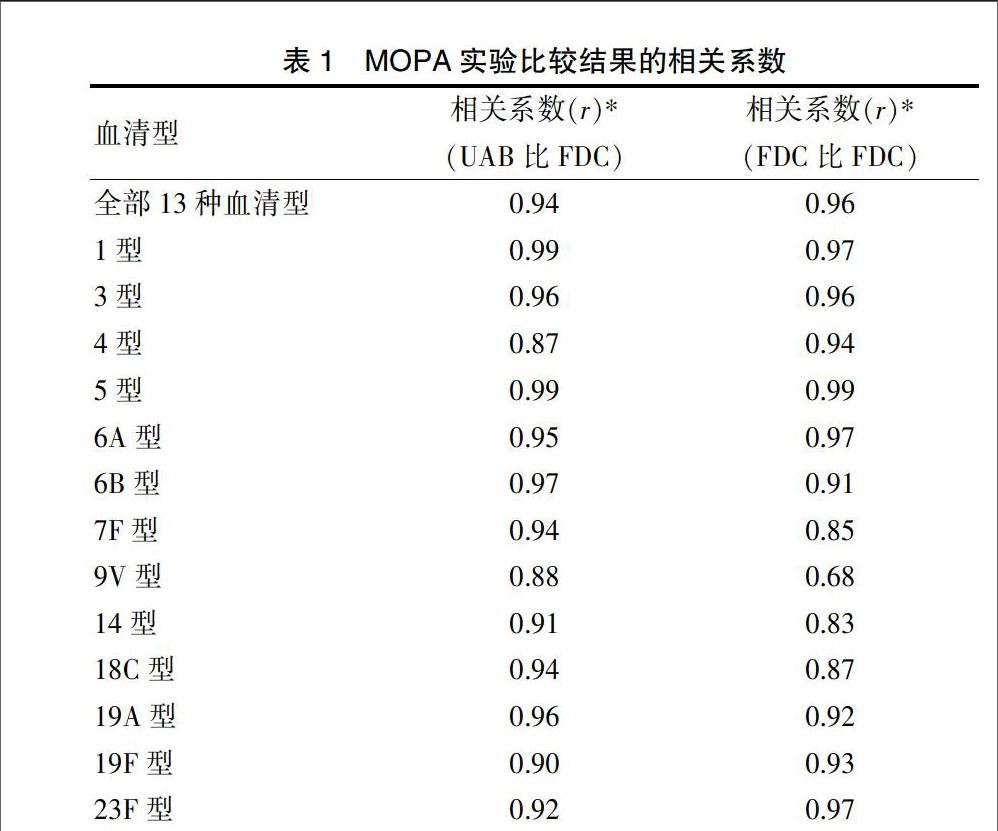
19份血清樣本針對(duì)13個(gè)血清型肺炎球菌的OPA滴度在兩實(shí)驗(yàn)室間及我院內(nèi)的比較結(jié)果見圖1(封三)。圖1可以看出,兩實(shí)驗(yàn)室間比較及我院內(nèi)比較產(chǎn)生的點(diǎn)均大部分集中聚集在一致線上及其附近,提示結(jié)果有著良好一致性。實(shí)驗(yàn)室間比較的點(diǎn)相較與實(shí)驗(yàn)室內(nèi)比較的點(diǎn)分布稍微分散。19份血清樣本針對(duì)13個(gè)血清型肺炎球菌的OPA滴度在兩實(shí)驗(yàn)室間及本室兩輪試驗(yàn)的相關(guān)系數(shù)統(tǒng)計(jì)結(jié)果具體見表1。
3 討論
特異性抗體、補(bǔ)體與吞噬細(xì)胞表面結(jié)合,促進(jìn)吞噬細(xì)胞吞噬細(xì)菌等顆粒性抗原的過程稱為調(diào)理吞噬作用,是人類宿主抵抗肺炎球菌感染的主要機(jī)制[4]。由于OPA技術(shù)可以直接測定具有調(diào)理吞噬功能的功能性抗體水平[5],并且與肺炎球菌疫苗免疫保護(hù)效力的相關(guān)性比ELISA法更高[6-7],因而OPA技術(shù)在國際上受到越來越多的關(guān)注和應(yīng)用[11-15]。2013年美國惠氏公司的13價(jià)肺炎球菌結(jié)合疫苗在歐洲被批準(zhǔn)用于50歲以上成人使用時(shí),采用OPA技術(shù)進(jìn)行臨床效果評(píng)價(jià)[16-17]。2015年美國默沙東公司新注冊的的15價(jià)肺炎球菌結(jié)合疫苗使用OPA法進(jìn)行臨床評(píng)價(jià)[18]。
然而,由于OPA試驗(yàn)操作相對(duì)復(fù)雜,對(duì)實(shí)驗(yàn)室條件及操作人員專業(yè)技術(shù)要求高,因而其大范圍的推廣應(yīng)用受到了一定程度限制。OPA試驗(yàn)中涉及的活性物質(zhì)較多,需要經(jīng)過反復(fù)摸索逐漸掌握。首先,效應(yīng)細(xì)胞是OPA實(shí)驗(yàn)中一個(gè)重要部分,也是比較難于掌控的一個(gè)環(huán)節(jié)。許多實(shí)驗(yàn)室在建立OPA技術(shù)時(shí)遇到的主要障礙來自HL-60細(xì)胞的操作。因?yàn)樵摲椒ú粌H要求實(shí)驗(yàn)室具備細(xì)胞培養(yǎng)能力,還得確保HL-60細(xì)胞能夠有效分化為中性粒細(xì)胞樣吞噬細(xì)胞。誘導(dǎo)劑DMF的濃度、細(xì)胞分化時(shí)間以及用于分化的細(xì)胞數(shù)量都需嚴(yán)格控制。其次,該方法中各血清型的活性靶菌數(shù)均需控制在70~180 cfu范圍內(nèi)以保證計(jì)數(shù)數(shù)據(jù)的準(zhǔn)確性,而實(shí)驗(yàn)中各種原因常常導(dǎo)致靶菌數(shù)量波動(dòng)和超出范圍,容易導(dǎo)致試驗(yàn)失敗。再次,本方法對(duì)補(bǔ)體的要求也比較高,要求補(bǔ)體自身的非特異性殺菌力不能太強(qiáng),需經(jīng)過篩選。正由于該方法試驗(yàn)操作復(fù)雜,技術(shù)性要求高,目前在國內(nèi)的發(fā)展和應(yīng)用仍比較缺乏。為了促進(jìn)該技術(shù)在國內(nèi)的應(yīng)用,我院前期構(gòu)建了該技術(shù)所需的HL-60主代細(xì)胞庫、13種血清型的工作菌種批,完成了相應(yīng)的有效性檢測,最終成功建立起MOPA技術(shù)[9]。隨后利用建立的MOPA技術(shù)完成了12份血清樣本的13種血清型的OPA滴度檢測,并與相應(yīng)的ELISA結(jié)果進(jìn)行了比較分析,得到較高的一致性結(jié)果[10]。
為了進(jìn)一步對(duì)所建立的MOPA技術(shù)進(jìn)行驗(yàn)證,本研究組利用MOPA技術(shù)對(duì)19份血清樣本針對(duì)13個(gè)血清型肺炎球菌的OPA滴度在兩個(gè)實(shí)驗(yàn)室(我院和美國阿拉巴馬大學(xué)MOPA技術(shù)發(fā)明實(shí)驗(yàn)室)分別進(jìn)行了兩輪檢測,并對(duì)兩實(shí)驗(yàn)室間結(jié)果及我院內(nèi)兩輪結(jié)果進(jìn)行比較分析,通過與國際權(quán)威參比實(shí)驗(yàn)室的結(jié)果比較來檢驗(yàn)建立的MOPA技術(shù)的再現(xiàn)性和重復(fù)性。本研究結(jié)果顯示:全部13個(gè)血清型的總的實(shí)驗(yàn)室間和總的實(shí)驗(yàn)室內(nèi)相關(guān)系數(shù)均較高,分別為0.94和0.96。各血清型的實(shí)驗(yàn)室間和實(shí)驗(yàn)室內(nèi)相關(guān)系數(shù)范圍分別為0.87~0.99和0.68~0.99。1、3、5、6A、6B型在兩實(shí)驗(yàn)室間測定的OPA滴度相關(guān)性很高,其中1、5型的兩實(shí)驗(yàn)室間相關(guān)性最高,均為0.99。4型和9V型在兩實(shí)驗(yàn)室間相關(guān)性相對(duì)略低,分別為0.87和0.88。9V型在我院內(nèi)兩次OPA結(jié)果相關(guān)系數(shù)偏低,可能是由于兩次實(shí)驗(yàn)中所用效應(yīng)細(xì)胞的分化狀態(tài)不同導(dǎo)致。總體上看,13個(gè)血清型的總實(shí)驗(yàn)室內(nèi)相關(guān)系數(shù)高于總實(shí)驗(yàn)室間相關(guān)系數(shù);各血清型分開來看,多個(gè)型別的實(shí)驗(yàn)室內(nèi)相關(guān)系數(shù)小于實(shí)驗(yàn)室間相關(guān)系數(shù),可能由于兩實(shí)驗(yàn)室間進(jìn)行比較的數(shù)值是各自實(shí)驗(yàn)室兩輪OPA試驗(yàn)的平均值,結(jié)果值更為準(zhǔn)確一些。國際上有過6個(gè)實(shí)驗(yàn)室同時(shí)用OPA法檢測16份血清樣本的研究,得出實(shí)驗(yàn)室間相關(guān)系數(shù)范圍為0.71~0.91[19]。本研究證實(shí)我院建立的MOPA方法具有良好的重復(fù)性和再現(xiàn)性,不低于國際同等水平。
綜上所述,本研究證明所建立的MOPA方法具有良好的重復(fù)性和再現(xiàn)性。未來還將對(duì)建立的MOPA方法做更多的驗(yàn)證,如特異性、精密性等,以逐步完善該方法的整體驗(yàn)證,最終為該技術(shù)成功應(yīng)用于肺炎球菌疫苗的臨床免疫效果評(píng)價(jià),并為實(shí)現(xiàn)在我國藥檢機(jī)構(gòu)的推廣提供基礎(chǔ)。
[參考文獻(xiàn)]
[1] Eskola J,Kilpi T,Palmu A,et al. Efficacy of a pneumococcal conjugate vaccine against acute otitis media [J]. N Engl J Med,2001,344(6):403-409.
[2] Wernette CM,F(xiàn)rasch CE,Madore D,et al. Enzyme-linked immunosorbent assay for quantitation of human antibodies to pneumococcal polysaccharides [J]. Clin Diagn Lab Immunol,2003,10(4):514-519.
[3] Ortqvist A,Henckaerts I,Hedlund J,et al. Non-response to specific serotypes likely cause for failure to 23-valent pneumococcal polysaccharide vaccine in the elderly [J]. Vaccine,2007,25(13):2445-2450.
[4] Winkelstein JA,Smith MR,Shin HS. The role of C3 as an opsonin in the early stages of infection [J]. Proc Soc Exp Biol Med,1975,149(2):397-401.
[5] Romero-Steiner S,F(xiàn)rasch CE,Carlone G,et al. Use of opsonophagocytosis for serological evaluation of pneumococcal vaccines [J]. Clin Vaccine Immunol,2006,13(2):165-169.
[6] Henckaerts I,Durant N,De Grave D,et al. Validation of a routine opsonophagocytosis assay to predict invasive pneumococcal disease efficacy of conjugate vaccine in children [J]. Vaccine,2007,25(13):2518-2527.
[7] Schuerman L,Wysocki J,Tejedor JC,et al. Prediction of pneumococcal conjugate vaccine effectiveness against invasive pneumococcal disease using opsonophagocytic activity and antibody concentrations determined by enzyme-linked immunosorbent assay with 22f adsorption [J]. Clin Vaccine Immunol,2011,18(12):2161-2167.
[8] Burton RL,Nahm MH. Development and validation of a fourfold multiplexed opsonization assay (MOPA4) for pneumococcal antibodies [J]. Clin Vaccine Immunol,2006,13(9):1004-1009.
[9] 李江姣,杜慧竟,石繼春,等.評(píng)價(jià)肺炎鏈球菌疫苗免疫效果的功能性抗體檢測方法的建立[J].中國醫(yī)藥導(dǎo)報(bào),2014,11(20):4-8.
[10] 李江姣,杜慧竟,陳馳,等.肺炎球菌結(jié)合疫苗兩種免疫效果評(píng)價(jià)方法的比較分析[J].實(shí)用預(yù)防醫(yī)學(xué),2014,22(11):1-8.
[11] Kim KH,Seoh JY,Cho SJ. Phenotypic and functional analysis of HL-60 cells used in opsonophagocytic-killing assay for Streptococcus pneumoniae [J]. J Korean Med Sci,2015,30(2):145-150.
[12] Bhorat AE,Madhi SA,Laudat F,et al. Immunogenicity and safety of the 13-valent pneumococcal conjugate vaccine in HIV-infected individuals naive to pneumococcal vaccination [J]. AIDS,2015,29(11):1345-1354.
[13] Togashi T,Okada K,Yamaji M,et al. Immunogenicity and safety of a 13-valent pneumococcal conjugate vaccine given with DTap vaccine in healthy infants in Japan [J]. Pediatr Infect Dis J,2015[Epub ahead of print].
[14] Shiramoto M,Hanada R,Juergens C,et al. Immunogenicity and safety of the 13-valent pneumococcal conjugate vaccine compared to the 23-valent pneumococcal polysaccharide vaccine in elderly Japanese adults [J]. Hum Vaccin Immunother,2015,15:1-9.
[15] Blumental S,Mosi JC,Roalfe L,et al. Streptococcus pneumoniae serotype 1 burden in the African meningitis belt: exploration of functionality in specific antibodies [J]. Clin Vaccine Immunol,2015,22(4):404-412.
[16] Jackson LA,Gurtman A,van Cleeff M,et al. Immunogenicity and safety of a 13-valent pneumococcal conjugate vaccine compared to a 23-valent pneumococcal polysaccharide vaccine in pneumococcal vaccine-naive adults [J]. Vaccine,2013,31(35):3577-3584.
[17] Durando P,F(xiàn)aust SN,F(xiàn)letcher M,et al. Experience with pneumococcal polysaccharide conjugate vaccine (conjugated to CRM197 carrier protein) in children and adults [J].Clin Microbiol Infect,2013,19(Suppl 1):1-9.
[18] McFetridge R,Meulen AS,F(xiàn)olkerth SD,et al.Safety,tolerability,and immunogenicity of 15-valent pneumococcal conjugate vaccine in healthy adults [J]. Vaccine,2015,33(24):2793-2799.
[19] Rose CE,Romero-Steiner S,Burton RL,et al. Multilaboratory comparison of streptococcus pneumoniae opsonophagocytic killing assays and their level of agreement for the determination of functional antibody activity in human reference sera [J]. Clin Vaccine Immunol,2011,18(1):135-142.
(收稿日期:2015-06-29 本文編輯:蘇 暢)

