優化“分離以尿素為氮源的微生物”的實驗
劉怡+吳彬
“分離以尿素為氮源的微生物”的實驗屬于高中生物學選修1《生物技術實踐》(浙科版)中的內容。該模塊是為了滿足學生多樣化發展的需要而設計的實驗課,但在實際教學中,由于受到高考要求和實驗條件的限制,真正以實驗形式開展教學的學校很少,對于該實驗的理解也停留在了理論的層面上,缺乏實際的操作實踐。本文在實驗研究的基礎上,結合教學實踐的嘗試,針對該實驗中存在的一些問題進行了反思,提出了一些改進的策略。
一、實驗材料的選擇和處理
該實驗的目的是使用含有尿素的培養基分離有脲酶的細菌和利用指示劑顏色的變化檢知脲酶所催化的反應;實驗的內容是從土壤中分離出能利用尿素的細菌,觀察菌落數,了解它在生態平衡中的作用,并以LB全營養培養基為對照,觀察全營養生長細菌的菌落數。為了獲得實驗的成功,首先必須正確地選擇和處理實驗材料。[1]
(一)土樣的獲取
為了分離到能分解尿素的細菌,需要獲取合適的土樣。教材中只提到從有哺乳動物排泄物的地方獲取,具體的方法并未說明,操作過程中由于實驗材料獲取不當很容易導致實驗的失敗。土壤中的微生物數量繁多、種類復雜,在富含有機質的土壤表層,有更多微生物生長。細菌適宜在中性環境的潮濕土壤中生長,且絕大多數分布在距地表約3~8cm的土壤層。因此在土壤取樣時,可以從施用人畜糞便的農田等環境中選擇肥沃、濕潤的土壤,先鏟去表層土3cm左右再取樣,將樣品裝入事先準備好的信封中備用。
(二)制備土壤稀釋液
教材中只說明了制備土壤稀釋液的過程要在無菌條件下進行,實際上土樣的稱取也應該無菌操作,在超凈臺上酒精燈火焰旁進行。
在無菌條件下,稱取1g土樣,加到99mL無菌水的三角瓶中,振蕩,即成10-2稀釋液,從該稀釋液中取0.5mL懸液加到4.5mL無菌水的試管中,經振蕩制成10-3 稀釋液,再依次制備10-4、10-5土壤稀釋液。實驗要求每次稀釋后都要振蕩10min,在實際教學中很難有那么長的時間給學生操作,可以適當縮短振蕩時間,混勻即可。
二、尿素固體培養基的配制
該實驗中分離以尿素為氮源的微生物所依據的原理是在氮源只有尿素時,這些微生物能利用尿素獲得氮源而存活,其他微生物則因為缺乏氮源而死亡,因此尿素固體培養基的配制是本實驗的關鍵。
(一)用瓊脂糖代替瓊脂
其他版本的教材中配制尿素固體培養基時添加的是瓊脂,浙科版教材改為瓊脂糖。瓊脂在制作固體培養基時可作為凝固劑,但它是一種未被純化的混合物,里面有一定量的含氮化合物。
瓊脂糖是瓊脂進一步純化,去除了含氮化合物后的產物。利用瓊脂糖作凝固劑,能防止含氮化合物對實驗的干擾,有利于以尿素為氮源的細菌的篩選。
(二)適當降低尿素的濃度
教材中配制尿素培養基時,25mL培養基溶液中是加入了10mL含有2g尿素的尿素溶液,質量分數達到了8%,實驗研究發現,經這種培養基培養長出的細菌含量很少,10-2的稀釋度下也只是偶爾能看到1個菌落,高的稀釋度下更難有結果出現。文獻資料表明,尿素可在脲酶的作用下水解成碳酸銨進而生成氨,尿素濃度過高,產生的氨太多會導致培養基pH增大,不利于細菌生長。[2]若尿素濃度過低,產生的氨太少,酚紅的顯色現象則不明顯。
為了確定尿素溶液的最佳比例,筆者配制了不同濃度梯度的尿素溶液進行實驗,在25mL培養基溶液中分別加入10mL含有0.25g、0.5g、1g、1.5g、2g尿素的尿素溶液,結果表明,添加0.5g尿素的培養基中細菌生長較多,顯色現象較明顯。由此可見,適當降低配方中的尿素濃度,有利于實驗效果的改善。
(三)尿素溶液的滅菌方法
尿素加熱后會分解,因此不能使用高壓蒸汽滅菌,一般采用的是過濾除菌法,可以使用G6玻璃漏斗或針頭式過濾器過濾。教材中采用的是G6玻璃漏斗過濾的方法。玻璃漏斗使用前要先在121℃下用紙包好滅菌,使用后需要用1mol/L的HCl浸泡,并抽濾去酸,再用蒸餾水洗至洗出液呈中性,干燥后保存,操作起來非常煩瑣,且過濾耗時很長。目前實驗室中廣泛采用的過濾處理裝置為針頭式過濾器。一次性針頭式過濾器可與一次性注射器配套使用,過濾尿素時,一般選擇孔徑為0.22μm的針頭式過濾器。這種方法不需要換膜和清洗濾器,省去了復雜、費時的準備工作,使用起來快速方便。
也可以使用化學滅菌法對尿素滅菌。取麝香草酚結晶一塊,在燒杯中用蒸餾水反復洗滌三次,然后置于一定量的尿素溶液中,在冰箱內保存24小時后即可使用。由于麝香草酚對霉菌的抑制力較差,故配好后應在冰箱中保存,以免受到霉菌污染而使尿素失效,同時可以長期使用。這種方法非常簡便,效果也較好,在醫院中經常使用。
三、稀釋涂布分離法的操作
分離以尿素為氮源的微生物需要使用稀釋涂布分離的方法,教材中只是簡要介紹了稀釋涂布的內容和程序,對于移液槍的正確使用和涂布法的操作都沒有說明,對于首次使用涂布分離法的學生來說困難很大。
(一)移液槍的使用方法
在設定容量時先通過粗調將容量值迅速調整至接近自己的預想值,再將移液槍橫置,水平放置在自己的眼前進行細調,慢慢將容量值調至預想值,從而避免視覺誤差。需要特別注意的是,從大值調整到小值時,剛好就行;但從小值調整到大值時,需要調超1/3圈后再返回,這是因為計數器里面有一定的空隙需要彌補。在該過程中,不能將按鈕旋出量程,否則會卡住內部機械裝置而損壞了移液槍。將移液槍垂直插入槍頭中,稍微用力左右微微轉動即可使其緊密結合。
在吸取液體之前,應該先預吸取、排放三次,讓吸頭內壁吸附一層液膜,確保移液的精度和準度。吸液時,先將移液槍排放按鈕按至第一停點,再將吸頭垂直浸入液面2~4mm以下,然后慢慢松開按鈕回原點。放液時,先將按鈕按至第一停點排出液體,稍停片刻后,繼續按按鈕至第二停點吹出殘余的液體,最后松開按鈕,確保吸頭內無殘留液體。整個過程應保持慢吸慢放,避免速度太快而產生反沖和氣泡,導致移液的體積不準確,同時還要注意是否會有漏氣現象。endprint
(二)涂布分離的操作
涂布分離時,若平板不干燥,會影響涂布的效果,有時會因涂布不均勻使某些部位的菌落不能分開,或在培養基上出現一層薄膜。因此涂布前可將制備好的平板預先放在培養箱里培養一段時間,待表面水分蒸發后再進行涂布。取0.1mL 10-4、10-5土壤稀釋液加入尿素培養基和全營養LB培養基中,右手持玻璃刮刀平放在培養基表面,將菌液沿同心圓方向輕輕地向外擴展,可以先按一條線輕輕地來回推動,使菌液分布均勻,然后再按其垂直方向來回推動,平板邊緣可弧線推動。需要注意的是,涂布完成后不宜立即將培養基倒置,而應先在室溫下靜置5~l0min,使菌液滲透入培養基內,再將培養基倒置培養。
此外,玻璃刮刀在使用前保存在70%酒精中,使用時先將玻璃刮刀在酒精燈火焰上引燃,待酒精燃盡、火焰熄滅后,先在培養皿蓋內側稍作冷卻后再進行涂布。切忌將剛剛灼燒過的玻璃刮刀立即放入酒精中,以免高溫引起酒精燃燒,造成危險。更換稀釋度時,需要將玻璃刮刀灼燒滅菌并更換玻璃刮刀,若由低濃度向高濃度更換,也可以不更換。因此,建議先進行10-5土壤稀釋液的涂布,再進行10-4土壤稀釋液的涂布,這樣在使用移液槍滴加液體時可以不用換槍頭,玻璃刮刀也可以不用更換,省去了許多麻煩。
四、培養時間的調整
該實驗中利用酚紅作為指示劑檢測脲酶所催化的反應,細菌培養時間為24~48h。
酚紅是一種酸堿指示劑,顯色范圍為pH6.4~8.2,酸性條件下顯黃色,堿性條件下顯紅色。細菌培養后,產生的脲酶將尿素分解成氨,從而使酚紅由黃變紅,從而可以檢測出細菌是否已將尿素分解。隨著培養時間的延長,紅色區域的面積越來越大,據此也可以判斷細菌分解尿素能力的強弱。
實驗研究發現,在含有酚紅的培養基中細菌生長會較緩慢。在沒有添加酚紅的尿素培養基中,培養24h后即可看到明顯的菌落產生;添加了酚紅的培養基中,則要到48h后才能看到菌落出現,若要觀察到顯色反應,時間則更久,至少需要72h,甚至一周左右。因此,建議可以將培養時間相對延長至72h以后,紅色也會越來越明顯。
五、改進后的實驗效果
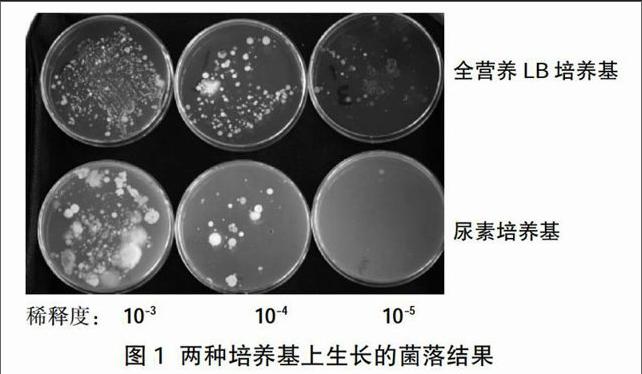
根據預期的實驗結果,有脲酶的細菌菌落周圍應出現著色環帶,但教材中的實驗結果圖片只能顯示出兩種培養基上細菌數量的不同,并沒有清楚地看見紅色環帶,學生很難產生直觀的認識。經過反思和改進后,取得了較好的實驗效果,如圖1所示。
實驗結果顯示,在相同的稀釋度下,全營養培養基中有較多菌落,尿素培養基中只有少量菌落;全營養培養基中菌落種類多樣,尿素培養基中菌落種類較單一;有脲酶的細菌菌落周圍出現紅色環帶,菌落較多的尿素培養基逐漸變紅。值得注意的是,理論上尿素培養基中分離出的只有以尿素為氮源的細菌,但實際上尿素培養基中分離出的細菌不一定全都是以尿素為氮源的,有些細菌會利用其他微生物代謝的產物為氮源,如尿素分解后產生的氨就可為硝化細菌提供氮源,[3]因此還需要通過進一步的檢測確定細菌的種類。
六、小結與反思
“分離以尿素為氮源的微生物”的實驗教學不僅有助于學生更深入地認識微生物的利用,拓展生物科技視野,增進對生物科技與社會關系的理解,還有助于提高設計實驗、動手操作等科學探究的能力。充分的實驗準備和良好的實驗效果是提高實驗教學有效性、達成教學目標的基本途徑和重要手段。
經過改良后的實驗方案,既提高了實驗的效率,又能取得較好的實驗效果,學生們基本都能培養分離得到以尿素為氮源的細菌并觀察到紅色環帶的現象。成功的實驗結果更能激發學生學習的興趣和動力,增強實驗的自信心和積極性,提升對生物學科的熱愛,有助于知識的意義建構,大大提高了實驗教學的有效性。
參考文獻:
[1] 李其安.高中生物實驗教學中存在的問題及解決策略[J].中學生物學,2012(9):13-14.
[2] 竇向梅,王愛麗,郭寧寧.“分離以尿素為氮源的微生物”的實驗改進[J].生物學通報,2010(11):51-53.
[3] 畢詩秀.“分離以尿素為氮源的微生物”實驗教學目標及組織[J].生物學通報,2013(3):32-36.endprint

