神經肽Y對小神經膠質細胞活化狀態和生成TNF-α的影響
李琦軍,吳永波,常軍英,侯衛星,邢兆國,王彥志,穆衛廬,李 炎,賈東昭,張淑麗
(1.河北省石家莊市第三醫院,河北 石家莊 050011;2.河北省石家莊市公安局法醫損傷檢驗鑒定室,河北 石家莊 050011;3.河北省秦皇島市骨科醫院,河北 秦皇島 066001)
神經肽Y對小神經膠質細胞活化狀態和生成TNF-α的影響
李琦軍1,吳永波2,常軍英1,侯衛星1,邢兆國1,王彥志1,穆衛廬1,李 炎1,賈東昭1,張淑麗3
(1.河北省石家莊市第三醫院,河北 石家莊 050011;2.河北省石家莊市公安局法醫損傷檢驗鑒定室,河北 石家莊 050011;3.河北省秦皇島市骨科醫院,河北 秦皇島 066001)

目的 探討神經肽Y(NPY)對原代小神經膠質細胞生物活性及生成腫瘤壞死因子-α(TNF-α)的影響。方法 培養原代大鼠皮質小膠質細胞,經脂多糖(LPS)和NPY處理后行免疫細胞化學熒光染色,顯微鏡下觀察LPS和NPY對小膠質細胞形態學的影響。將小膠質細胞分為對照組、LPS組、NPY+LPS組、NPY組和BIBP3226+NPY+LPS組,每組3個樣本,培養各組細胞6 h。ELISA法檢測培養液中TNF-α蛋白含量,RT-PCR方法檢測小膠質細胞中TNF-α mRNA表達水平。結果 LPS處理后小膠質細胞處于活化狀態,NPY處理后的小膠質細胞活化水平降低。LPS組和IBP 3226+NPY+LPS組培養液中TNF-α蛋白含量及細胞中TNF-α mRNA表達水平顯著高于對照組(P均<0.05);LPS+NPY組TNF-α蛋白含量和TNF-α mRNA表達水平明顯低于LPS組和IBP3226+NPY+LPS組(P均<0.05)。結論 NPY能夠降低小神經膠質細胞的生物活性。NPY可能通過激活NPY Y1受體抑制小神經膠質細胞生成TNF-α。
神經肽-Y;小神經膠質細胞;腫瘤壞死因子-α
小膠質細胞是一種廣泛分布于中樞神經系統的巨噬細胞。正常狀態下,小膠質細胞處于靜息狀態,在中樞神經系統中起著免疫監視作用。當內環境發生變化時會迅速被激活,激活后的小膠質細胞能夠釋放白細胞介素1β(IL-1β)和腫瘤壞死因子α(TNF-α)等細胞因子以及活性氧、活性氮、脂類等大量生物活性物質[1-2],這些活性物質的過分釋放并積聚于中樞神經系統會導致神經元損傷[3-5]。神經肽Y(NPY)是一種多肽類物質,廣泛分布于中樞及周圍神經系統,由36個氨基酸組成,與癲癇、學習和記憶都有著密切關系,NPY可以通過其Y2、Y5受體起到保護神經元作用[6]。最近Ferreira等[7]研究表明,NPY可以抑制脂多糖(LPS)所致的小鼠小膠質細胞N9細胞株的激活,減少TNF-α、IL-1β、NO的生成。本實驗進一步研究了NPY對體外培養的原代大鼠皮質小膠質細胞的生物活性、小膠質細胞來源的TNF-α生成的影響。現將結果報道如下。
1 實驗資料
1.1實驗動物 24 h內新生SD大鼠30只[清潔級,河北醫科大學實驗動物中心提供,動物生產許可證號:SCXK(冀)2013-1-03]。
1.2 主要試劑 小鼠單克隆抗體IBA-1、脂多糖(美國Sigma公司),FITC標記的山羊抗小鼠IgG(美國Proteintech公司),胎牛血清、DMEM/F12培養基(美國Gibco公司), BIBP3226(美國Tocris Bioscience公司),NPY(美國ENZO公司),ELISA試劑盒(中國Bio-Swamp公司),GoldViewⅠ型核酸染料(美國Ameresco公司),Trizol(美國Invitrogen公司),RT-PCR逆轉錄試劑盒、RNA酶抑制劑(RNasin)、PCR擴增試劑盒、隨機引物(美國Promega公司)。
1.3 小膠質細胞培養 參照Nakajima等[8]所述方法。24 h內新生大鼠無菌環境下開顱取腦,剝除腦膜及血管,取部分大腦皮質,剪碎后用0.125%胰蛋白酶37 ℃消化15 min后,反復吹打成懸液,1 000 r/min離心5 min后過濾,棄上清,在沉淀物中加入膠質細胞培養液(膠質細胞培養液為含10%胎牛血清,1 IU/mL青霉素、100 μg/mL鏈霉素的DMEM/F12培養基制成細胞懸液),接種于250 mL培養瓶中,37 ℃、5%CO2培養。第2天全量換液1次,以后每3 d更換1/2體積培養液。培養至第14天,細胞充分分層生長后,置于37 ℃恒溫搖床中180 r/min振搖2 h,收集細胞懸液,1 000 r/min離心5 min,去上清,用DMEM/F12全培養基吹打成細胞懸液,將細胞調至約1×108L-1,種植到預先鋪好多聚賴氨酸的六孔板內,每孔3 mL。在恒溫培養箱內靜置30 min后完全換液1次,去除少突膠質細胞,加入 DMEM/F12完全培養基繼續培養3~5 d。
1.4 形態學觀察 分離純化好的小膠質細胞分別以1×104個細胞/皿接種于3個預先放置經多聚賴氨酸處理過的蓋玻片的3.5 cm培養皿,24 h后,分別更換為無血清膠質細胞培養液、含LPS(終濃度為100 ng/mL)的無血清膠質細胞培養液和含NPY (終濃度為1 μmol/L)及LPS(終濃度為100 ng/mL)的無血清膠質細胞培養液繼續培養6 h, 6 h后取出蓋玻片,以IBA-1為一抗,行免疫細胞化學染色,熒光顯微鏡下觀察原代大鼠皮質小膠質細胞形態學變化。
1.5 小膠質細胞分組及處理方法 將分離純化好的小膠質細胞以2×104個細胞/孔接種于預鋪多聚賴氨酸的24孔培養板用于TNF-α蛋白檢測,以5×105個細胞/孔接種于6孔培養板用于TNF-α mRNA的檢測。培養3 d后換新鮮無血清膠質細胞培養液培養12 h使細胞同步化,然后將細胞分為對照組、LPS組、NPY+LPS組、NPY組和BIBP3226+NPY+LPS組,每組3個樣本。對照組細胞以無血清膠質細胞培養液孵育6 h,LPS組細胞以含LPS(終濃度為100 ng/mL)的無血清膠質細胞培養液孵育6 h,NPY+LPS組細胞是先以含NPY(終濃度為1 μmol/L)的無血清膠質細胞培養液孵育0.5 h,然后加入LPS(終濃度為100 ng/mL)繼續孵育6 h。NPY組細胞以含NPY(終濃度為1 μmol/L) 無血清膠質細胞培養液孵育6 h。IBP3226+NPY+LPS組細胞先用含NPY Y1受體阻斷劑BIBP3226(終濃度為1 μmol/L)的無血清膠質細胞培養液孵育0.5 h,再加入終濃度為1 μmol/L的NPY孵育0.5 h,最后加入終濃度100 ng/mL的LPS繼續孵育6 h。
1.6 小膠質細胞培養液中TNF-α蛋白含量的檢測 取上述各組小膠質細胞培養液,離心后采用ELISA法檢測培養液中TNF-α蛋白含量。
1.7 小膠質細胞中TNF-α mRNA表達水平的檢測 采用實時熒光定量PCR法檢測上述各組小膠質細胞中的TNF-α mRNA表達水平。小膠質細胞加入Trizol(1 mL/孔),吹打后移至去核酶的離心管中,靜置5 min。每管加入0.2 mL氯仿,震蕩15 s,靜置5 min。12 000 r/min離心15 min,把上層無色液體移到新的離心管中。加入等體積的異丙醇,顛倒混勻。4 ℃ 12 000 r/min離心10 min,管底可見羽毛狀白色沉淀物,完全棄去上清。加入1 mL 75%乙醇(DEPC水配置),洗滌沉淀。4 ℃ 7 500 r/min離心5 min,棄上清。靜置晾干3~5 min,加入20~30 μL DEPC水充分溶解RNA。1%瓊脂糖凝膠電泳證實RNA完整性較好,無污染。紫外分光光度計檢測RNA濃度。引物由上海生工生物公司合成。TNF-α和GAPDH的引物序列:TNF-α上游引物為5’-TGCCTCAGCCTCTTCTCATT-3’;TNF-α下游引物為5’-GCTTGGTGGTTTGCTACGAC-3’;擴展長度為208 bp。GAPDH上游引物為5’- TGAACGGGAAGCTCACTGG -3’; GAPDH下游引物為5’- GCTTCACCACCTTCTTGATGTC -3’;擴增長度為120 bp。實時PCR反應中反轉錄反應體系為:總RNA 8 μL,隨機引物1 μL,2×ES Reaction Mix 10 μL,RT/RI Enzyme Mix 1 μL,總體積20 μL。擴增體系為:2×UltraSYBR Mixture(with ROX)10 μL,上游引物(10 μmol/L)1 μL,下游引物(10 μmol/L)1 μL,cDNA 8 μL,總體積20 μL。RT-PCR反應程序參數:預變性95 ℃ 10 min;變性95 ℃ 15 s,退火58 ℃ 20 s,延伸72 ℃ 27 s,40個循環。用ABI 7300 Real-Time PCR System (Applied Biosystems,Foster City,CA,USA)檢測并計算目的基因表達量與內參GAPDH比較的相對值(RQ值),結果用于統計分析。
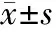
2 結 果
2.1大鼠大腦皮質小膠質細胞的形態學表現 無血清培養液孵育的小膠質細胞呈分枝狀外觀,胞體較小,有細長的突起(箭頭),細胞表達IBA-1,見圖1(標尺為25 μm)。含LPS的無血清培養液孵育的小膠質細胞處于活化狀態,胞體變為圓形和阿米巴狀,突起回縮,IBA-1染色加深(箭頭),見圖2。提前加入NPY再加入LPS的無血清培養液孵育的小膠質細胞大部分為非活化狀態,成多角形,有長的突起(箭頭),IBA-1染色陽性,但比LPS組熒光強度明顯弱,見圖3。各組IBA-1染色陽性細胞均大于90%。
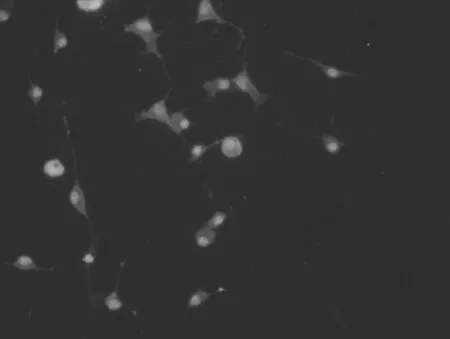
圖1 無血清培養基孵育的IBA-1染色后的小膠質細胞 (400×)
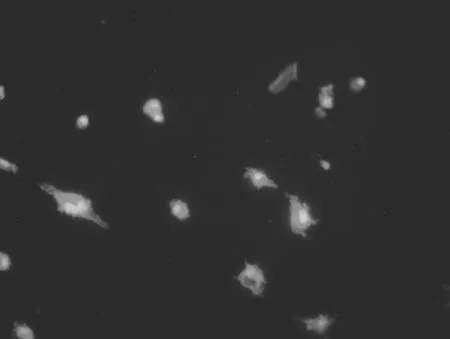
圖2 含LPS的無血清培養基孵育的IBA-1染色后的小膠質細胞(400×)
圖3 含LPS和NPY的無血清培養基孵育的IBA-1染色后的小膠質細胞(400×)
2.2 培養液中TNF-α蛋白含量及小膠質細胞中TNF-α mRNA表達水平的變化 孵育各組小膠質細胞 6 h后,LPS組和IBP3226+NPY+LPS組培養液中TNF-α蛋白含量及小膠質細胞中TNF-α mRNA表達水平均顯著高于對照組(P均<0.05),LPS組和IBP3226+NPY+LPS組比較差異均無統計學意義;LPS+NPY組培養液中TNF-α蛋白含量及小膠質細胞中TNF-α mRNA表達水平均顯著低于LPS組和IBP3226+NPY+LPS組(P均<0.05)。見表1。

表1 各組培養基中TNF-α蛋白含量及小膠質細胞中TNF-αmRNA相對表達量比較
注:①與對照組比較,P<0.05;②與LPS+NPY組比較,P<0.05。
3 討 論
自從Besedovsky 提出了免疫-神經-內分泌調節網絡學說以來,免疫在神經系統疾病中的作用受到人們越來越多的關注。小膠質細胞廣泛分布于中樞神經系統,在免疫功能調節方面起著重要作用。當中樞神經系統發生病理變化時,小膠質細胞能夠迅速做出反應,由靜止狀態變為激活狀態,胞體變大,成阿米巴狀,特異性標志產物增加,吞噬能力增強。很多資料顯示小膠質細胞激活和中樞神經系統很多疾病有關,如阿爾茨海默病、帕金森綜合征、腦缺血等中樞神經系統病變[9-10]。小膠質細胞活化后產生大量細胞因子等生物活性物質,如IL-1β、TNF-a、NO等,這些物質的大量積聚會對神經元產生毒害作用,這可能是小膠質細胞活化后導致神經元損傷的重要途徑之一。TNF-α是最常見的損傷性細胞因子,也是小膠質細胞激活后釋放的前炎癥因子,在中樞神經系統多種生理和病理過程中發揮著重要作用。
人體內的神經肽類物質與炎癥反應有著較密切的關系。當體內出現炎癥反應時會釋放一些神經肽類物質,如血管活性腸肽、尿皮質素、胃饑餓素(ghrelin)等[11-13],這些神經肽類物質可以下調機體的免疫應答,誘導T細胞的產生,抑制抗原特異性Th1細胞分化,維持機體免疫耐受,減輕炎癥反應[14-16]。NPY是一種廣泛存在于中樞神經系統中的神經肽,與癲癇、學習、記憶、攝食和內分泌有著密切關系。NPY通過與不同的受體結合在體內發揮不同的作用,NPY受體都屬于G蛋白的耦聯受體,在人體內包括Y1、Y2、Y3、Y4、Y5 5種亞型。其Y1受體與機體免疫功能的調節有著密切關系,NPY通過其Y1受體影響細胞遷移、細胞因子的釋放、抗體的產生等多個方面[17]。在不同的部位,不同的免疫進程階段,NPY可能起的作用也不盡相同。周江睿等[18]對原代培養的腹腔巨噬細胞和RAW264.7細胞的研究顯示,NPY對炎癥因子的調節具有雙面性:一方面,NPY能夠抑制腹腔巨噬細胞釋放炎性因子IL-1β、TNF-α、IL-6 和前列腺素B2;另一方面,NPY能夠促進腹腔巨噬細胞晚期炎癥因子HMGB1的分泌。Ferreira等[19-20]的研究表明,小鼠小神經膠質細胞株N9細胞表達NPY Y1受體,NPY可以抑制LPS所致N9細胞的激活,減少IL-1β、NO的生成,另一方面,NPY還能抑制N9細胞的吞噬作用和遷移能力,當阻斷NPY Y1受體后,這種抑制作用消失。本實驗采用LPS為小膠質細胞的激活劑,在LPS處理小膠質細胞6 h后,小膠質細胞處于明顯的活化狀態,細胞體積增大,突觸回縮,由分支狀變為圓形、梭形或者阿米巴狀,特征性標志物IBA-1免疫染色加深,小膠質細胞的免疫活性也隨之增強,小膠質細胞培養液中TNF-α蛋白含量與小膠質細胞中TNF-α mRNA表達水平均明顯增高。加入NPY后能夠明顯抑制LPS對小膠質細胞的激活作用,使大部分小膠質細胞處于非活化狀態,降低了小膠質細胞培養液中TNF-α蛋白和小膠質細胞內的TNF-α mRNA表達水平,使用BIBP3226阻斷NPY Y1受體后這種抑制作用完全消失,說明NPY是通過Y1受體起到降低小膠質細胞的免疫活性,減少小膠質細胞來源的TNF-α產生的,這與文獻[19-20]研究N9細胞株的結果一致。NPY處理非活化的小膠質細胞后,培養液中TNF-α蛋白及小膠質細胞的TNF-α mRNA水平均未發生明顯變化,說明NPY對靜止期的小膠質細胞影響不大。
綜上所述,NPY對中樞神經系統內的小膠質細胞的免疫活性有調節作用,NPY能下調中樞神經系統內小膠質細胞的免疫活性,抑制TNF-α的產生,這種作用是通過其Y1受體實現的。本研究為NPY以小膠質細胞為靶點治療與免疫有關的中樞神經系統疾病提供了實驗依據。
[1] Wu CY,Kaur C,Sivakumar V,et al.Kv1.1 expression in microglia regulates production and release of proinflammatory cytokines,endothelins and nitric oxide[J].Neuroscience,2009,158(4):1500-1508
[2] Mayer AM,Clifford JA,Aldulescu M,et al.Cyanobacterial Microcystis aeruginosa lipopolysaccharide elicits release of superoxide anion,thromboxane B2,cytokines,chemokines,and matrix metalloproteinase-9 by rat microglia[J].Toxicol Sci,2011,121(1):63-72
[3] Auvin S,Mazarati A,Shin D,et al.Inflammation enhances epileptogenesis in the developing rat brain[J].Neurobiol Dis,2010,40(1):303-310
[4] Friedman A,Dingledine R.Molecular cascades that mediate the influence of inflammation on epilepsy[J].Epilepsia,2011,52(s3):33-39
[5] Vezzani A,Maroso M,Balosso S,et al.IL-1 receptor/Toll-like receptor signaling in infection,inflammation,stress and neurodegeneration couples hyperexcitability and seizures[J].Brain Behav Immun,2011,25(7):1281-1289
[6] Noe F,Nissinen J,Pitk?nen A,et al.Gene therapy in epilepsy: the focus on NPY[J].Peptides,2007,28(2):377-383
[7] Ferreira R,Xapelli S,Santos T,et al.Neuropeptide Y modulation of interleukin-1β (IL-1β)-induced nitric oxide production in microglia[J].J Biol Chem,2010,285(53):41921-41934
[8] Nakajima K,Takemoto N,Kohsaka S.Retinoic acid enhances the secretion of plasminogen from cultured rat microglia[J].Febs Lett,1992,314(2):167-170
[9] Marinova-Mutafchieva L,Sadeghian M,Broom L,et al.Relationship between microglial activation and dopaminergic neuronal loss in the substantia nigra:a time course study in a 6-hydroxydopamine model of Parkinson's disease[J].J Neurochem,2009,110(3):966-975
[10] Arranz AM,Gottlieb M,Pérez-Cerdá F.Increased expression of glutamate transporters in subcortical white matter after transient focal cerebral ischemia[J].Neurobiol Dis,2010,37(1):156-165
[11] Anderson P,Gonzalez-Rey E.Vasoactive intestinal peptide induces cell cycle arrest and regulatory functions in human T cells at multiple levels[J].Mol Cell Biol,2010,30(10):2537-2551
[12] Gonzalez-Rey E,Delgado M.Vasoactive intestinal peptide inhibits cycloxygenase-2 expression in activated macrophages,microglia,and dendritic cells[J].Brain Behav Immun,2008,22(1):35-41
[13] Gonzalez-Rey E,Ganea D,Delgado M.Neuropeptides: keeping the balance between pathogen immunity and immune tolerance[J].Curr Opin Pharmacol,2010,10(4):473-481
[14] Delgado M,Ganea D.Anti-inflammatory neuropeptides:a new class of endogenous immunoregulatory agents[J].Brain Behav Immun,2008,22(8):1146-1151
[15] Dello Russo C,Lisi L,Navarra P,et al.Diverging effects of cortistatin and somatostatin on the production and release of prostanoids from rat cortical microglia and astrocytes[J].J Neuroimmunol,2009,213(1):78-83
[16] Prasse A,Zissel G,Lützen N,et al.Inhaled vasoactive intestinal peptide exerts immunoregulatory effects in sarcoidosis[J].Am J Respir Crit Care Med,2010,182(4):540-548
[17] Wheway J,Herzog H,Mackay F.NPY and receptors in immune and inflammatory diseases[J].Curr Top Med Chem,2007,7(17):1743-1752
[18] 周江睿,蔣春雷.神經肽Y對巨噬細胞炎癥因子和小分子炎癥介質的調節及機制研究[D].上海:第二軍醫大學,2012
[19] Ferreira R,Santos T,Cortes L,et al.Neuropeptide Y inhibits interleukin-1 beta-induced microglia motility[J].J Neurochem,2012,120(1):93-105
[20] Ferreira R,Santos T,Viegas M,et al.Neuropeptide Y inhibits interleukin-1b-induced phagocytosis by microglial cells[J].J Neuroinflammation,2011,8:169
Effect of NPY on the biological activity of microglia and production of TNF-α in these cells
LI Qijun1,WU Yongbo2,CHANG Junying1,HOU Weixing1,XING Zhaoguo1,WANG Yanzhi1,MU Weilu1,LI Yan1,JIA Dongzhao1,ZHANG Shuli3
(1.The Third Hospital of Shijiazhuang,Shijiazhuang 050011,Hebei,China; 2.Forensic Damage Identification Room,the Public Security Bureau of Shijiazhuang,Shijiazhuang 050011,Hebei,China; 3.Orthopedic Hospital of Qinhuangdao,Qinhuangdao 066001,Hebei,China)
Objective It is to explore the effect of NPY on biological activity of primary microglia and the production of TNF-α in the rats.Methods Primary cerebral cortical microglia were cultured and treated with LPS and NPY.Then they were stained by immunocytochemistry staining and the morphological characteristics of microglia was observed with microscope.The microglia were divided into control group,LPS group,NPY+LPS group,NPY group and BIBP3226+NPY+LPS group.Every group had 3 samples and the the cells were cultured for 6 h.The protein levels of TNF-α in the culture media and the mRNA expression levels of TNF-α in the microglia cells of different groups were detected with the methods of ELISA and RT-PCR respectively.Results The microglia treated with LPS kept active,the activity of microglias treated with NPY was lower.The contents of TNF-α in the culture media and the mRNA expression levels of TNF-α in the cells of LPS group increased remarkably compared with control group(P<0.05).Compared with LPS group,the contents of TNF-α in the culture media and the mRNA expression levels of TNF-α in the cells of LPS+NPY group reduced obviously.Compared with LPS+NPY group,the contents of TNF-α in the culture media and the mRNA expression levels of TNF-α in the cells of BIBP3226+NPY+LPS group rose outstandingly (P<0.05).Conclusion NPY can restrain the biological activity of microglia cells.NPY can reduce the production of TNF-α of microglia cells,Activation of NPY Y1 recepter on the microglia cells may be one of the reasons.
neuropeptide Y; microglia; TNF-α
李琦軍,男,副主任醫師,博士,從事創傷骨科研究工作。
邢兆國,E-mail:13832121438@163.com
10.3969/j.issn.1008-8849.2015.13.006
R-332
A
1008-8849(2015)13-1384-04
2014-10-10

