改良人原代臍靜脈內皮細胞的分離及鑒定*
?
改良人原代臍靜脈內皮細胞的分離及鑒定*
網絡出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20150113.1849.012.html
崔麗麗, 余芳芳, 左麗**
(貴陽醫學院 免疫學教研室, 貴州 貴陽550004)
[摘要]目的: 優化人臍靜脈內皮細胞(HUVECs)的分離及培養方法。方法: 在傳統HUVECs分離的基礎上進行改進,通過Ⅰ型膠原酶消化分離HUVECs,利用倒置顯微鏡觀察其生長狀況、免疫組織化學方法及流式細胞術檢測所培養細胞的純度。結果: 改良實驗步驟和精簡操作后,HUVECs分離不受影響,分離的HUVECs在體外2~4 d可長成單層,倒置顯微鏡下可見細胞呈“鵝卵石”狀排列,Ⅷ因子免疫組化實驗陽性,流式細胞術檢測細胞純度達99.37%。結論: 用膠原酶消化法分離HUVECs具有培養周期短,所獲得的HUVECs純度較高的優點,有利于體外血管內皮細胞模型的建立。
[關鍵詞]內皮,血管; 臍靜脈; 免疫組織化學; 細胞培養; 細胞分離; 流式細胞術
血管是人體的重要器官,血管內皮細胞(vascular endothelial cell,VECs)是覆蓋其內膜表面的單層扁平或多角形的細胞。VECs既是感應細胞又是效應細胞,不僅能感知血液中的炎性信號、激素水平、切應力及壓力等信息,而且能通過分泌多種血管活性物質對這些信息作出反應。血管內皮細胞在生理止血、血管滲透及血管對于其他生理性和病理性刺激做出的反應中起重要的作用[1-6]。血管內皮細胞的培養是體外研究大血管內皮細胞功能的重要手段。Jaffe等[7]首次從人臍靜脈中分離出內皮細胞(ECs)并在體外培養成功后,人臍靜脈內皮細胞(human umbilical vein endothelial cell, HUVECs) 作為體外研究 ECs 的模型受到研究者的關注。新生兒臍帶由于取材方便,來源充足,而成為體外內皮細胞實驗的主要材料。本實驗采用改良的膠原酶消化法分離培養HUVECs、免疫組化法對其進行鑒定及流式細胞術檢測純度,通過改良方法可大量獲得純度較高的血管內皮細胞。
1材料與方法
1.1材料
1.1.1標本來源與采集
標本均來自于正常足月娩出的新生兒臍帶。配制含0.49%葡萄糖的PBS緩沖液150 mL裝于已泡酸處理的250 mL玻璃瓶中,4 ℃保存待用。取臍帶時將臍帶無菌條件下浸入瓶中,運輸時加冰袋保持低溫,取材后3 h內完成對HUVECs處理。
1.1.2主要試劑與儀器
M199/EBSS培養液(Hyclone)、胎牛血清(Gibico 公司, 美國)、Ⅰ型膠原酶(Sigma,美國)、Hanks液(corning公司,美國)、0.25%胰蛋白酶(Hyclone)、 內皮細胞生長添加物(ECGS, Sciencell 公司, 美國) , 雙抗(Hyclone)、肝素納、明膠, 兔抗人Ⅷ因子相關抗原抗體(北京中杉金橋生物技術有限公司,中國) , FITC-抗人 CD31 抗體 (Abcam公司, 美國) 。倒置顯微鏡(NIKON 公司, 日本) , 超凈工作臺(蘇州凈化設備有限公司, 中國) , 體積分數5%的CO2培養箱 (Thermo,美國) , 離心機(Thermo,美國) , 流式細胞儀(Beckman公司, 美國) 。
1.2方法
1.2.1HUVECs分離、培養
取新生兒臍帶約20 cm,剔除血腫以及壞死出血部位,用7號輸液器針頭插入臍靜脈一端,止血鉗固定,用4 ℃預冷的PBS 100 mL沖洗臍靜脈完全去除紅細胞。夾閉臍帶另一端,注入37 ℃預溫處理(用Hanks液配制)的0.1%I型膠原酶10 mL于臍靜脈內,用手輕揉按摩臍帶,使其分布均勻,消化充分,將裝有臍帶的無菌鋁盒放入5% CO2溫箱37 ℃孵育15 min。用50 mL無菌離心管收集臍靜脈內的消化液, PBS反復沖洗臍靜脈,沖洗液也收集于50 mL無菌離心管中,800 r/min離心5 min,棄上清,沉淀即為HUVECs。往沉淀加入M199培養液(含10%胎牛血清、50 mg/L ECGS、100 U/mL 青霉素、100 Ug/mL 鏈霉素及0.1 g/L肝素),重懸細胞沉淀,接種于用明膠包被的T25細胞培養瓶明膠(提前1 d用明膠包被,用前用PBS緩沖液洗滌1~2次),放入5% CO2培養箱37 ℃培養,24 h后全量換液,此后1~2 d換液1次,直至細胞80%~90%融合。
1.2.2HUVECs傳代培養
原代內皮細胞融合至80%~90%后,棄去培養液,用PBS洗滌2~3次,加入0.25%胰蛋白酶1 mL 37 ℃消化5 min,鏡下觀察細胞皺縮變圓,彼此分離或大片狀分離時加入3~4倍胰酶體積的M199培養液(含10%胎牛血清)終止消化,重懸細胞后繼續培養。
1.2.3HUVECs的鑒定方法
1.2.3.1HUVECs形態鑒定用倒置顯微鏡每天鏡下觀察細胞的形態。
1.2.3.2Ⅷ因子相關抗原檢測將HUVECs懸液接入96孔板,100 μL/孔(105個/孔),細胞長滿時,采用免疫組織化學法鑒定Ⅷ因子相關抗原,一抗為兔抗人內皮細胞Ⅷ因子相關抗原多克隆抗體(稀釋比例為1∶50),陰性對照為BHK細胞,空白對照用PBS。
1.2.3.3流式細胞術檢測取2瓶基本長滿的HUVECs,用0.25%胰蛋白酶消化,離心棄上清。加入10%胎牛血清重懸細胞,室溫或4 ℃孵育15 min,用PBS洗滌1次,離心后用1 200 μL PBS將細胞重懸,均分為3份。1份加入5 μL FITC標記抗CD31抗體作為檢測組;1份作為陰性,不加任何抗體;1份作為同型對照,加入5 μL相關同型抗體(eBioscience,鼠 IgG1,κ,FITC)。3份樣品均4 ℃孵育30 min, PBS洗滌2次,重懸細胞,上機檢測CD31表達。
2結果
2.1HUVECs形態
接種分離原代HUVECs 4 h 后,細胞開始貼壁生長, 1~2 d后融合成片, 即原代培養的周期為2~3 d。 第1天見細胞呈梭形,成團貼壁,逐漸向外擴散生長,呈單層, 胞核呈圓形或橢圓形,呈“鵝卵石”狀排列(圖1)。
2.2Ⅷ因子相關抗原檢測
免疫組織化學染色示,細胞呈圓形、梭形或多邊形, 胞漿內含有棕黃色顆粒,此為Ⅷ因子陽性特征,證實為內皮細胞(圖2)。

原代培養24 h 原代培養第2天圖1 原代HUVECs培養(100×)Fig.1 Primary culture of HUVECs
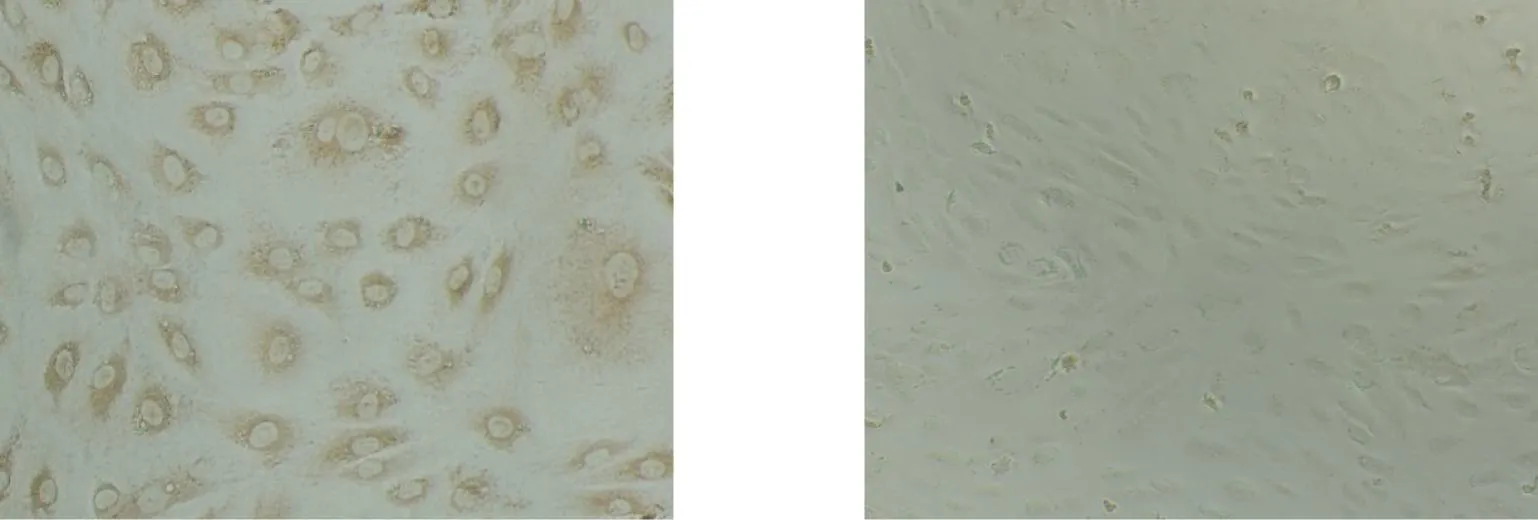
Ⅷ因子陽性(HUVEC) 陰性對照 (BHK)圖2 免疫組化鑒定HUVECs(100×)Fig.2 Identification of HUVECs with immunohistochemisty
2.3流式細胞術檢測 血管內皮細胞強表達于CD31是另一特征性表現。目前,國內外普遍采用CD31作為指示血管內皮細胞細胞的指標。流式細胞結果顯示,HUVECs表面高表達CD31分子,紅色為同型對照,綠色為檢測的樣本,99.37%的細胞表面抗原CD31表達陽性,表明所分離培養的HUVECs純度高達99.37%(圖3)。

圖3 HUVECs表面CD31表達Fig.3 Expression of CD31 on the surface of HUVECs
3討論
1973年 Jaffe等[7]首次報道了內皮細胞體外培養的方法,隨后大批學者對內皮細胞的培養方法進行了一系列的改進和創新[8-9]。但由于影響內皮細胞生長的因素較多,原代HUVECs的獲得率較低,且傳代次數有限。本研究通過總結前人的方法,改進了HUVECs提取方法,獲得了較高純度的原代HUVECs,要點如下:(1)臍帶采用含葡萄糖的PBS緩沖液保存在 4 ℃進行運輸,取材后3 h內完成對HUVECs處理,保護了臍靜脈內皮細胞的活性,提高了臍靜脈內皮細胞的獲得率;(2)采用Ⅰ型膠原酶進行消化,膠原酶較溫和,對內皮細胞的損傷較少,可獲得數量較多的內皮細胞,對HUVECs貼壁生長無太大的影響,克服了傳統方法采用胰蛋白酶消化對于內皮細胞的損傷較大的缺點;(3)采用含10%胎牛血清的M199培養液,并加入ECGS及肝素,可促進內皮細胞的生長,增殖及貼壁[10-11],使內皮細胞在1~2 d有90%融合長成單層細胞;(4)細胞傳代用含EDTA的0.25%胰蛋白酶消化5 min,立即加入胰蛋白酶體積3~4倍10%胎牛血清的M199培養液終止消化,減少了細胞的損傷;(5)用明膠包被細胞培養瓶可以促進內皮細胞的貼壁性;(6)本研究在傳代過程中發現原代HUVECs傳至第5代后形態有所改變,貼壁性較差的現象,采用細胞傳代至第5代時進行研究,即可保持細胞的活性,還可保證實驗結果真實可靠。
本研究獲得的原代HUVECs,鏡下細胞呈長梭形,以“鵝卵石”狀排列,免疫組織化學染色示細胞呈圓形、梭形或多邊形, 胞漿內含有棕黃色顆粒,流式細胞術檢測細胞表面抗原CD31表達陽性高達99.37%,成功分離并獲得大量純度較高的HUVECs。為HUVECs模型模型的建立提供更加簡便宜、快速的方法。
參考文獻4
[1] Xiao L, Liu Y, Wang N. New paradigms in inflammatory signaling in vascular endothelial cells[J]. Am J Physiol Heart Circ Physiol, 2014(306):H317-H325.
[2] Sena CM, Pereira AM, Seica R. Endothelial dysfunction-a major mediator of diabetic vascular disease[J].Biochim Biophys Acta (BBA)-Mol Basis Dis, 2013(1832):2216-2231.
[3] Sumpio BE, Riley JT, Dardik A.Cells in focus: endothelial cell[J]. International Journal of Biochemistry & Cell Biology, 2002(34):1508-1512.
[4] Deanfield JE, Halcox JP, Rabelink TJ. Endothelial function and dysfunction: testing and clinical relevance[J]. Circulation, 2007(115): 1285-1295.
[5] Cines DB, Pollak ES, Buck CA, et al. Endothelial cells in physiology and in the pathophysiology of vascular disorders[J]. Blood, 1998(91):3527-3561.
[6] Trung DT,Wills B.Systemic vascular leakage associated with dengue infections the clinical Perspective[J].Curr Top Microbiol Immunol, 2010(338):57-66.
[7] Jaffe EA. Culture of human endothelial cells derived from umbilical veins[J]. Clin Invest, 1973(52):2754.
[8] 張寶庚,陳鐵鎮,張晶范.人臍帶靜脈及大鼠主動脈內皮細胞的培養[J].中華心血管病雜志, 1985(1):52-54.
[9] Crampton SP, Davis J, Hughes CC. Isolation of human umbilical vein endothelial cells (HUVEC)[J].J Vis Exp, 2007(3):183.
[10]余繼海,許戈良,傅斌生.人臍靜脈內皮細胞的培養及鑒定 [J].安徽醫學, 2003(24):4-6.
[11]錢勇,張勵.內皮細胞生長因子和肝素對人臍靜脈內皮細胞增殖的影響[J].眼科研究, 2003(21):26-28.
(2014-09-08收稿,2014-10-15修回)
Improved Isolation and Identification of Primary Vascular
Endothelial Cells from Human Umbilical Veins
CUI Lili, YU Fangfang, ZUO Li
(TeachingDivisionofImmunology,GuiyangMedicalCollege,Guiyang550004,Guizhou,China)
[Abstract]Objective: To optimize the isolation and nurturing method of the human umbilical vein endothelial cell (HUVECs), to conclude identification methods of HUVEC. Method: Improving the traditional isolation of HUVECs, isolating HUVECs by type I collagenase. Then the growth of cells was observed under an inverted microscope, the cultured cells were identified by immunocytochemistry, and the purity of cells was identified by flow cytometry. Result: Improved experimental procedures and simplified the operation, the isolation of HUVECs was not affected, the primary HUVECs began to grow into a single layer about 2~4 days in vitro, arrayed like "cobblestone"shape under the inverted microscope.Ⅷ factor in the HUVECs showed positive reaction by immunocytochemistry, the purity was 99.37% by flow cytometry. Conclusions: Collagenase procedure is convenient and high purified HUVECs can be acquired. It can successfully establish the model for endothelial cells.
[Key words]endothelium, vascular; umbilical veins; immunocytochemistry; cell culture; cell separation;flow cytometry
[中圖分類號]R329.2
[文獻標識碼]A
[文章編號]1000-2707(2015)01-0020-04
通信作者**E-mail:zuoligymc@163.com網絡出版時間:2015-01-13
[基金項目]*國家自然科學基金 (31260224)

