組蛋白去乙酰化酶1、7在腎癌組織中的表達及臨床意義探討
組蛋白去乙酰化酶1、7在腎癌組織中的表達及臨床意義探討
劉婷婷1,左文東2,宋立友3, 晉學飛4
(1.吉林省軍隊離退休干部療養中心,吉林 長春130000;2.吉林省前衛醫院;
3.吉林省腫瘤醫院;4.吉林大學中日聯醫院)
腎癌是泌尿外科常見的惡性腫瘤之一,又叫腎細胞癌或腎腺癌,是一種起源于腎小管上皮細胞的腎實質性腫瘤。目前,對于腎癌的發病機制,國內外仍無統一意見,但都認同腎癌的發生是多因素共同參與形成的[1]。組蛋白去乙酰化酶(HDAC)是一種蛋白酶,在人體內主要控制染色體的結構修飾和調節并控制基因的表達。在細胞核中,組蛋白的乙酰化和去乙酰化的速率大致相同,處于動態平衡,其速率就是由組蛋白乙酰化轉移酶(HAT)和組蛋白去乙酰化酶(HDAC)共同調控的。HDAC-1在細胞周期中,主要起到控制細胞周期和轉錄因子的分化與增殖;HDAC-7近年來在多種腫瘤中都發現了其有過表達的情況,王君等人認為HDAC-7可以作為診斷腎癌的腫瘤標記物之一,并且可以檢測其預后情況[2]。本次研究著重探討HDAC-1和HDAC-7在腎癌組織中的表達情況及其臨床意義,現將研究結果報道如下。
1材料與方法
1.1 一般資料
隨機選取2013年1月至7月期間,我院泌尿外科收治的、經術后病理檢查確診為腎癌的患者67例。其中男性44例,女性23例,年齡范圍48-72歲,平均年齡(57.3±9.6)歲。透明細胞癌51例,顆粒細胞癌9例,混合細胞癌5例,未分化細胞癌2例。根據臨床TNM分期,Ⅰ期12例,Ⅱ期15例,Ⅲ期29例,Ⅳ期11例。根據病理分級標準:Ⅰ級為分化良好,Ⅱ級為中等分化,Ⅲ級為分化不良,其中Ⅰ級24例,Ⅱ級28例,Ⅲ級15例。
1.2 研究方法
術中尋找目標瘤體,沿瘤體邊緣選取無壞死的腫瘤組織,取2-4 mm作為病例標本[3],在癌旁取正常組織2-4 mm作為正常標本,用液氮保存,送檢。如不能及時送檢,將標本保存在-80℃的冰柜內。
標本用10%的甲醛固定,脫水、包埋,做厚度為3 μm的切片3-5張。采用免疫組織化學法(S-P法)對標本切片進行染色,切片脫蠟、水化后,用3%的過氧化氫溶液對過氧化物酶進行阻斷,持續15 min。HDAC-1選取鼠抗人HDAC-1單抗,HDAC-7選取兔抗人HDAC-7單抗,陰性對照選用濃度為1%的PBS緩沖液作為一抗,利用蘇木精復染后,用DAB試劑盒顯色后用顯微鏡觀察標本切片。所有試劑盒均購自上海研晶生物科技有限公司,所有操作均按照相應說明書嚴格進行操作。
陽性表達判定方法:細胞染色標準:在細胞漿內出現淺黃色、棕黃色或黃褐色顆粒為染色細胞。在400倍光學顯微鏡下,每張切片隨機選取4個視野,每個視野對1000個細胞進行染色計數,觀察每個標本的所有切片,計算平均染色細胞數,作為該例標本的染色數量。陰性(-):染色細胞數量<25%;弱陽性(+):染色細胞數量在25%-75%;強陽性(++):染色細胞數量>75%。所有標本標本均由兩位病理專家獨立審閱并給出結果,當兩位專家意見不一致時,請第三位專家獨立給予判定。陽性率=(表達陽性標本數+表達強陽性標本數)/該組總標本數×100%。
1.3 統計學方法
采用SPSS 20.0軟件對所有實驗所得數據進行處理,對計數資料用卡方檢驗,對計量資料用t檢驗,組間比較采用秩和檢驗,取α=0.05作為檢驗水準。
2結果
2.1 HDAC-1和HDAC-7在腎癌組織和癌旁正常組織中的表達情況
絕大部分腎癌組織中觀察到了HDAC-1和HDAC-7的表達情況。HDAC-1染色顆粒主要出現在細胞漿內,HDAC-7染色顆粒主要出現在腎小管上皮細胞細胞核中,還有部分出現在腎小球上皮細胞細胞核中。HDAC-1在腎癌組織中的陽性表達率為80.60%,其中弱陽性21例,強陽性33例,而正常組織中只有7例表達弱陽性,其余均為陰性表達,HDAC-1在腎癌組織中的陽性表達率顯著高于正常組織(P<0.05)。HDAC-7在腎癌組織中陽性表達率為61.19%,其中弱陽性29例,強陽性12例,在正常組織中僅有8例表達弱陽性,其余均表達陰性,HDAC-7在腎癌組織中的陽性表達率顯著高于正常組織(P<0.05)。
2.2 不同臨床分期HDAC-1和HDAC-7的表達情況
13例陰性表達的HDAC-1主要集中在臨床分期為Ⅰ期和Ⅱ期的標本中,分別有7例和6例,而Ⅲ期和Ⅳ期標本中HDAC-1全部為陽性表達,隨著臨床分期的提高,HDAC-1的陽性表達率也隨之升高,組間比較具有顯著差異(P<0.05)。Ⅰ期和Ⅱ期的標本中,HDAC-7多為陽性表達,在Ⅲ期和Ⅳ期標本中,HDAC-7多為陰性表達,隨著臨床分期的提升,HDAC-7的陽性表達率也隨之下降,組間具有統計學差異(P<0.05),見表1。
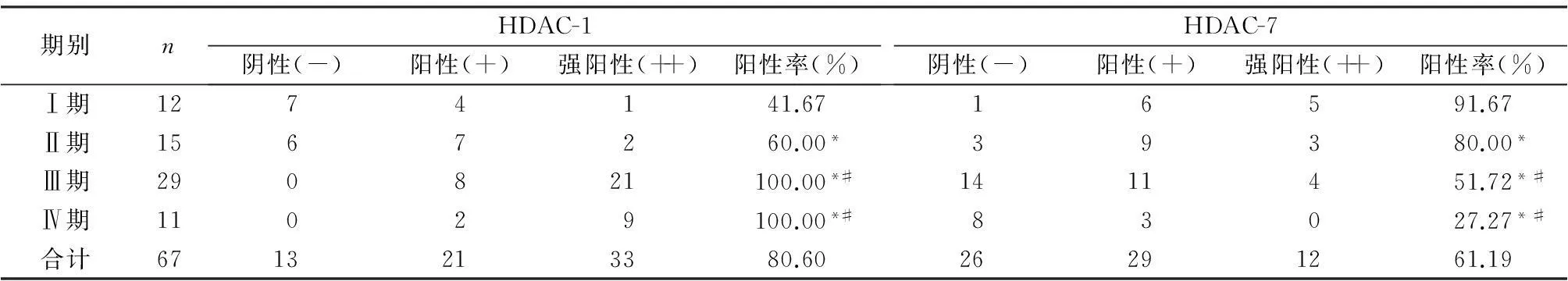
表1 不同臨床分期HDAC-1和HDAC-7的表達情況(n)
注:與Ⅰ期比較,*P<0.05;與Ⅱ期比較,#P<0.05
2.3 不同病理分級HDAC-1和HDAC-7的表達情況
病理分級為Ⅰ級的標本中,僅有約1/2的標本HDAC-1表達陽性,而病理分級為Ⅱ級和Ⅲ級的標本中,絕大部分標本HDAC-1呈陽性表達,隨著病理分級的提高,HDAC-1的陽性表達率也隨之提高,組間具有統計學差異(P<0.05)。病理分級為Ⅰ級的標本中,絕大多數標本HDAC-7呈陽性表達,隨著病理分級的提高,HDAC-1的陽性表達率隨之降低,組間具有統計學差異(P<0.05),見表2。
注:與Ⅰ級比較,*P<0.05;與Ⅱ級比較,#P<0.05
3討論
組蛋白去乙酰化酶(HDAC)是一種類蛋白酶,其主要功能是在細胞染色體修飾過程中和基因表達時發揮調節作用,同時對組蛋白的去乙酰化過程起到調控作用,使之與組蛋白的乙酰化速率接近,從而達到一個動態平衡[4,5]。根據與酵母菌的同源性,HDAC可以分為三型,HDAC-1屬于Ⅰ型,HDAC-7屬于Ⅱ型。近年來,HDAC-1在多種腫瘤中(如結腸癌、乳腺癌、前列腺癌等)被發現有高表達的情況,Yu J等人在研究中發現,HDAC-1有促進腫瘤細胞增殖的能力,并且與腫瘤細胞對周圍組織的浸潤和向遠處轉移有密切關系[6]。作為第一個在哺乳類動物細胞中發現的HDAC,HDAC-1被認為具有調節基因轉錄的動能。魏曙光等人在研究中發現,HDAC-1幾乎參與了整個細胞周期,并且,HDAC-1可以通過對線粒體轉位的控制,來促進癌基因的活化和表達[7]。而Takashi等人在對腫瘤細胞中HDAC-1進行干涉的實驗中發現,缺少HDAC-1的腫瘤細胞,有絲分裂過程會被抑制,取而代之的是Caspase-3的激活,這種改變可以直接導致腫瘤細胞進入凋亡程序,故提出了HDAC-1抑制劑來治療腫瘤的新觀點[8]。HDAC-7在體內的作用是與肌細胞結合因子-2(MEF-2)結合,對MMP-10(基質金屬蛋白酶-10)的表達起到抑制作用,MMP-10可以講解細胞外基質,這種作用在血管內皮細胞尤為明顯[9]。HDAC-7通過上述作用將內皮細胞和平滑肌細胞緊密的連接。Glaser在研究中發現,若HDAC-7的表達發生障礙,則內皮細胞和平滑肌細胞之間的粘附作用會大大降低[10]。本次研究著重探討HDAC-1和HDAC-7在腎癌組織中的表達情況,為腎癌的治療提供新思路。
從本次研究的結果中可以看出,腎癌組織中HDAC-1和HDAC-7的陽性表達率均顯著高于正常組織(P<0.05),正常組織中未發現HDAC-1和HDAC-7有強陽性表達,僅有7例和8例的陽性表達。而在對不同臨床分期和病理分級的腫瘤標本的檢查中發現,隨著臨床分級和病理分期的提高,HDAC-1的陽性表達率逐漸升高,而HDAC-7的陽性表達率逐漸下降。可以認為HDAC-1在腫瘤發生發展過程中起到了一定作用,正是由于HDAC-1的高表達,才使得抑癌基因被抑制,而原癌基因被激活,隨著腫瘤的生長,HDAC-1的表達越來越強烈,可能是腫瘤產生了某種刺激HDAC-1表達的因子,兩者互成因果。本次研究只對HDAC-1的表達做了定性研究,至于其定量檢測可不可以作為腎癌診斷和評估預后的標志,還有待進一步研究。本次研究結果還發現,隨著臨床分期和病理分級的提高,HDAC-7的陽性表達率隨之降低。這說明HDAC-7的陽性表達率與腫瘤的自然病程和惡性程度均相關。腫瘤細胞生長十分迅速,而當其向遠處發生轉移時,需要有血管的支持,而HDAC-7的陽性表達率逐漸降低,可能腫瘤血管向外發生轉移時的一種特殊變化,也可以認為有其它的促癌因素抑制了HDAC-7的表達。
綜上,HDAC-1和HDAC-7在腎癌組織中的表達陽性率顯著高于正常腎組織;臨床分期和病理分級越高,HDAC-1表達陽性率越高,HDAC-7表達陽性率越低。HDAC-1和HDAC-7可能是促進腎癌形成的一種因子。
參考文獻:
[1]Anja Lachenmayer,Sara Toffanin,Laia Cabellos,et al.Combination therapy for hepatocellular carcinoma:Additive preclinical efficacy of the HDAC inhibitor panobinostat with sorafenib[J].Journal of Hepatology,2012,56(6):1552.
[2]王君.HDAC7在腎癌組織中的表達及其臨床意義[D].安徽醫科大學,2012.
[3]Kurundkar Deepali,Srivastava Ritesh K,Chaudhary Sandeep C,et al.Vorinostat,an HDAC inhibitor attenuates epidermoid squamous cell carcinoma growth by dampening mTOR signaling pathway in a human xenograft murine model.[J].Toxicology and Applied Pharmacology,2012,266(2):1025.
[4]王勇.組蛋白乙酰基轉移酶MYST1與腎細胞癌關系的研究[D].吉林大學,2013.
[5]A.Iglesias-Linares,R.M.Yaez-Vico,M.A.González-Moles.Potential role of HDAC inhibitors in cancer therapy:Insights into oral squamous cell carcinoma[J].Oral Oncology,2010,46(5):2469.
[6]Yu J,Mi J,Wang Y,et al.Regulation of radiosensitivity by HDAC inhibitor trichostatin A in the human cervical carcinoma cell line Hela.[J].European Journal of Gynecological Oncology,2012,33(3):36.
[7]魏曙光,竇中嶺,孫國賢,等.Caveolin-1和HDAC1蛋白在腎細胞癌中的表達及意義[J].現代泌尿生殖腫瘤雜志,2013,01:32.
[8]Takashi Yoshioka,Shingo Yogosawa,Takeshi Yamada,et al.Combination of a novel HDAC inhibitor OBP-801/YM753 and a PI3K inhibitor LY294002 synergistically induces apoptosis in human endometrial carcinoma cells due to increase of Bim with accumulation of ROS[J].Gynecologic Oncology,2013,13:468.
[9]馬永良.DNMT1和HDAC1在腎透明細胞癌中的表達及其相關性研究[D].河北醫科大學,2012.
[10]Glaser Keith B,Staver Michael J,Waring Jeffrey F,et al.Gene expression profiling of multiple histone deacetylase (HDAC) inhibitors:defining a common gene set produced by HDAC inhibition in T24 and MDA carcinoma cell lines[J].Molecular Cancer Therapeutics,2003,2(2):164.
收稿日期:(2013-12-14)
文章編號:1007-4287(2015)01-0115-03

