Periaxin與腓骨肌萎縮癥4F亞型
任頁玫(綜述),石亞偉(審校)
(山西大學生物技術研究所 教育部化學生物學與分子工程重點實驗室,太原 030006)
?
Periaxin與腓骨肌萎縮癥4F亞型
任頁玫△(綜述),石亞偉※(審校)
(山西大學生物技術研究所 教育部化學生物學與分子工程重點實驗室,太原 030006)
摘要:Periaxin是施萬細胞特異表達的一種蛋白,在維持髓鞘穩定性方面起重要作用,該基因突變將導致脫髓鞘型常染色體隱性遺傳的腓骨肌萎縮癥4F亞型發生。從分子遺傳學角度探討腓骨肌萎縮癥4F亞型發病的機制已成為目前研究的熱點。從periaxin的分布、結構與功能開展研究,尋找與其相互作用的蛋白質并揭示其互作的生物學意義,從蛋白質水平上研究腓骨肌萎縮癥的發病機制具有重要意義。
關鍵詞:腓骨肌萎縮癥4F亞型;Periaxin;結構;功能
腓骨肌萎縮癥又稱為Charcot-Marie-Tooth病(CMT)是一類最常見的遺傳性周圍神經單基因遺傳病,具有明顯的臨床和遺傳異質性,發病率約1/2500,多數呈常染色體顯性遺傳。CMT的臨床主要特征是四肢遠端進行性的肌無力和萎縮性感覺障礙,腱反射減弱或消失、輕到中度遠端感覺減退,典型者雙下肢呈倒立酒瓶狀或稱鶴立腿[1]。近十幾年內,將近30個不同的CMT遺傳位點被定位,20個基因相繼被克隆,這些基因在維持周圍神經軸索、髓鞘的結構完整性和功能完整性、線粒體功能、細胞信號轉導等方面發揮重要作用。將CMT的為數眾多的致病基因組成一個微芯片系統,可揭示維持施萬細胞-軸突完整結構的分子組織和維持周圍神經正常功能必須的生物分子的種類和數量。現對Periaxin與CMT4F進行綜述。
1CMT4F
周圍神經系統發育時,軸突是否被有髓鞘施萬細胞包裹,以及包裹的厚度、長度均會影響神經信號轉導,越厚越長則傳導速度越快。施萬細胞和神經元為彼此提供整個發育過程中生存及分化的調節。影響施萬細胞中任何一種類型的基因突變導致的遺傳缺陷都可使神經元和施萬細胞間通訊發生紊亂而引起CMT發生。根據臨床特征、周圍神經電生理和病理特點,CMT分為脫髓鞘型和軸突型兩大類。神經電生理檢查表明脫髓鞘型CMT正神經傳導速度減慢(<38 m/s),周圍神經傳導速度減緩,神經活檢顯示有髓神經纖維的數量減少,廣泛的節段性脫髓鞘和髓鞘再生,形成“洋蔥頭”樣結構;軸突型CMT神經傳導速度正常或輕度減慢(>38 m/s),神經活檢見軸突內空泡變性,髓鞘塌陷,有髓神經纖維丟失,而極少有脫髓鞘改變[2-4]。CMT4F亞型屬于脫髓鞘型常染色體隱性遺傳,表現為感覺神經共濟失調、運動發育遲緩等。該疾病發病年齡早,常在兒童期發病,9~10歲出現下肢遠端的肌肉萎縮和無力,14~15歲時出現上肢無力,但以后病情進展緩慢;神經電生理檢查顯示嚴重的感覺失調,輕微的脊柱后側凸,高弓足,上下肢感覺和運動誘發反應均差;病理組織學檢查主要表現為有髓鞘纖維密度(<1000 mm2)顯著降低,施萬細胞增殖明顯,并伴隨許多微小的洋蔥頭樣改變[5-6]。
2Periaxin的定位、分布
Periaxin屬于有髓施萬細胞非致密髓鞘中的重要蛋白之一[7],與髓鞘延展性相關。Periaxin基因作為CMT4F亞型的致病基因,最早由Delague等[5]和Guilbot等[8]共同報道,他們在對一個大家族的近親結婚的CMT4F研究中發現在periaxin 基因一個無義突變R196X,導致CTM4F疾病的發生。
2000年,Delague等[5]將periaxin基因定位于染色體19q13.1~13.3;2001年,Boerkoel等[9]進一步將該基因定位于人類染色體19q13.13~13.2。由于信使RNA(mRNA)不同的剪切方式編碼了兩種長短不同的含PDZ結構域的periaxin蛋白,即L-periaxin和S-periaxin。由4.6 kb mRNA所編碼的periaxin蛋白為L-periaxin,含有1461個氨基酸,相對分子質量為1.47×105,包含有1、2、3、4、5、6a、6c共7個外顯子。由5.2 kb mRNA所編碼的periaxin蛋白為S-periaxin,包含1、2、3、4、5、6b共6個外顯子但由于終止密碼子的出現在6 b外顯子讀框的起始部分,使其編碼了截短型的S-periaxin,該蛋白含有147個氨基酸,相對分子質量約為1.6×104[10]。雖然其N端都具有PDZ結構域,但兩者在施萬細胞內卻有不同的定位,施萬細胞內表達的S-periaxin彌散分布在細胞質中,而L-periaxin則集中在細胞膜或細胞核內。Periaxin蛋白屬于周圍神經纖維和細胞骨架相結合的蛋白,在周圍神經纖維發育的早期階段就可以檢測到其表達,但該蛋白在外周神經系統髓鞘化的施萬細胞表達而在中樞神經的寡突神經膠質細胞不表達并且不整合到致密的髓鞘中[11]。1995年Scherer等[11]利用免疫組織化學研究表明,periaxin蛋白在外周神經的發育過程中存在重新的亞細胞定位,在髓鞘未成熟時,periaxin蛋白集中在近軸突膜處,當髓鞘成熟時,periaxin蛋白主要集中到質膜,遠軸突膜。另外,Sherman和Brophy[12]在培養轉染L-periaxin基因的施萬細胞系33B時發現L-periaxin在細胞內的定位存在以下變化:細胞密度低時,L-periaxin集中分布在細胞核內;當細胞密度增大達到一個閾值時或細胞鋪滿平板時,L-periaxin蛋白核定位減少,膜定位增加;當進行劃痕使細胞間的連接破壞后,發現劃痕邊緣細胞數量減少且L-periaxin又重新定位在細胞核中。L-periaxin核輸入過程需要能量,且存在細胞之間的接觸抑制,一旦細胞黏合減少或細胞損傷,L-periaxin蛋白又會出現在核內[12]。
Periaxin除在髓鞘化的施萬細胞表達外,在眼睛晶狀體纖維細胞中也有分布。2003年,Straub等[13]研究表明,在眼睛晶狀體纖維細胞中periaxin與ezrin、periplakin、desmoyokin形成EPPD復合物。隨后Maddala等[14]觀察到,隨著晶狀體纖維細胞的成熟,在3個細胞的交聯處periaxin主要集中分布在內皮層六邊形纖維細胞的短臂頂端處并且以不連續、斑片狀的方式呈現,然而在兩個細胞的交聯處,periaxin在六邊形纖維細胞的長臂、短臂的頂端交替出現。
3Periaxin的結構與功能
人源L-periaxin由1461個氨基酸組成,含有PDZ、核輸出信號區(nuclear localization signal,NLS)、重復序列區、酸性結構域區4個結構域。PDZ結構域作為一個蛋白-蛋白相互作用元件,其可和蛋白質或多肽配體、脂質體相結合,也可形成同源或異源二聚體。 Sherman等[15]通過酵母雙雜交、GST-pull down實驗、免疫共沉淀證明了L-periaxin蛋白可以通過PDZ形成二聚體。此外,Wu等[16]將myc-periaxin分別和Flag-periaxin、Flag-ΔPDZ-periaxin共轉染HEK293細胞,利用免疫共沉淀研究表明,L-periaxin蛋白之間有相互作用,缺失PDZ后其不再同野生型periaxin相互作用,說明L-periaxin蛋白通過PDZ結構域相互作用。Shi等[17]研究結果顯示,L-periaxin的PDZ結構域還是控制L-periaxin蛋白核輸出的一個重要因素,L-periaxin與S-periaxin間也存在由PDZ介導的相互作用和調節。另外,核輸入信號區介導了L-periaxin蛋白核輸入[12],與此同時L-periaxin通過NLS區域與肌營養不良蛋白(dystroglycan-dystrophin-related protein 2,DRP2)結合參與肌營養不良蛋白聚糖復合物的形成,將施萬細胞膜骨架連接到基膜上[15,18-19],但L-periaxin中NLS區域共有3段NLS信號肽,其中NLS1可能是參與核輸入主要調節因子,NLS2,3區段可能是同DRP2相互作用的區域,其作用方式見圖1。
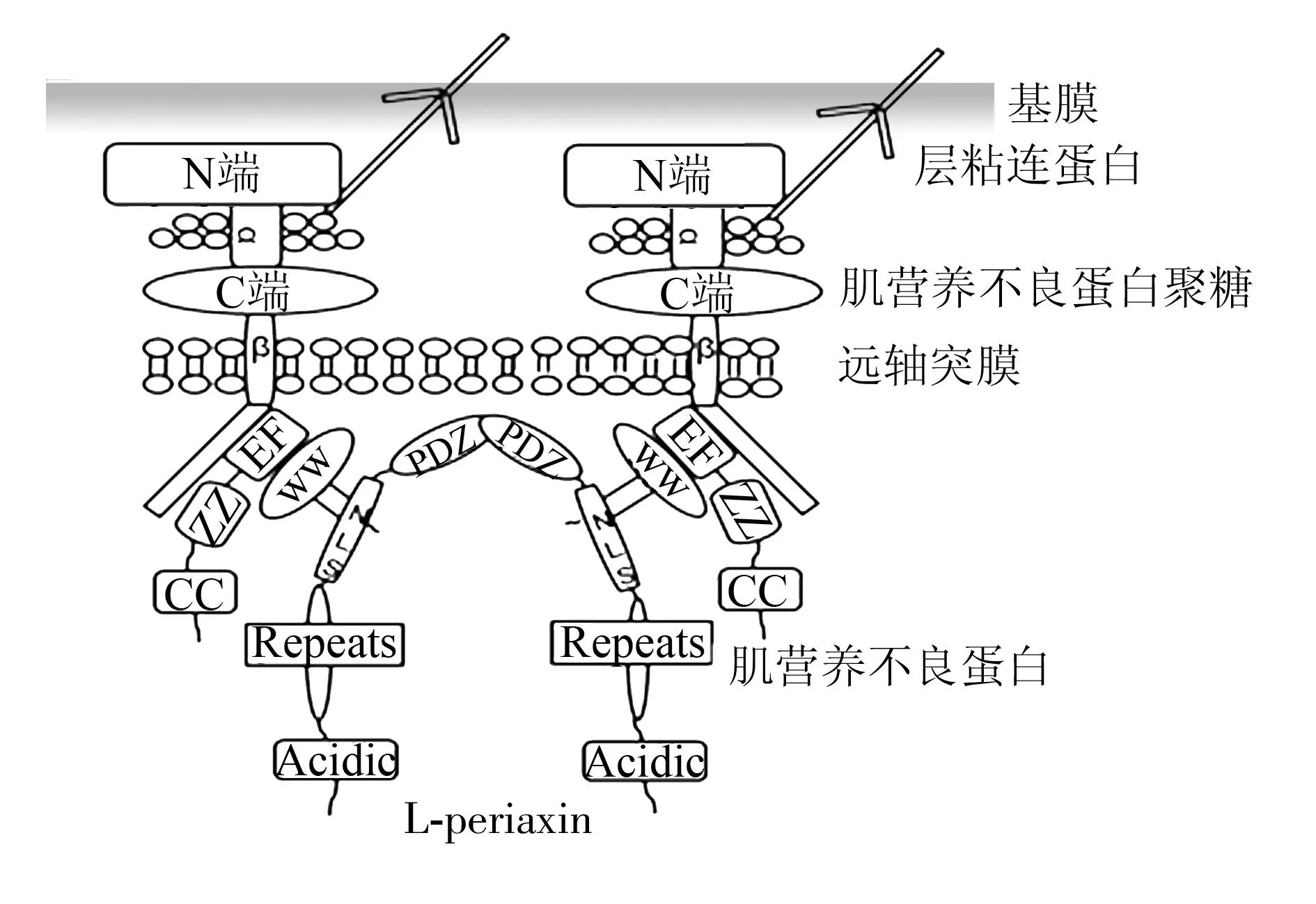
WW、EF、ZZ、CC為肌營養不良蛋白的結構域;PDZ、NLS、Repeats、Acidic均為periaxin蛋白的結構域;PDZ為post-synaptic density 95(PSD95),disk-large(Dlg) and zona occludens-1(ZO-1)3種蛋白首字母縮寫;Repeats(重復序列結構域);Acidic (酸性結構域)
圖1L-periaxin和DRP2在施萬細胞膜上作用示意圖
4Periaxin與CMT4F
CMT的發病機制尚不清楚,從分子遺傳角度探討其發病機制成為目前的研究熱點,已經報道了periaxin基因30個位點的突變[9,20-22],見圖2。2001年Boerkoel等[9]在3例診斷為Dejerine-Sottas神經病的患者中,發現在periaxin基因上分別存在R368X、V763fsX774、S929fsX957、R953X 突變。另外還有其他突變位點:E1259K、A406T、E1359del、E495Q、R1132G、P1083R、I921M等[9]。2004年Kijima等[23]利用變性高效液相色譜分析技術對隨機選擇的66例CMT日本患者進行基因序列分析,發現其中3例來自不同家族的CMT患者存在Periaxin蛋白的R1070X位點突變,患者病程均表現為發病早、進程慢。2008年,Auer-Grumbach等[24]對CMT患者研究發現A700fsX17突變將導致L-periaxin蛋白C端缺失。2011年,Nouioua 等[25]對近親結婚的阿爾及利亞CMT4F患者進行研究發現了A364X突變。2012年,Tokunaga等[20]對3例日本CMT患者檢測發現了R651N和R1070X兩種突變。2013年,Renouil等[21]報道,留尼汪島上CMT患者的periaxin蛋白E1085fsX4突變率是很高的。

NH2:periaxin蛋白的N端;COOH:periaxin蛋白的C端;PDZ:Post-synaptic density protein-95(PSD-95)、Discs large(DLG)、Zonula occludens 1(ZO-1)3種蛋白首字母的縮寫;NLS:核輸入信號;Repeat:重復序列結構域;Acidic:酸性結構域;R:精氨酸;L:亮氨酸;T:蘇氨酸;S:絲氨酸;A:丙氨酸;E:谷氨酸;Q:谷氨酰胺;P:脯氨酸;V:纈氨酸;K:賴氨酸;I:異亮氨酸;C:半胱氨酸;M:甲硫氨酸;G:甘氨酸;fs:移碼突變;del:缺失;X:終止密碼子
圖2periaxin基因突變位點
5展望
腓骨肌萎縮癥為遺傳性周圍神經病中報道最多的疾病,目前國內外的研究主要涉及基因突變與病理及疾病表型間的關系。對CMT4F患者進行針對periaxin的基因檢測以及進一步家系采集,能發現更多的突變位點,這對揭示CMT4F的分子遺傳學機制具有重要作用。通過對periaxin蛋白的結構和功能間關系的詮釋,及對periaxin蛋白之間相互作用網絡的描繪,可能是詮釋CMTF4亞型機制的一個好的路線圖。
參考文獻
[1]楊茜,李嗇夫,毛新發,等.腓骨肌萎縮癥的研究進展[J].醫學綜述,2013,19(19):3545-3547.
[2]張如旭,唐北沙.腓骨肌萎縮癥的分型與分子診斷流程[J].中華醫學遺傳學雜志,2012,29(5):553-557.
[3]段曉慧,顧衛紅,王國相.腓骨肌萎縮癥1型和2型的臨床與基因學研究現狀[J].中日友好醫院學報,2009,23(2):107-110.
[4]郭鵬,翟暉,宋福聰.腓骨肌萎縮癥臨床表現、基因分型和分子發病機制研究進展[J].中風與神經疾病雜志,2013,30(10):953-955.
[5]Delague V,Bareil C,Tuffery S,etal.Mapping of a new locus for autosomal recessive demyelinating Charcot-Marie-Tooth disease to 19q13.1-13.3 in a large consanguineous Lebanese family:exclusion of MAG as a candidate gene[J].Am J Hum Genet,2000,67(1):236-243.
[6]張付峰,羅巍,唐北沙.常染色體隱性遺傳的腓骨肌萎縮癥[J].國外醫學:兒科學分冊,2003,30(6):313-316.
[7]Kursula P.Structural properties of proteins specific to the myelin sheath[J].Amino Acids,2008,34(2):175-185.
[8]Guilbot A,Williams A,Ravise N,etal.A mutation in periaxin is responsible for CMT4F,an autosomal recessive form of Charcot-Marie-Tooth disease[J].Hum Mol Genet,2001,10(4):415-421.
[9]Boerkoel CF,Takashima H,Stankiewicz P,etal.Periaxin mutations cause recessive Dejerine-Sottas neuropathy[J].Am J Hum Genet,2001,68(2):325-333.
[10]Dytrych L,Sherman DL,Gillespie CS,etal.Two PDZ domain proteins encoded by the murine periaxin gene are the result of alternative intron retention and are differentially targeted in Schwann cells[J].J Biol Chem,1998,273(10):5794-5800.
[11]Scherer SS,Xu YT,Bannerman PG,etal.Periaxin expression in myelinating Schwann cells:modulation by axon-glial interactions and polarized localization during development[J].Development,1995,121(12):4265-4273.
[12]Sherman DL,Brophy PJ.A tripartite nuclear localization signal in the PDZ-domain protein L-periaxin[J].J Biol Chem,2000,275(7):4537-4540.
[13]Straub BK,Boda J,Kuhn C,etal.A novel cell-cell junction system:the cortex adhaerens mosaic of lens fiber cells[J].J Cell Sci,2003,116(Pt 24):4985-4995.
[14]Maddala R,Skiba NP,Lalane R 3rd,etal.Periaxin is required for hexagonal geometry and membrane organization of mature lens fibers[J].Dev Biol,2011,357(1):179-190.
[15]Sherman DL,Fabrizi C,Gillespie CS,etal.Specific disruption of a schwann cell dystrophin-related protein complex in a demyelinating neuropathy[J].Neuron,2001,30(3):677-687.
[16]Wu LM,Williams A,Delaney A,etal.Increasing internodal distance in myelinated nerves accelerates nerve conduction to a flat maximum[J].Curr Biol,2012,22(20):1957-1961.
[17]Shi Y,Zhang L,Yang T.Nuclear export of L-periaxin,mediated by its nuclear export signal in the PDZ domain[J].PLoS One,2014,9(3):e91953.
[18]Noriega E,Ramos E.New mutation in periaxin gene causing Charcot Marie Tooth disease in a Puerto Rican young male[J].J Clin Neuromuscul Dis,2013,15(2):63-68.
[19]Sherman DL,Wu LM,Grove M,etal.Drp2 and periaxin form Cajal bands with dystroglycan but have distinct roles in Schwann cell growth[J].J Neurosci,2012,32(27):9419-9428.
[20]Tokunaga S,Hashiguchi A,Yoshimura A,etal.Late-onset Charcot-Marie-Tooth disease 4F caused by periaxin gene mutation[J].Neurogenetics,2012,13(4):359-365.
[21]Renouil M,Stojkovic T,Jacquemont ML,etal.Maladie de Charcot-Marie-Tooth associée au gène de la périaxine (CMT4F) :description clinique,électrophysiologique et génétique de 24 patients[J].Revue Neurologique,2013,169(8/9):603-612.
[22]Marchesi C,Milani M,Morbin M,etal.Four novel cases of periaxin-related neuropathy and review of the literature[J].Neurology,2010,75(20):1830-1838.
[23]Kijima K,Numakura C,Shirahata E,etal.Periaxin mutation causes early-onset but slow-progressive Charcot-Marie-Tooth disease[J].J Hum Genet,2004,49(7):376-379.

[25]Nouioua S,Hamadouche T,Funalot B,etal.Novel mutations in the PRX and the MTMR2 genes are responsible for unusual Charcot-Marie-Tooth disease phenotypes[J].Neuromuscular Disorders,2011,21(8):543-550.
Periaxin and Charcot-Marie-Tooth Disease Subtype 4F
RENYe-mei,SHIYa-wei.
(KeyLaboratoryofChemicalBiologyandMolecularEngineeringofMinistryofEducation,InstituteofBiotechnologyofShanxiUniversity,Taiyuan030006,China)
Abstract:Periaxin is expressed by myelinating Schwann cells,which plays an essential role in stabilization of the myeline sheath.Periaxin mutations cause autosomal recessive,demyelination neuropathy,Charcot-Marie-Tooth 4F(CMT4F) subtype.Molecular genetics mechanism of CMT4F subtype has been one of the hot spots in the research field.The study of periaxin distribution,structures and functions,finding the interacting proteins with periaxin will reveal its biological function,and lay the foundation for the research of CMT pathogenesis on the protein level.
Key words:Charcot-Marie-Tooth disease 4F; Periaxin; Structure; Function
收稿日期:2014-05-04修回日期:2014-09-22編輯:相丹峰
基金項目:國家自然科學基金 (31170748)
doi:10.3969/j.issn.1006-2084.2015.08.005
中圖分類號:R746文獻標識號:A
文章編號:1006-2084(2015)08-1356-03

