雞囊胚細胞DMSO細管冷凍保存技術研究
王 坤,張佰忠,易康樂,朱立軍,蔣 雋,燕海峰,3*
(1.湖南省畜牧獸醫研究所,長沙410131;2.湖南農業大學動物科學技術學院,長沙410128;3.湖南天心黃雞育種有限公司,長沙410143)
禽類種蛋產出時,受精卵已發育成為具有內外胚層,達40 000~60 000個細胞的X期囊胚[1],該時期的細胞稱為囊胚細胞(Blastodermal cells,BCs)。雞BCs在禽類生物技術研究領域具有十分重要的作用:(1)BCs是潛在的雞胚胎干細胞[2];(2)BCs是禽類轉基因技術研究中的主要靶細胞[3-5];(3)BCs可在禽類種質資源保護利用研究領域中,通過解凍BCs制備嵌合體而重新獲得活體[6-8],解決無法冷凍保存禽類母系(W染色體)遺傳資源的困境。K.Kino等[8]通過移植超低溫冷凍的BCs能獲得種系嵌合體,說明冷凍保存后的細胞具有很好的生命力。但在后續的研究中,對雞干細胞的冷凍研究大多集中在原生殖細胞(PGCs),安靜[9]、王丙云等[10]對雞BCs的冷凍保存進行過研究,雖然都獲得了不錯的結果,但沒有對于BCs冷凍保存中各種操作程序和影響因素進行研究。
本研究使用胚胎冷凍儀、細管冷凍以及二乙酰熒光素(Fluorescein diacetate,FDA)染色測定細胞活力(簡稱活力,Cell viability,CV)與體外培養24 h貼壁率(簡稱貼壁率,Cell adherent rate cultivated for 24 h,CAR)雙重評價方法,對雞BCs冷凍保存中,DMSO的濃度、冷凍及解凍速率進行研究,欲建立雞BCs細管冷凍保存的有效方法,促進其在胚胎干細胞與遺傳資源保存領域的應用。
1 材料與方法
1.1 試驗材料
白來航雞與黑鳳雞種蛋由湖南省畜牧獸醫研究所提供。
96孔平底細胞培養板、0.25 m L細管均購自IMV公司。倒置熒光顯微鏡(CK40-RFL,Olympus)、離心機(TGL-16C,上海安亭科學儀器廠制造)。胚胎程序冷凍儀(NH78200-EN,AIR LIQUIDE-DMC)。DMEM高糖培養基、胎牛血清(FBS)(Gibco公司),青霉素鈉、鏈霉素(Biosharp公司),二乙酸熒光素(FDA)(TCI公司),丙酮、二甲基亞砜(DMSO)等試劑(VETEC公司)。
1.2 方法
1.2.1 雞X期BCs的分離 種蛋儲存于10~18℃,采用10 d內的種蛋。將蛋殼表面用70%酒精擦拭消毒,置于紫外線消毒過的蛋托上,轉移到無菌室,水平朝上靜置30 min左右。使用孔略大于胚盤的打孔器,制作濾紙環,滅菌。根據種蛋大小選取合適培養皿,種蛋保持靜止時的方位不變,從底部小心敲破蛋殼,兩手從底部破口處,往兩側迅速掰開,內容物快速落入培養皿中。使胚盤位于水平面上,用眼科剪將卵黃膜外胚盤上方的濃蛋清完全剪開,暴露干燥的卵黃膜,用尖嘴小鑷子夾取濾紙環,孔正對胚胎,準確貼在卵黃膜上。沿紙環小心將卵黃膜剪開,用鑷子夾住濾紙環邊緣,從卵黃上分離后在盛有0.9%生理鹽水的幾個培養皿中輕輕搖動,依次漂洗,去除卵黃,直到胚盤從卵黃膜上脫離[11]。
1.2.2 雞BCs體外培養 用剪去約3 mm的1 m L Tip吸取脫離的胚盤,轉入含生長培養基的液滴中,分離到足夠的胚盤(每次試驗一般取16個左右胚)后,將胚轉移到2 m L離心管中,添加1 m L生長培養基,用1 m L Tip與1 m L移液槍,每次吸入1 m L再完全排出,反復進行6下,制成密度約為8× 105m L-1的細胞懸液(按照每個胚50 000~60 000個細胞估算[1]),一部分用于冷凍備用,一部分調整密度為4×104m L-1后使用96孔板培養,作為對照細胞。每孔接種懸液200μL,在37℃5%CO2濃度與95%相對濕度的培養箱中培養。
1.2.3 冷凍 采用5種不同濃度DMSO(5℃保存)進行冷凍保護劑優化:1)5%DMSO+30%FBS+65%DMEM;2)10%DMSO+30%FBS+60% DMEM;3)15%DMSO+30%FBS+55%DMEM;4)20%DMSO+30%FBS+50%DMEM;5)25% DMSO+30%FBS+45%DMEM。優化其他參數時選用4)配方。
將細胞密度為8×105m L-1的BCs懸液,5℃預冷處理10 min,1∶1緩慢添加冷凍保護液,5℃平衡30 min,用經過預冷處理的0.25 m L的細管裝管。通過胚胎程序冷凍儀實現3步冷凍:(1)打開程序冷凍儀,設定好程序并倒入液氮,在儀器降溫至5℃時將細管放入程序冷凍儀,以-1℃·min-1的速率降溫至-7℃,保持10 min。(2)繼續以-1℃·min-1的速率降溫,比較降溫至-15、-35、-55、-75℃的效果(在優化其他參數時,選擇-35℃)。(3)達到設定溫度后,將細管直接投入液氮保存。
1.2.4 解凍 細管從液氮中取出后,對兩種不同解凍速率進行優化:1)慢速解凍,立即投入到37℃水浴鍋中,分別保持10 s、1 min、2 min、3 min后進行下一步操作(優化其它參數時使用1 min);2)快速解凍,立即投入到50℃水浴鍋中,分別保持5 s、20 s、40 s、1 min后進行下一步操作。
隨著農村經濟體制的改革,土地經營日益集中化、規模化,農民專業合作社、家庭農場等組織地膜使用量大,白色污染嚴重。應加強對合作社等組織的管理,根據農膜使用量,下達回收任務,并與其簽訂回收協議,采用收取保證金的方式,對于完成回收任務的退還保證金并給予資金獎勵。對于沒有完成回收任務的,則使用保證金組織第三方進行回收清理,倒逼新型經營主體開展廢舊農膜污染防治工作。
解凍后的處理:將細管中的細胞懸液轉入離心管中,緩慢添加10倍體積含10%FBS的生長培養基,用4 000 r·min-1離心5 min,去上清液,重復1次,計算活力后調整密度為4×104m L-1,按1.2.2方法培養。
1.2.5 活力與貼壁率檢測 FDA細胞活力檢測,將FDA加入到細胞液中,FDA終濃度為1μg·m L-1,37℃暗室染色3~5 min,取25μL制片后使用100~400倍的熒光顯微鏡(激發和發射波長分別為450~490和520 nm)觀察并計算活力,發綠色熒光的是活細胞,不發光的是死細胞,計數需在10 min內完成。貼壁率檢測,按步驟1.2.2將細胞培養24 h后,用倒置熒光顯微鏡對每一孔貼壁情況進行觀察和評估,評估方法為貼壁細胞數占總細胞數百分比即貼壁率。
1.2.6 數據處理 采用SAS 9.2統計軟件進行單因素方差分析和多重比較。
2 結 果
2.1 細胞鏡檢圖
圖1中,圖1A為冷凍前BCs形態圖,圖1B為使用冷凍程序解凍后細胞形態圖。圖1C、D為FDA熒光染色結果,其中圖1D是開了少量可見光的效果,可以同時辨別出死、活細胞。圖1E~J為不同貼壁率細胞貼壁圖。貼壁細胞聚集成集落并且與未貼壁細胞有明顯界限,表現為塊狀或斑狀。
2.2 不同DMSO濃度對雞BCs冷凍保存的結果
由表1可知,1)在細胞活力上,未冷凍組與各冷凍組都有極顯著差異(P<0.01);DMSO濃度為20%組活力最高,為0.58,與15%組差異不顯著(P>0.05),但與5%、10%和25%組差異極顯著(P<0.01);10%組細胞活力最差,為0.18,與5%組差異不顯著(P>0.05);15%組和25%組差異不顯著(P>0.05)。2)在貼壁率上,未冷凍組與各冷凍組差異極顯著(P<0.01);其中20%組貼壁率最高,為30.5%,與15%組差異不顯著(P>0.05),與25%組差異顯著(P<0.05),與5%組和10%組差異極顯著(P<0.01),15%組和25%組差異不顯著(P>0.05);5%組結果最差,貼壁率為0。
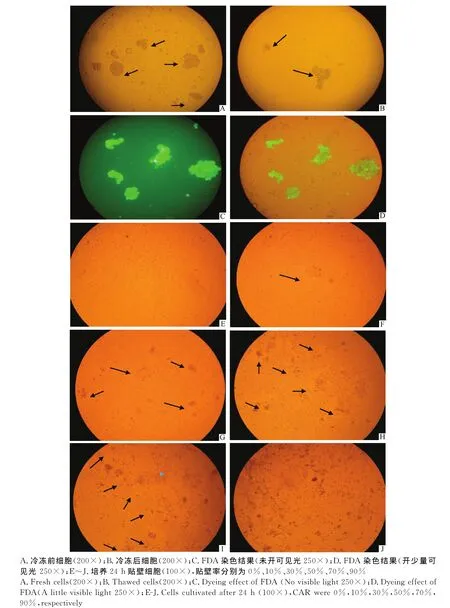
圖1 細胞鏡檢圖Fig.1 Cell microscopy
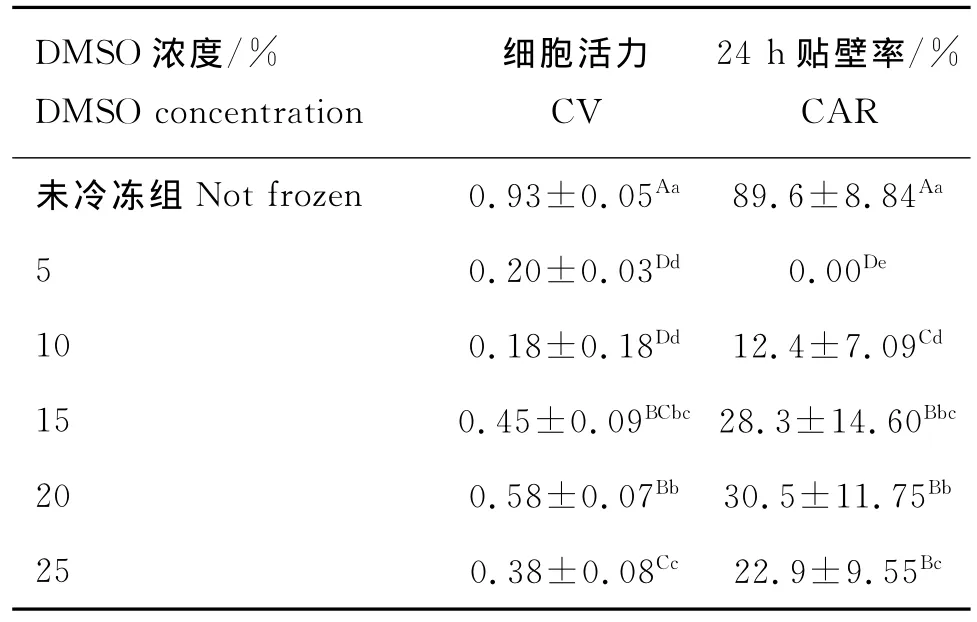
表1 不同DMSO濃度冷凍保存BCs的結果(n=40)Table 1 The CV and CAR of BCs freezed by different DMSO concentrations
由圖2可以看出,不同DMSO濃度,解凍后細胞活力和貼壁率的變化趨勢基本相同,都是先升高后降低,在濃度為20%時達到最高值。同時也發現,濃度為5%時,細胞活力不為0,但培養24 h后貼壁率為0,說明該組細胞解凍后存活的也隨后死亡或是無法貼壁。
2.3 雞BCs不同冷凍速率處理結果
由表2可知,1)在活力上,未冷凍組與各冷凍組都有極顯著差異(P<0.01);-75℃組解凍后細胞活力最高,為0.53,但與-35℃、-55℃組解凍后的細胞活力差異不顯著(P>0.05);-15℃組解凍后的細胞活力最差,為0.03,且與各組之間差異都極顯著(P<0.01)。2)在貼壁率上,未冷凍組與各冷凍組差異極顯著(P<0.01);不同冷凍速率各組間差異也極顯著(P<0.01),其中-35℃組貼壁率最高,為36.6%,-15℃組最差,沒有細胞貼壁。
由圖3可以看出,不同冷凍速率處理下,解凍后活力和貼壁率有不同的變化趨勢。解凍后活力,在一定范圍內,隨著投入液氮時溫度的降低,細胞活力有逐漸上升的趨勢,-75℃組活力最高,-15℃組活力最低;從解凍后貼壁率看,在一定范圍內,隨著投入液氮時刻溫度的降低,活力先升高后逐漸下降,-35℃組活力最高,-15℃組最低;同時也發現,-15℃組活力不為0,但貼壁率為0,-75℃組活力最高,但貼壁率很低。
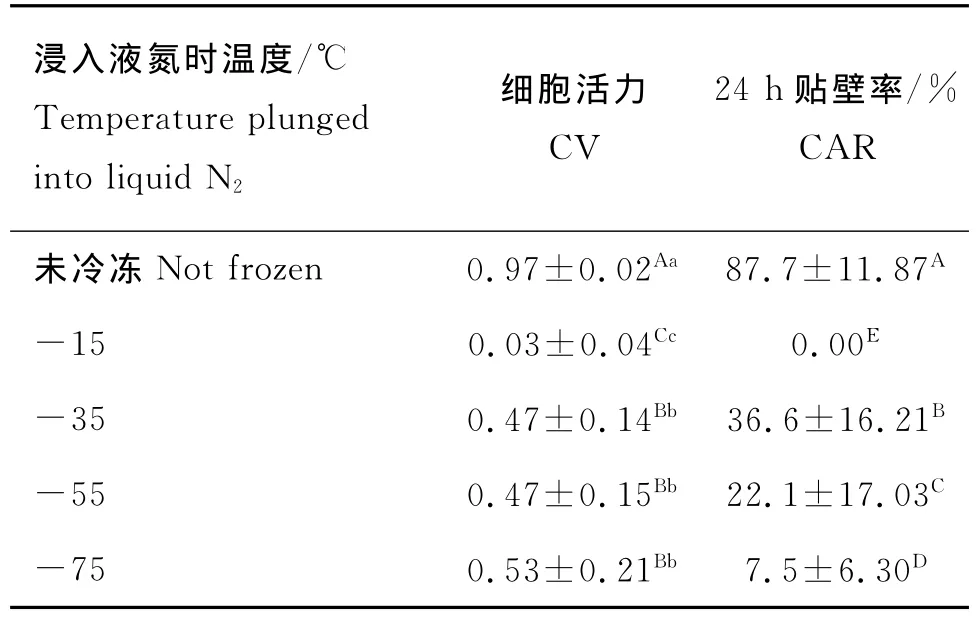
表2 不同冷凍速率結果的比較(n=40)Table 2 The CV and CAR of different freezing rate
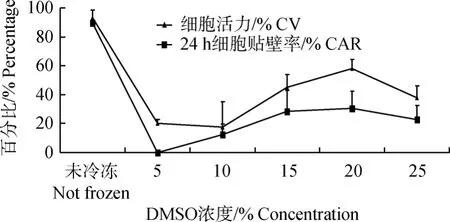
圖2 不同DMSO濃度冷凍結果折線圖Fig.2 The line chart of CV and CAR at different DMSO concentration
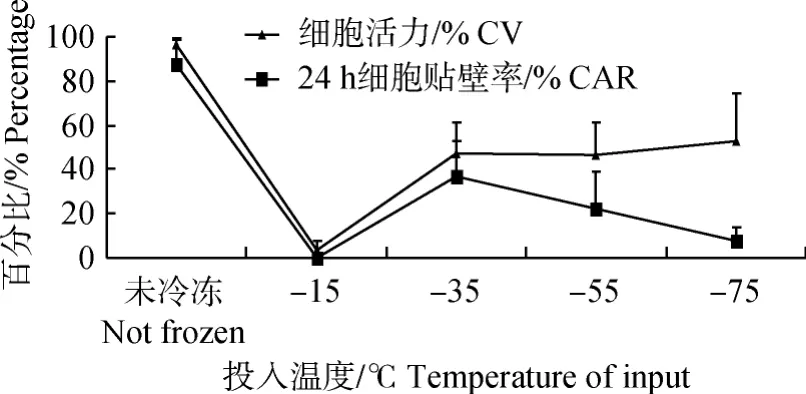
圖3 不同冷凍速率冷凍結果折線圖Fig.3 The line chart of CV and CAR at different freezing rate
2.4 雞BCs不同解凍速率處理結果
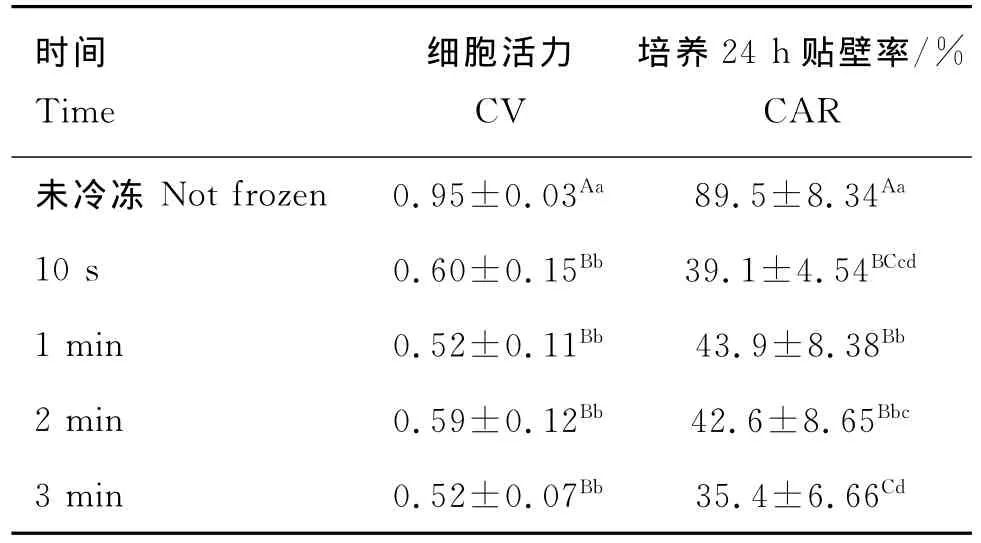
表3 37℃水浴不同時間解凍結果(n=30)Table 3 The CV and CAR of different bath time in 37℃water
2.4.2 快速解凍 采用50℃水浴不同時間進行解凍,結果見表4:1)在活力上,未冷凍組與冷凍組不同解凍速率之間均差異極顯著(P<0.01);水浴5 s效果最好,為0.70,與水浴20 s差異顯著(P<0.05),與水浴40 s、1 min差異極顯著(P<0.01);水浴1 min效果最差,為0.41,與水浴40 s差異不顯著(P>0.05),與水浴20 s差異顯著(P<0.05)。2)在貼壁率上,未冷凍組與冷凍組各解凍速率間差異均極顯著(P<0.01);不同解凍速率之間差異也極顯著(P<0.01);其中水浴5 s效果最好,為36.9%,水浴1 min效果最差,為5.6%。
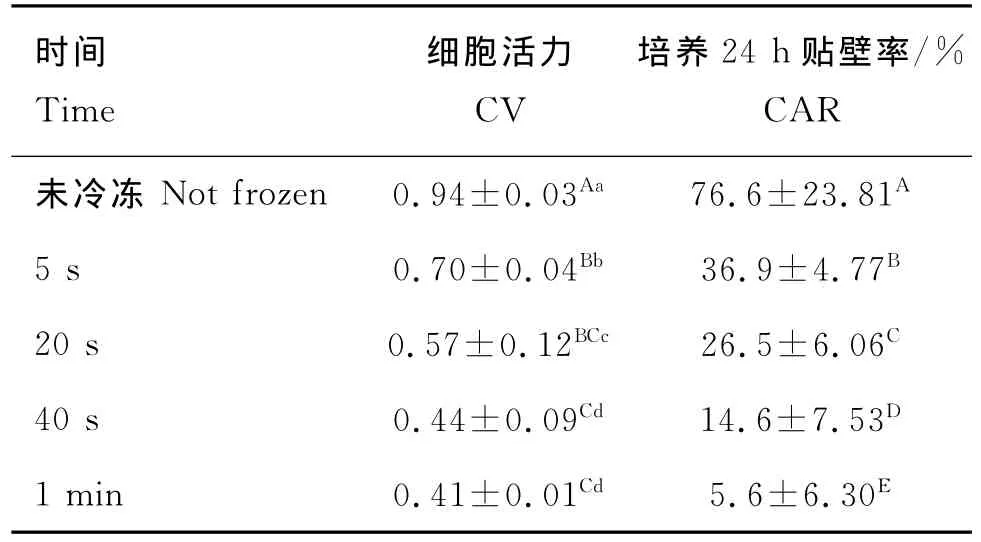
表4 50℃水浴不同時間解凍結果(n=30)Table 4 The CV and CAR of different bath time in 50℃water
2.4.3 慢速與快速解凍的對比結果 由圖4可以看出,解凍后活力,37℃水浴整體上優于50℃水浴,且變化趨勢較平緩;50℃水浴活力整體上隨水浴時間增加有下降趨勢,且變化幅度相對較37℃更大,但50℃水浴5 s獲得了最高活力。
由圖5可以看出,37℃水浴解凍,貼壁率隨著時間增加,先增加后下降,變化幅度較平緩,在整體上每一個速率都高于50℃水浴的結果,特別是在1~2 min時貼壁率最高;50℃水浴解凍,隨著水浴時間增加,貼壁率不斷下降,且下降幅度越來越大。
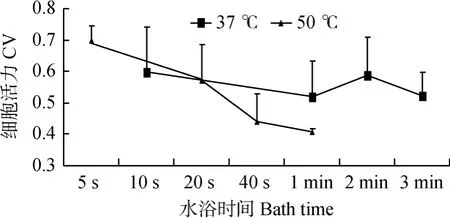
圖4 不同解凍速率對活力影響折線圖Fig.4 The line chart of CV thawed at different rate
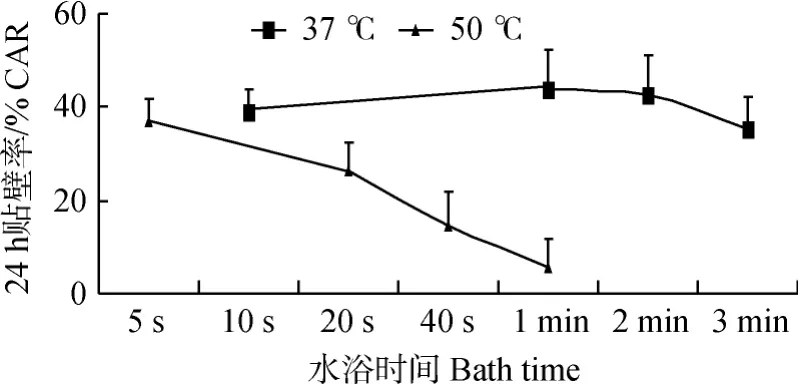
圖5 不同解凍速率解凍后貼壁率折線圖Fig.5 The line chart of CAR thawed at different rate
3 討 論
3.1 冷凍保護劑濃度對雞BCs冷凍保存的影響
DMSO是一種滲透性細胞冷凍保護劑。它能在細胞冷凍懸液完全凝固之前,滲透到細胞內,在細胞內外產生一定的濃度,降低細胞內外未結冰溶液中電解質的濃度,從而保護細胞免受高濃度電解質的損傷,同時細胞內水分也不會過分外滲,避免了細胞過分脫水皺縮。本研究表明,一定范圍內,隨著DMSO濃度增加,冷凍效果是先增加后降低,在20%時最高。這可能是由于低濃度的冷凍保護劑無法達到保護細胞受高濃度電解質損傷的要求,而DMSO具有毒性,因此濃度過大時,對細胞的毒性作用就會顯現出來[12]。本研究使用濃度為20% DMSO作為冷凍保護劑,所得復蘇率最高結果為70%,低于王丙云等[10]和李碧春等[13]復蘇率最高為85.5%的結果,但接近K.Kino[8]的結果,可能是因為活力測定方法不同所致。
3.2 冷凍速率對雞BCs冷凍保存的影響
本試驗在國內首次使用胚胎程序冷凍儀對雞BCs進行冷凍保存研究。對常規冷凍程序進行了改進,增加了細胞懸液預冷、-7℃平衡結晶兩個步驟。細胞預冷可降低冷凍保護劑加入時產生熱量對細胞的損傷,而且DMSO在常溫下對細胞有較大的毒副作用,預冷則可以減少這種傷害。-7℃平衡結晶可以讓細胞更好地度過“危險期”,減少冷凍損傷,這與韓威等[14]結論一致。冷凍過程中均以-1℃·min-1的速率降溫[15],對比降溫至-15、-35、-55、-75℃時投入液氮保存的不同效果,發現在-15~-75℃隨著溫度的下降細胞活力逐漸增加,-75℃時最高,這與M.Naito等[16]在降溫至-80℃投入液氮保存獲得較高活力類似。但復蘇后貼壁率卻呈現出不同的結果,在-15~-75℃,其貼壁率是先增加后降低,最高結果出現在-35℃。細胞活力出現最高值的-75℃組,貼壁率卻是4組中除了-15℃組(沒有貼壁)以外最低的,可能是-75℃組,解凍后雖然活力高,但細胞已經損傷,只是這些損傷的表達較慢,而且可能投入液氮前溫度越低,這種損傷越嚴重。在人類[17]和小鼠[18]胚胎冷凍上,也較多使用降溫至-30或-35℃再投入液氮,可能該溫度區域更適合胚胎的冷凍,對細胞造成的傷害較小。
3.3 解凍速率對雞BCs冷凍保存的影響
解凍速率在一定程度上決定復蘇細胞的存活力,解凍緩慢往往會導致細胞重結晶而死亡,而迅速升溫則可以使其重結晶的晶體減少,還可以使細胞處在高濃度物質中的時間縮到最短,減少滲透性休克,恢復細胞的生理功能,從而降低細胞死亡率。解凍溫度必須控制在一定范圍內,若細胞懸浮液的溫度過高,超過了細胞的耐受程度,就會造成細胞死亡。在解凍程序上,常規的方法是37℃水浴至融化[19],但這種方法主觀性強,不易重復。本研究通過固定水浴時間進行對比,使試驗的重復性得到了保證。也發現雖然50℃水浴5 s細胞活力最高,但貼壁率最高則出現在37℃水浴1 min上,可能是細胞在某些溫度范圍內受到損傷表達較緩慢,這也再次說明細胞活力不能完全代表細胞生命力。50℃水浴5 s雖然活力上最好,但隨著時間延長活力下降迅速,難以控制。37℃水浴解凍整體上無論是細胞活力還是貼壁率均高于50℃水浴結果,而且隨水浴時間增加變化較小,1~3 min內均未出現較大差距,穩定性好,更適合試驗中使用。
3.4 雞BCs冷凍損傷評價方法
活力測定上,本研究室多次嘗試臺盼藍染色法,但無論是自配的或是購買的染色劑,按文獻報道的各種配比,都發現染色效果不佳,很難區分活細胞和死細胞,特別是在卵黃等雜質未去除干凈時誤差更大,而且計數時間短促,也不能顯示出細胞的存活狀態[20]。因此,本研究首次在雞BCs上使用FDA熒光染色測定細胞活力,發現操作簡單快捷,死活細胞對比明顯,而且根據熒光的強弱還可以判斷出細胞的活力高低[21],但使用中要注意染色劑的濃度和染色時間,如果濃度太高則在視野中背景就會較亮,活細胞發出的綠色熒光就不明顯,而且死細胞有時也會照亮。染色時間不夠,則熒光物質積累不足,效果不佳,染色時間過長,則會導致活細胞的熒光衰減。試驗中發現,在開少量可見光的情況下,可以同時看到發出綠色熒光的活細胞和不發光的死細胞,達到雙染的效果,計算活力更加快捷準確。
本研究同時也使用了貼壁法來評估細胞的冷凍效果,因為依據細胞分化試驗可知,雞BCs在體外培養時,一部分細胞貼壁生長并最終分化為不同類型的細胞,還有一部分細胞則懸浮聚集分化,形成簡單的類胚體[22]。所以通過BCs貼壁生長的難易程度,可以更加準確的判定其作為潛在胚胎干細胞的活力,而且在增殖和傳代培養上,貼壁細胞都是最主要的對象,因此,冷凍復蘇后能貼壁的細胞才能更有利于干細胞研究。試驗發現冷凍復蘇后的細胞貼壁時間較未冷凍細胞要晚一些,而且貼壁速率也較慢,大概在24 h以后貼壁速率才與新鮮細胞差不多,這與有關報道[14,23]類似。原因可能是,復蘇后BCs細胞從冷凍時的休眠狀態到體外培養恢復正常增殖能力需要一定時間。因此選擇24 h作為觀察時間點不僅可以獲得較穩定的結果,而且結果相對明顯。對比3組結果,采用活力與貼壁率兩類指標評估,大體趨勢是一致的,但在冷凍速率和50℃水浴解凍試驗時出現不同結果,還有待進一步研究。由此,也可以發現,僅靠細胞活力評價細胞冷凍效果是不全面的,本實驗室使用的貼壁法評價,將為新的細胞冷凍損傷評價標準開辟新思路。
4 結 論
雞BCs使用DMSO濃度為20%的冷凍保護劑進行細管冷凍,以-1℃·min-1的速率降溫至-7℃保持10 min,繼續以同樣速率降溫至-35℃投入液氮保存,37℃水浴1~2 min解凍細胞,不僅可以獲得較好的細胞活力,而且培養后可以獲得較高的貼壁率。
(
):
[1] ZHANG Y N,YANG H Y,ZHANG Z T,et al.Isolation of chicken embryonic stem cell and eparation of chicken chimeric model[J].Mol Biol Rep,2013,40:2149-2156.
[2] YAN H F,LEE C Y,XIAO B N,et al.Production of transgenic chicken chimeras via blastodermal cells[J].Asian Australas J Anim Sci,2005,18(2):158-164.
[3] BAO S Q,LEITCH H G,GILLICH A,et al.The germ cell determinant blimp1 is not required for derivation of pluripotent stem cells[J].Cell Stem Cell,2012,11(1):110-117.
[4] KOO B C,KWON M S,LEE H,et al.Tetracyclinedependent expression of the human erythropoietin gene in transgenic chickens[J].Transgenic Res,2010,19(3):437-447.
[5] 楊海燕,孫 敏,田智泉,等.雞X期BCs電轉染外源基因條件的探索[J].中國畜牧雜志,2010,46(23):15-20.YANG H Y,SUN M,TIAN Z Q,et al.Transfection of EGFP genes into X period of chicken blastoderm cells mediated by electroporation[J].Chinese Journal of Animal Science,2010,46(23):15-20.(in Chinese)
[6] NAKAMURA Y,USUI F,MIYAHARA D,et al.Efficient system for preservation and regeneration of genetic resources in chicken:concurrent storage of primordial germ cells and live animals from early embryos of a rare indigenous fowl(Gifujidori)[J].Reprod Fertil Dev,2010,22:1237-1246.
[7] 燕海峰,鄧 緣,TREFIL P,等.以黑絲羽烏骨雞為供體制作家雞嵌合體的研究[J].激光生物學報,2010,19(4):535-541.YAN H F,DENG Y,TREFIL P,et al.Producing of multi-phenotypic BCs chimeric chickens using black silkies[J].Acta Laser Biology Sinica,2010,19(4):535-541.(in Chinese)
[8] KINO K,PAIN B,LEIBO S P,et al.Production of chicken chimeras from injection of frozen-thawed blastodermal cells[J].Poult Sci,1997,76:753-760.
[9] 安 靜.雞胚胎干細胞的分離、培養及鑒定[D].泰安:山東農業大學,2002.AN J.Isolatino,culture and identification of chicken embryonic stem cells[D].Taian:Shandong Agricultural University,2002.(in Chinese)
[10] 王丙云,黃文靜,計慧琴,等.不同冷凍保護劑對雞胚胎干細胞凍存與復蘇的影響[J].佛山科學技術學院學報(自然科學學版),2008,26(6):1-4.WANG B Y,HUANG W J,JI H Q,et al.The effect of different cryoperservations on cryopreservation and recovery of chicken embryonic stem cells[J].Journal of Foshan University(Natural Science Edition),2008,26(6):1-4.(in Chinese)
[11] 王 坤,張佰忠,易康樂等,雞BCs原代培養貼壁性影響因素分析[J].家畜生態學報,2015,36(2):61-66.WANG K,ZHANG B Z,YI K L,et al.Study on the factors affecting the adherent rate of primary cultured chicken BCs[J].Acta Ecologica Sinica,2015,36(2):61-66.(in Chinese)
[12] 高大勇,丁力行,呂金虎,等.細胞冷凍保存的最佳降溫速率及其影響因素[J].仲愷農業技術學院學報,2007,20(3):54-59.GAO D Y,DING L X,LüJ H,et al.Optimum rate of temperature drop and its effect factors for cells’cryopreservation[J].Journal of Zhongkai University of Agriculture and Technology,2007,20(3):54-59.(in Chinese)
[13] 李碧春,周冠月,陳國宏,等.雞胚精原干細胞體外保存能力的研究[J].畜牧獸醫學報,2007,38(7):657-662.LI B C,ZHOU G Y,CHEN G H,et al.Cryopreservation capacity of chicken spermatogonial stem cells[J].Acta Veterinaria et Zootechnica Sinica,2007,38(7):657-662.(in Chinese)
[14] 韓 威,李碧春,朱云芬,等.雞胚19期原始生殖細胞慢速冷凍和玻璃化冷凍保存的研究[J].中國畜牧獸醫,2007,34(3):55-59.HAN W,LI B C,ZHU Y F,et al.Study on the slow speed cryopreservation and vitrificated cryopreservation for chicken PGCs at stage 19[J].China Animal Husbandry &Veterinary Medicine,2007,34(3):55-59.(in Chinese)
[15] 張 保,卜海富,桂斌捷,等.降溫速率對程序化降溫低溫保存動脈的影響[J].安徽醫科大學學報,2008,43(2):132-134.ZHANG B,BU H F,GUI B J,et al.The influence of the different cooling rate to the effect of the cryopreservation carotids in rabbit[J].Acta Universitatis Medicinalis Anhui,2008,43(2):132-134.(in Chinese)
[16] NAITO M,TAJIMA A,TAGAMI T,et al.Preserva-tion of chick primordial germ cells in liquid nitrogen and subsequent production of viable offspring[J].J Reprod Fertil,1994,102:321-325.
[17] 劉春玲,吳曉云,邱惠麒,等.玻璃化和程序化凍融人卵裂期胚胎結果分析[J].中國優生與遺傳雜志,2014,22(1):95-96.LIU C L,WU X Y,QIU H Q,et al.Comparing the outcomes of vitrification and programming methods for cryopreservation of cleavage stage embryos[J].Chinese Journal of Birth Health &Heredity,2014,22(1):95-96.(in Chinese)
[18] 顧美超,盧天罡,劉云海,等.凍融后小鼠休眠胚胎超微結構的變化[J].中國實驗動物學報,2014,22(3):53-61.GU M C,LU T G,LIU Y H,et al.Ultrastructural observation of dormant mouse embryos cultured in vitro after freezing-thawing[J].Acta Laboratorium Animalis Scientia Sinica,2014,22(3):53-61.(in Chinese)
[19] 陳勝鋒,黃文靜,陳志勝,等.雞胚胎干細胞的離體培養與鑒定[J].畜牧與獸醫,2009,41(8):62-64.CHEN S F,HUANG W J,CHEN Z S,et al.Cells in vitro culture and identification of chicken embryonic stem[J].Animal Husbandry &Veterinary Medi-cine,2009,41(8):62-64.(in Chinese)
[20] 李 昕,陳方平,蔣鐵斌,等.深低溫冷凍保存對臍血細胞的影響及機制[J].中南大學學報,2013,38(7):709-714.LI X,CHEN F P,JIANG T B,et al.Effect of cryopreservation on umbilical blood cells and its mechanism[J].Journal of Central South University,2013,38(7):709-714.(in Chinese)
[21] LINHOVáM,BRANSKáB,PATáKOVáP,et al.Rapid flow cytometric method for viability determination of solventogenic clostridia[J].Folia Microbiol,2012,57:307-311.
[22] PETITTE J N,LIU G,YANG Z.Avian pluripotent Stem cells[J].Mech Dev,2004,121(9):1159-1168.
[23] 肖小珺,蔡琳琳,秦 潔,等.第28期雞胚原始生殖細胞的冷凍保存與體外培養研究[J].西北農林科技大學學報(自然科學版),2005,33(2):39-42.XIAO X J,CAI L L,QIN J,et al.Cryopreservation and culture of chicken primordial germ cells at stage 28[J].Journal of Northwest A&F University(Natural Science Edition),2005,33(2):39-42.(in Chinese)

