乳腺導管內癌伴微浸潤的病理和免疫組織化學特征分析
徐明 葉輝* 葉曼娜 余燕民
(上海市黃浦區中心醫院病理科,*外科,#乳腺外科,上海 200002)
?
乳腺導管內癌伴微浸潤的病理和免疫組織化學特征分析
徐明△葉輝△*葉曼娜余燕民#
(上海市黃浦區中心醫院病理科,*外科,#乳腺外科,上海200002)
摘要目的:比較乳腺導管內癌伴微浸潤(ductal carcinoma in situ with microinvasion,DCIS-MI)及導管內癌(ductal carcinoma in situ,DCIS)的病理和免疫組織化學特征。方法:收集176例DCIS-MI和184例DCIS患者的臨床資料,對其病理和免疫組織化學特征進行分析。結果:兩者腫塊最大徑≥2.5 cm、高級別組織分級、粉刺型組織亞型比例差異均有統計學意義(P<0.01);乳頭paget病及腋窩淋巴結轉移的患者比例差異無統計學意義(P>0.05);免疫組織化學標志物雌激素受體(estrogen receptor,ER)、孕激素受體(progesterone receptor,PR)、人表皮生長因子受體(human epidermal growth factor receptor 2,HER2)、Ki-67、小凹蛋白(caveolin-1)表達差異均有統計學意義(P<0.05)。結論:DCIS-MI在高級別組織分級、粉刺型組織亞型、腫塊最大徑≥2.5 cm、ER陰性、PR陰性、caveolin-1陰性、HER2陽性、Ki-67增殖指數≥14%的發生率高。
關鍵詞乳腺癌;導管內癌伴微浸潤;導管內癌;免疫組織化學
1982年Lagios等[1]提出“微浸潤”概念,至今已20余年,但目前診斷標準尚未統一。乳腺微浸潤癌(microinvasive carcinoma,MIC)是2003年由WHO在乳腺腫瘤組織學分類中首次提出,但未將其列為獨立的疾病類型,亦未統一定義和診斷標準。2012年WHO在乳腺腫瘤組織學分類[2]將MIC定義為乳腺間質中出現單個或多個獨立的顯微鏡下浸潤灶,每個病灶直徑均不超過1 mm。近年來,免疫組織化學雙標記技術的應用為MIC的檢出提供了幫助。本研究回顧分析了176例導管內癌伴微浸潤(ductal carcinoma in situ with microinvasion,DCIS-MI)和184例DCIS的病理特征以及免疫組織化學標志物雌激素受體(estrogen receptor,ER)、孕激素受體(progesterone receptor,PR)、人表皮生長因子受體(human epidermal growth factor receptor 2,HER2)、Ki-67和小凹蛋白(caveolin-1)的表達差異。
1資料與方法
1.1一般資料選擇上海市黃浦區中心醫院2010年1月—2013年12月經手術病理證實的176例DCIS-MI患者,年齡28~78歲,中位年齡55歲(DCIS-MI組);選擇同期手術病理證實的184例DCIS患者為對照組(DCIS組),年齡25~76歲,中位年齡53歲。組織學分級診斷標準參照2012年WHO乳腺腫瘤組織學分類[2]。
1.2方法所有標本均經中性甲醛溶液固定,常規脫水,石蠟包埋,連續切片(4 μm厚),HE染色,光學顯微鏡下觀察。免疫組織化學染色采用EnVision法,二氨基聯苯胺顯色。一抗ER、PR、HER2、Ki-67為鼠抗人單克隆即用型抗體,購自瑞士羅氏公司。一抗AE1/AE3、p63為鼠抗人單克隆即用型抗體,購自丹麥DAKO公司。一抗濃縮液caveolin-1購自英國Abcam公司,按1∶300稀釋。即用型二抗以及其他輔助試劑均購自福建福州邁新生物技術開發公司。用磷酸鹽緩沖液代替一抗做陰性對照,用已知陽性表達的乳腺癌組織做陽性對照。染色步驟嚴格按說明書進行。
由2位病理科醫師采用雙盲法分別觀察并交換結果。所有DCIS-MI(圖1)均經AE1/AE3、p63(圖2)雙標記證實。ER(圖3)、PR、Ki-67(圖4)的陽性信號位于細胞核(棕褐色染色細胞數>1%為陽性,標準參照2012年WHO乳腺腫瘤組織學分類[2]);按Ki-67細胞核棕褐色染色細胞占全部細胞的百分率計算細胞增殖指數。caveolin-1(圖5)陽性信號位于細胞膜和(或)細胞質(棕褐色染色細胞數>10%為陽性);HER2(圖6)陽性信號位于細胞膜,1+/0、2+、3+參照2014年乳腺癌HER2檢測指南[3]。陽性細胞數均經隨機選5個高倍視野(×400)計算得出。
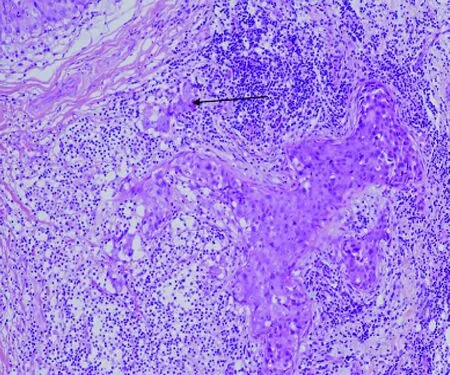
圖1 DCIS-MI病理組織學照片(HE染色,×100)
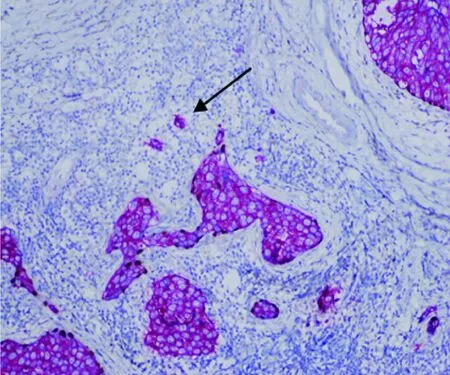
圖2 AE1/AE3在DCIS-MI上皮陽性表達、
圖3 ER在DCIS-MI陰性表達(免疫組織化學染色,×100)
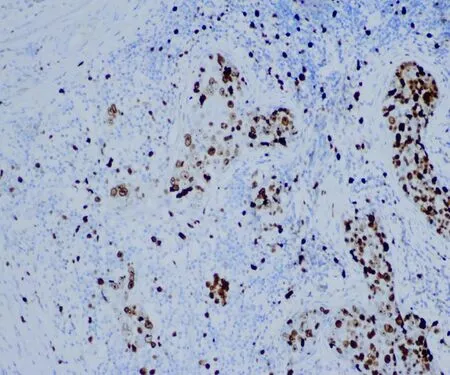
圖4 Ki-67在DCIS-MI表達≥14%(免疫組織化學染色,×100)
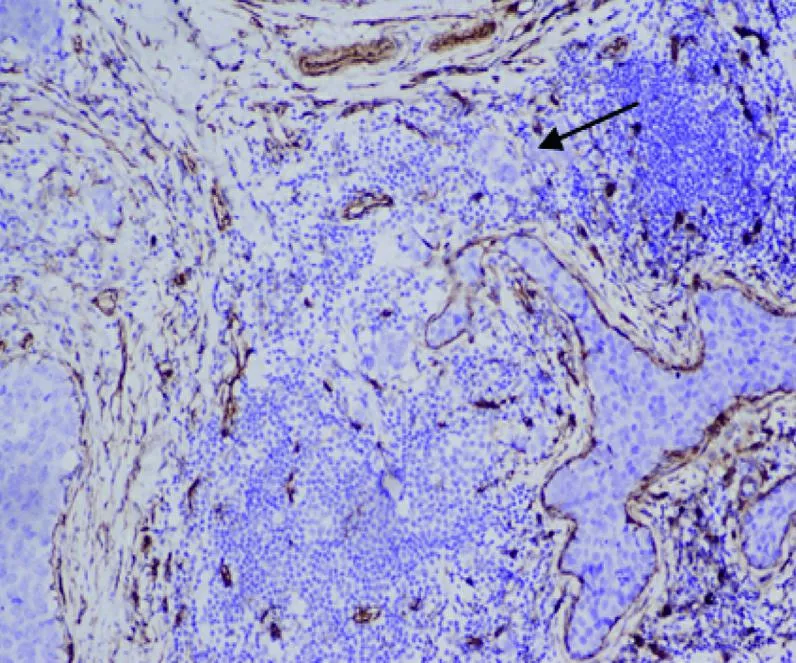
圖5 caveolin-1在DCIS-MI基質表達陰性
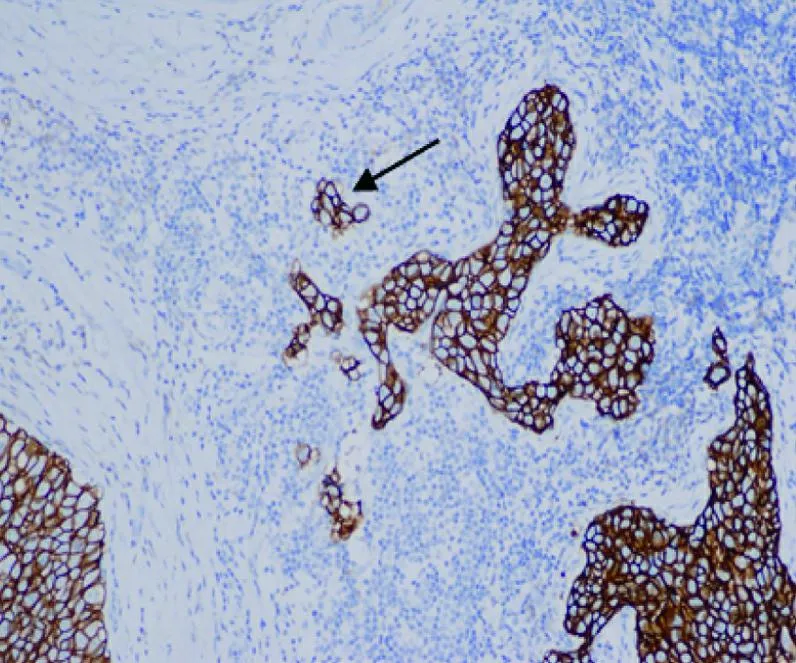
圖6 HER2在DCIS-MI表達3+(免疫組織化學染色,×100)
1.3統計學處理采用SPSS 17.0軟件進行統計學分析,計量資料比較采用χ2檢驗、Fishers確切概率法,等級資料采用Wilcoxon秩和檢驗。以P<0.05為差異有統計學意義。
2結果
2.1臨床特征比較DCIS-MI組腫塊最大徑≥2.5 cm組患者比例與DCIS組患者差異有統計學意義(P<0.01),兩組乳頭paget病及腋窩淋巴結轉移的比例差異均無統計學意義(P>0.05)。見表1。
2.2組織學特征比較兩組高級別組織分級、粉刺型組織亞型的患者比例差異均有統計學意義(P<0.01),見表2。
2.3免疫組織化學特征比較兩組ER、PR、caveolin-1陰性表達及HER2、Ki-67陽性表達患者的比例差異均有統計學意義(P<0.01),見表3。

表1 DCIS-MI與DCIS臨床特征的比較 (n,%)
注:與DCIS比較,*P<0.01
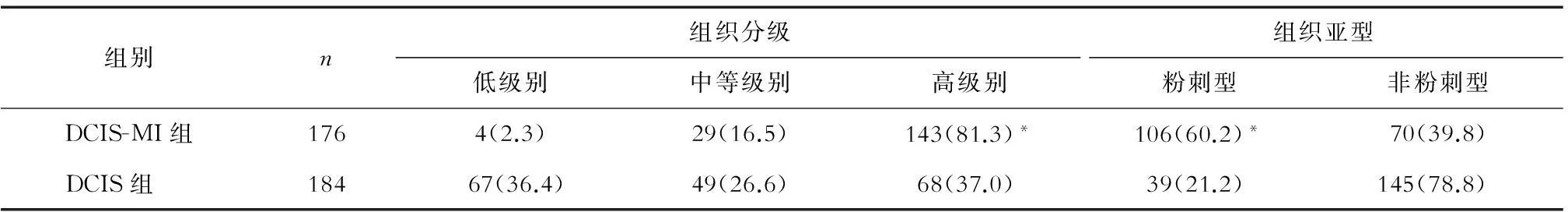
表2 DCIS-MI與DCIS組織學特征的比較 (n,%)
注:與DCIS組比較,*P<0.01
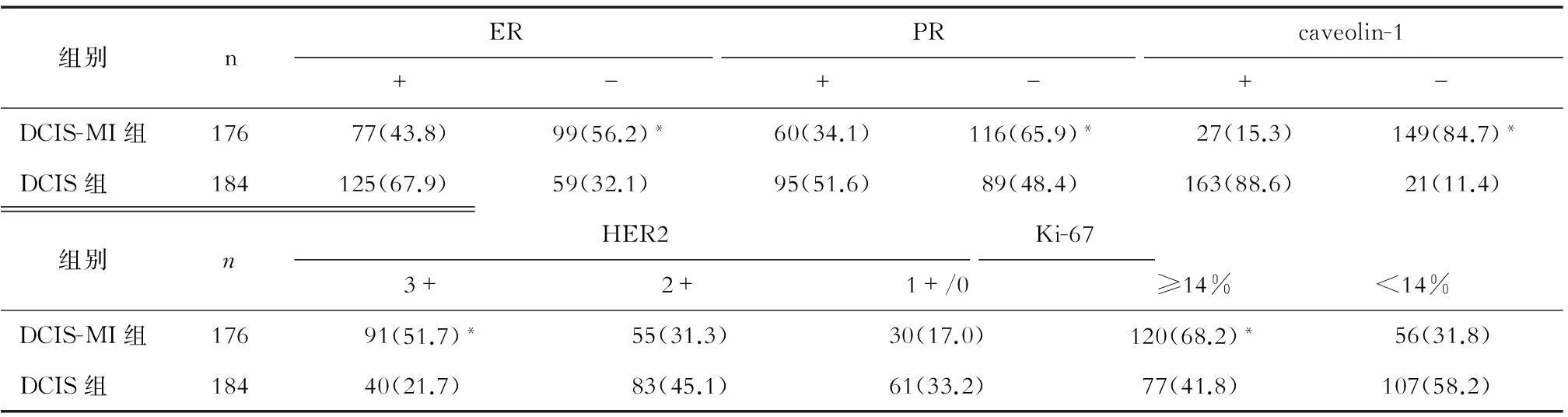
表3 DCIS-MI與DCIS免疫組織化學特征的比較 (n,%)
注:與DCIS組比較,*P<0.01
3討論
近年來,隨著乳房檢查的普及以及早期檢查技術的提高,DCIS-MI檢出率呈上升趨勢[4]。Stuart等[5]認為細胞角蛋白(cytokeratin,CK)和p63免疫組織化學雙標記在鑒別診斷DCIS-MI時有幫助,因此在本研究中采用了AE1/AE3與p63雙標記。2012年WHO乳腺腫瘤組織學分類[2]中對于DCIS-MI的發病率沒有明確的表述,但提出應避免過診斷,且認為免疫組織化學標志物有助于鑒別診斷。
本研究中兩組乳頭paget病、腋窩淋巴結轉移的患者比例差異無統計學意義,與Hanna等[6]的研究觀點相一致。國內外對DCIS-MI是否需要進行腋窩淋巴結清掃一直有爭議。Silver等[7]認為,腋窩淋巴結清掃術后并發癥較重,不提倡作為DCIS-MI的常規治療;Hanna等[6]也認為對DCIS-MI常規前哨淋巴結活檢應慎重。同時Silver等[7]和Maffuz等[8]認為,DCIS的腫塊最大徑對微浸潤及淋巴結轉移均有提示意義,當DCIS腫塊最大徑>2.5 cm時易發生微浸潤,并有腋窩淋巴結轉移風險。本研究中兩組腫塊最大徑≥2.5 cm、高級別組織分級、粉刺型組織亞型患者比例差異均有統計學意義。DCIS-MI高級別組織分級、粉刺型組織亞型的患者比例與文獻[9]報道的41%~76%、46%~82%相似。因此,當高級別DCIS為粉刺型、腫塊最大徑≥2.5 cm時,應充分取材,避免遺漏微浸潤,若陰性可行前哨淋巴結活檢而免做腋窩淋巴結清掃,陽性則再行腋窩淋巴結清掃。這樣既可避免過度治療,又可減少腋窩淋巴結轉移的發生。
臨床上ER、PR和HER-2是判斷浸潤性乳腺癌預后的重要指標,但DCIS進展為浸潤癌的具體機制仍不清楚。Okumura等[10]報告,DCIS和DCIS-MI腫塊中ER、PR、HER2的表達差異無統計學意義。但Mori等[11]研究認為,DCIS-MI中ER陰性率、HER2陽性率更高,且與DCIS Ki-67指數差異有統計學意義。本研究DCIS-MI組ER陰性、PR陰性、HER2陽性、Ki-67≥14%率大于DCIS組,差異均有統計學意義,支持Mori等[11]的研究觀點。腫瘤周圍成纖維細胞可以抑制周圍上皮細胞發生惡變,并能使癌變的細胞轉化為正常上皮細胞;但未活化的成纖維細胞活化為癌相關成纖維細胞后,可以促進腫瘤形成及影響腫瘤細胞侵襲和轉移。Martins等[12]研究認為,DCIS基質caveolin-1表達丟失與DCIS進展為浸潤性乳腺癌密切關聯,DCIS基質caveolin-1表達抑制75%可能是DCIS進展為浸潤性乳腺癌的關鍵點。本研究中兩組基質caveolin-1陰性表達差異有統計學意義,這提示腫瘤基質caveolin-1表達抑制對DCIS-MI的發生也有提示意義。
參考文獻
[1]Lagios MD,Westdahl PR,Margolin FR,et al.Duct carcinoma in situ.Relationship of extent of noninvasive disease to the frequency of occult invasion,multicentricity,lymph node metastases,and short-term treatment failures[J].Cancer,1982,50(7):1309-1314.
[2]Lakhani SR,Ellis IO,Schnitt SJ,et al.WHO classification of tumours of the breast(IARC WHO Classification of Tumours)[M].4th ed.2012:30-68.
[3]《乳腺癌HER2檢測指南(2014版)》編寫組.乳腺癌HER2檢測指南(2014版)[J].中華病理學雜志,2014,43(4):262-267.
[4]Bianchi S,Vezzosi V.Microinvasive carcinoma of the breast[J].Pathol Oncol Res,2008 ,14(2):105-111.
[5]Stuart J,Laura C.Biopsy interpretation of the breast[M].2nd ed.Philadephia:Lippincott Williams and Wilkins,2012:1-512.
[6]Hanna MG,,Jaffer S,Bleiweiss IJ,et al.Re-evaluating the role of sentinel lymph node biopsy in microinvasive breast carcinoma[J].Mod Pathol,2014,27(11):1489-1498.
[7]Silver SA,Tavassoli FA.Mammary ductal carcinoma in situ with microinvasion[J].Cancer,1998,82(12):2382-2390.
[8]Maffuz A,Barroso-Bravo S,Nájera I,et al.Tumor size as predictor of microinvasion,invasion,and axillary metastasis in ductal carcinoma in situ[J], J Exp Clin Cancer Res,2006,25(2):223-227.
[9]沈旭霞,楊文濤.乳腺導管原位癌伴微浸潤[J].中華病理學雜志,2010,39(11):781-784.
[10]Okumura Y,Yamamoto Y,Zhang Z,et al.Identification of biomarkers in ductal carcinoma in situ of the breast with microinvasion[J].BMC Cancer,2008,8:287.
[11]Mori M,Tsugawa K,Yamauchi H,et al.Pathological assessment of microinvasive carcinoma of the breast[J].Breast Cancer,2013,20(4):331-335.
[12]Martins D,Be?a FF,Sousa B,et al.Loss of caveolin-1 and gain of MCT4 expression in the tumor stroma:key events in the progression from an in situ to an invasive breast carcinoma[J].Cell Cycle,2013,12(16):2684-2690.
Analysis of Pathological and Immunohistochemical Features of Breast Ductal Carcinoma in Situ with Microinvasion
XUMing△YEHui△*YEMannaYUYanmin#
DepartmentofPathology,*DepartmentofSurgery,#DepartmentofBreastSurgery,TheCentralHospitalofShanghaiHuangpuDistrict,Shanghai200002,China
AbstractObjective: To compare the clinicopathological and immunohistochemical features of ductal carcinoma in situ(DCIS) with those of DCIS with microinvasion(DCIS-MI).Methods: The clinical data of 176 cases of DCIS-MI and 184 cases of DCIS were collected and the clinicopathological and immunohistochemical features were analyzed.Results: The differences between the proportion of tumor maximal diameter≥2.5 cm, high grade, comedo subtype in DCIS-MI and those in DCIS, were statistically significant(P<0.01). The differences in proportions of nipple with paget’s disease and axillary lymph node metastasis between the two groups were not statistically significant(P>0.05). The difference between the two groups in immunohistochemical markers estrogen receptor(ER),progesterone receptor(PR),human epidermal growth factor receptor 2(HER2), Ki-67, caveolin-1 expression was statistically significant(P<0.05).Conclusion: DCIS-MI shows high incidence in high grade, comedo subtype,tumor maximal diameter≥2.5 cm, ER negative, PR negative, caveolon-1 positive, HER2-positive, Ki-67 proliferation index≥14%.
Key WordsDuctal arcinoma in situ with microinvasion;Ductal carcinoma in situ;Immunohistochemistry
中圖分類號R737.9
文獻標識碼A
通訊作者余燕民,E-mail:yuyanmin75@126.com
基本項目:上海市黃浦區優秀學科帶頭人項目;黃浦區衛計委科研項目(編號:HKW201412)
△徐明和葉輝對本文有同等貢獻,為共同第一作者。
·
論著
·

