水稻耐冷性研究進展及建議
陳慧珍+江衛平+謝蔚+劉霞萍+黃良萍

摘要:低溫冷害是水稻減產的主要原因之一。就低溫脅迫對水稻的危害性、水稻冷害類型及鑒定指標、水稻耐冷性遺傳及QTL(數量性狀基因座)研究、水稻耐冷信號傳導及轉錄因子調控方面進行了概述。介紹了水稻耐冷性研究中存在的一些問題,并提出了相應的對策和建議。
關鍵詞:水稻;耐冷;數量性狀基因座;轉錄因子
中圖分類號:S511 ? ? ? ?文獻標識碼:A ? ? ? ?文章編號:0439-8114(2015)02-0257-05
DOI:10.14088/j.cnki.issn0439-8114.2015.02.001
Advances and Suggestion of Cold Tolerance of Rice
CHEN Hui-zhen1,JIANG Wei-ping2,XIE Wei3,LIU XIA-ping1,HUANG Liang-ping1
(1.Pingxiang Municipal Institute of Agricultural Science, Pingxiang, 337000 Jiangxi, China;2.Key Laboratory of Crop Physiology/Ecology and Genetic Breeding,Ministry of Education,Key Laboratory of Crop Physiology,Ecology and Genetic Breeding of Jiangxi Province,Jiangxi Agricultural University,Nanchang 330045,China;3.The Seed Administration of Pingxiang,Pingxiang 337000,Jiangxi,China)
Abstract: Chilling injury is one of the main reasons causing the decrease of rice yield. The effects of low temperature stress on rice, types of cold injury in rice and identification indicators of cold tolerance of rice, genetics and QTLs(quantitative trait loci) of cold tolerance of rice, signal transduction and regulation of transcription factors of cold tolerance of rice were reviewed. Problems and advices of studying cold tolerance of rice were proposed.
Key words: rice; cold tolerance; QTL; transcription factor
水稻是喜溫作物,對溫度極為敏感,低溫對水稻產量影響極大。有研究表明,中國每年因低溫冷害損失30億~50億kg稻谷,相當于糧食產量的1%[1]。為減小低溫對早秈稻的影響,除采取適當的栽培管理措施,根據不同水稻品種的特性調整播期外,選用配套的耐冷品種不失為經濟、有效的措施。因此,選育出高產、穩產的耐冷水稻品種并應用于生產實際,對當今水稻的安全生產,保證水稻生產的可持續發展有著重要的意義。然而,目前水稻耐冷性育種方式主要采用育種年限長的傳統育種方式,水稻耐冷性的研究也一直停留在耐冷基因的定位[2-4],以及通過基因工程等手段研究耐冷基因對水稻耐冷性的生理生化影響[5,6],并未更多地將定位出的效果顯著的耐冷基因應用于水稻分子育種。隨著分子標記技術的出現,分子標記輔助選擇育種(Molecularassisted selection, MAS)被廣泛應用于高產、優質及抗性強的水稻新品種的選育[7,8],因此利用分子標記技術與傳統育種技術相結合的方式進行水稻耐冷性育種是很有必要的。
1 ?低溫對水稻的影響
低溫冷害會導致水稻生長緩慢或非正常生長的現象,這是由于低溫條件下,植株體內酶活性降低,結構蛋白和非結構蛋白合成速率降低,細胞膜流動性降低,ROS(Reactive oxygen species,活性氧簇)含量的增加,抗氧化酶活性呈現先升后降趨勢,活性氧產生和清除的平衡機制被打破,導致各種生理機能遭受到破壞,進而使得水稻表現出植株矮小、葉片窄小縮短,生長發育受到阻礙,嚴重的則導致水稻植株死亡。同時,冷脅迫下的水稻植株體內會發生一系列復雜的適應低溫環境的生理生化變化,耐冷相關因子活性改變,激素的增加與減少,光合速率、呼吸作用及蒸騰速率的減弱,從而增強其對低溫條件的抗性并減小低溫環境對其傷害[9-12]。倒春寒是南方早稻播種育秧期的主要災害性天氣。長江中下游及華南地區的早稻孕穗揚花期還可能遭遇五月寒。寒露風是南方晚稻生育期的主要氣象災害之一。9月中下旬是長江中游雙季晚稻的抽穗揚花期,易受“寒露風”危害,造成“翹穗頭”、“包頸穗”、“白穎”現象。研究表明,低溫冷害嚴重影響水稻生長發育,早稻苗期和芽期遭遇低溫會導致出芽時間延長、爛種、秧苗不發、爛秧、死苗、生長發育延遲,最終導致產量減少[13];孕穗期低溫往往容易造成水稻空殼率大幅上升,降低單位面積產量;而抽穗期和灌漿期低溫往往降低水稻的灌漿速率和稻米品質[14]。
2 ?水稻冷害類型及鑒定指標
冷害是指作物在其生長所需的適溫以下至冰點以上溫度范圍內所發生的生長停滯或生育障礙現象。水稻在最低溫度8~10 ℃、最高溫度40~50 ℃范圍內能夠維持生長,但水稻生長所需的適宜溫度為15~18 ℃至30~33 ℃,粳、秈稻分別在15 ℃和 18 ℃以下就會發生冷害[15]。低溫冷害對水稻的影響包括低溫發生期間和低溫發生后兩個階段。不同的水稻品種正常生長發育所需的溫度不同,對低溫的忍耐能力有差異,其中粳稻的耐低溫能力顯著強于秈稻[16],不同秈稻之間也有一定的差異。不同的生育階段對低溫冷害的抗性也不同,表現出的癥狀也不同。根據不同的區分標準,可分為不同的冷害類型;根據低溫使水稻產量受損的原因,最早將水稻低溫冷害分為延遲型冷害、障礙型冷害,后又增加了混合型冷害和稻瘟病型冷害;根據低溫冷害發生的時期,劃分為芽期冷害、苗期冷害、孕穗期冷害、開花期冷害和灌漿期冷害[17]。endprint
水稻耐冷性鑒定指標大致可分為形態指標、生長發育指標和生理生化指標。形態指標有根系發達程度、葉片的形態以及分蘗數、穗的長度等;生長發育指標有存活率、死苗率、葉赤枯度、萎蔫率及花藥長度等;生理生化指標有葉片外滲電導率、MDA(Malondialdehyde,丙二醛)含量、脯氨酸含量、莖稈溢泌量及可溶性糖含量等[18]。以形態指標、生長發育指標為水稻耐冷性評價指標的研究頗為詳細,韓龍植等[19]做過詳細的綜述,本文不再贅述。Sang-Ic等[20]利用耐冷型水稻品種M-202和冷敏感水稻品種IR50為材料,將水稻低溫脅迫下生理生化變化進行量化,并轉化為可視化的耐冷性鑒定指標,認為電解質泄漏率和脯氨酸含量與可視化耐冷指標顯著相關。水稻不同時期的耐冷性不同,其評價指標也不同。研究者較為常用的耐冷性評價指標是不同時期低溫下種子的發芽勢、芽期的成苗率、幼苗期和分蘗期的葉赤枯度、孕穗期的結實率等,均有較為詳細的耐冷強度等級評價標準,耐冷性的生理生化指標雖有不少研究,由于不全面而缺乏系統,還沒有形成細化的評價等級標準。
3 ?水稻耐冷性遺傳及QTL研究
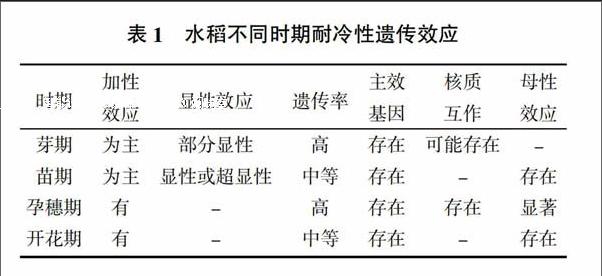
水稻耐冷性是一種受基因控制的可遺傳性狀(表1,-表示目前沒有查到相關研究)。近年來許多研究者對水稻耐冷性進行了遺傳特征研究,主要有以下4種觀點:①水稻耐冷性是受質量性狀控制的質量性狀;②水稻耐冷性是受多基因控制的數量性狀;③水稻耐冷性由基因的加性效應及加性互作效應共同控制;④水稻耐冷性為加性-顯性遺傳模型。
同時也有部分研究認為,水稻耐冷性還受細胞質影響[18,21]。然而,在水稻不同生長期耐冷性遺傳的特征不同,同一生長時期也表現出不同的遺傳特征。簡水溶[18]利用東鄉野生稻/協青早B//協青早B構建的228個回交重組自交系群體(BC1F10),以萎蔫率和死苗率為耐冷性鑒定指標,進行苗期耐冷性遺傳分析。結果表明,平均萎蔫率和死苗率分別為67.40%和70.80%,均呈偏態的連續分布,且耐冷性分離比為1∶3,故而認為東鄉野生稻苗期耐冷性遺傳為質量-數量性狀遺傳,存在耐冷性狀的主效數量性狀基因位點;也有研究表明基因的加性效應和加性互作效應共同控制了水稻苗期的耐冷性[20];王尚明等[22]對以東野1號與弱耐冷粳稻和秈稻品種配置的贛早秈49/東野1號和粳稻0298/東野1號的雜交后代進行了苗期耐冷性遺傳研究。結果表明,東野1號在幼苗3葉期強耐冷性遺傳屬于加性-顯性遺傳模型,基因效應為加性和顯性效應,受1對細胞核顯性基因所控制;有研究者表明,水稻芽期耐冷性受基因的累加效應控制[23];戴陸園等[24]利用強耐冷品種昆明小白谷與弱耐冷性品種十和田配制的雜交F2、B2F1等為材料,以結實率為耐冷性指標進行水稻孕穗期耐冷性遺傳研究。結果表明,水稻孕穗期耐冷性受1~2對主效基因控制;楊樹明等[25]在云南省阿子營自然低溫條件下,對以粳稻麗江新團黑谷耐冷基因作供體培育的近等基因系孕穗期耐冷性8個指標性狀(結實率、穗頸長、株高、穗下節長、穗長、每穗實粒數、每穗秕粒數、總粒數)做了深入的遺傳研究。結果表明,大多數性狀檢測到有主基因、多基因存在。因此,無論水稻耐冷性遺傳是受質量性狀控制、受數量性狀控制、受加性效應及加性互作效應共同控制,還是受細胞質的影響,都需要更進一步的驗證,水稻耐冷性遺傳規律的研究還有待深入。
不同形態指標性狀的耐冷性QTL表現出不同的遺傳特點[25],隨著DNA分子標記技術的日漸成熟,QTL鑒定技術也不斷完善,其檢測效應和定位精度也越來越高。根據Gramene數據庫(http://www.gramene.org/)的統計,目前已鑒定的水稻耐冷性相關QTL有37個(表2)。由表2可知,耐冷QTL12個染色體上均有分布,其中定位在第4和第8號染色體上的數量最多,分別占16.22%和13.51%,而在第5和第9號染色體上檢測到的QTL最少,均只有1個,占2.70%。
通過比較Gramene公布已經鑒定出的QTL位點可以得出,不同時期[27,28,31]、不同遺傳背景[27,30]能夠定位到同樣的耐冷性QTL位點。聶元元等[34]通過對比研究認為QTL檢測結果受不同鑒定時期影響較大,受環境和遺傳背景影響較小,同樣的鑒定群體和低溫條件在不同的生長時期檢測到的QTL所在位點共同的較少,而不同的群體或不同的低溫處理也能檢測相同的QTL位點。不同的遺傳背景或不同的環境條件下能夠檢測到相同的QTL位點,將有助于相關耐冷性狀的分子標記輔助選擇育種,更快地培育出該性狀的強耐冷品種。然而,分子標記和連鎖分析存在著自身的缺點,導致置信區間較大,定位不精確,難以克隆,只能鑒定兩個等位基因之間的效應,因此在不同分離群體的可重復性不好,難以更好地應用于現代分子設計育種。
4 ?水稻耐冷信號轉導及轉錄因子調控
植物在感受低溫信號后,通過信號轉導過程調控細胞內抗冷相關蛋白的表達,進而調整自身的生理狀態或形態來適應低溫環境。隨著檢測出的耐冷相關基因的增多及轉錄因子對耐冷性調節的作用發現,轉錄因子同時調控下游許多抗逆基因的表達[35]。轉錄因子包括組成型和誘導型,植物抗逆性轉錄因子大致分為WRKY類、MYB類、bZIP類、NAC類和AP2/EREBP類五類。研究表明,耐冷信號轉導包括ABA(Abscisic acid,脫落酸)依賴型和ABA非依賴型[36,37]。ABA依賴型信號轉導依賴于內源ABA的積累或外源ABA的處理,其信號轉導的具體調控機理尚未闡明。非依賴型是通過膜的流動性和蛋白構象的變化感受冷信號,然后激活Ca2+通道,誘導胞質Ca2+的瞬時增加[38],而Ca2+的增加導致CBF(C-repeat-binding factor)和COR (Cold-regulated protein,低溫調節蛋白)基因的高表達,提高植物耐冷能力。
由植物冷馴化的信號傳導網絡圖[39]得出,轉錄因子在植物耐冷信號轉導中起著重要的作用,轉錄因子可以激發功能基因表達或抑制功能基因的表達,進而調控下游更多的耐冷功能基因發揮作用,使植物更快地適應低溫環境。CBF是含有一個保守結構域AP2/EREBP,調節植物對低溫、干旱等逆境分子應答的轉錄因子,其表達翻譯受bHLH類轉錄激活因子ICE的調控,CBF可結合到COR基因的順式作用元件CRT/DRE上誘導一系列COR基因的表達。ICE-CBF-COR途徑是目前已知的低溫信號轉導途徑中非常重要的環節。另一個重要的途徑是FLC依賴途徑SOC1-CBF-FLC,FLC又反饋抑制SOC1的表達。有研究者認為FLC能顯著增強植物耐冷性[40]。Seo等[35]通過敲除和過量表達SOC1,認為SOC1可以負調控CBFs和COR等其他耐冷基因。endprint
5 ?存在的問題及展望
水稻在不同生育時期對低溫的抗性不同,做出的反應也不同,其對低溫抗性的鑒定指標也不同,韓龍植等[15,19]已對不同時期水稻耐低溫能力的鑒定指標做了詳細的綜述。然而對以下3點的研究有所不足:①未提出不同時期之間耐冷性的相互聯系和評價指標。②以低溫下根系活力及根系生理變化作為耐冷性鑒定指標的研究較少且缺乏系統性。③低溫下水稻生理生化指標的耐冷性指標的研究缺乏規范和標準化,已有的研究中可供參考的較為有限。植株體內生理生化指標的變化直接反映植株的生長發育狀況。比起形態指標和生長發育指標,生理生化指標更快速、更準確地反映植株對逆境條件的抗性能力,值得深入的研究。雖然已有研究者對低溫下水稻植株各種生理指標的含量變化進行研究,Sang-Ic等[20]利用低溫下電解質泄漏率和脯氨酸含量鑒定出一些耐冷品種和冷敏感品種。然而,有待做進一步的研究和制定詳細的可定量的耐冷性鑒定評級標準。
近年來,國內外定位了不少水稻耐冷性相關QTL位點,但應用于水稻耐冷性育種實踐的卻收效甚微,主要因為:①采用的定位方法和定位所用的群體,由于技術本身的缺陷導致所得到的圖譜精度有限;②研究者對已定位出的不同QTL位點之間的內在關系知之甚少;③目前利用基因工程進行耐冷育種研究都是轉入單個QTL位點,Zhang等[41]做了大量研究工作,但進展不理想,難以進行大面積推廣種植。所以,要提高分子育種的效應,首先應找到改進基因定位的方法,已有研究者提出以連鎖不平衡為基礎的關聯分析法[42],并且認為將關聯作圖法和連鎖作圖法結合起來,定位效果更加明顯[43],這種基因定位方式已在玉米研究中得到應用[44];其次應加強各QTL之間內在聯系的研究;最后,從耐冷性的整個調控網絡來看,對單個基因來講,轉錄因子對耐冷性調控的影響更大,所以應從改進轉錄因子的表達活性入手,達到增強水稻耐低溫能力的目標。
隨著分子生物學的長足進展以及分子標記、QTL定位、高通量測序及SNP(Single nucleotide polymorphisms,單苷酸多態性)等技術的創新,研究者已定位并克隆出一些水稻耐冷基因,并且試圖通過在水稻中導入耐冷基因,進行水稻抗冷害育種,育種實踐中,同時研究耐冷基因的耐低溫的作用機理。隨著分子標記的迅速發展以及水稻全基因組測序的完成,分子標記輔助選擇育種(MAS)越來越凸顯出其相對于傳統育種方法的優勢[45]。育種實踐中,首先應選擇有目標性狀的種質資源,與當地主推種植水稻品種構建重組自交系、等基因系等標記群體,利用RFLP(Restriction fragment length polymorphism,限制性內切酶片段長度多態性)、RAPD(Random amplified polymorphic DNA,隨機擴增多態性DNA標記)、SSR(Simple sequence repeats)等標記技術及已公布的耐冷標記位點,將已定位出的精細耐冷QTL位點聚合到當地種植水稻品種中,并開發優良的分子標記;然后利用田間表型觀察和分子標記輔助育種相結合的方法觀察不同耐冷QTL之間及其與環境間的互助效應,從而加快耐冷品種的選育進度和準確度,更快地選育出適合相應稻區穩產高產的耐冷品種,為糧食安全生產奠定基礎。
參考文獻:
[1] 趙正武,李仕貴,黃文章,等.水稻不同低溫敏感期的耐冷性研究進展及前景[J].西南農業學報,2006,19(2):330-335.
[2] FUJINO K, SEKIGUCHI H, MATSUDA Y, et al. Molecular identification of a major quantitative trait locus, qLTG3-1, controlling low-temperature germinability in rice[J]. Proceedings of the National Academy of Sciences, 2008, 105(34): 12623-12628.
[3] KOSEKI M, KITAZAWA N, YONEBAYASHI S, et al. Identification and fine mapping of a major quantitative trait locus originating from wild rice, controlling cold tolerance at the seedling stage[J]. Molecular Genetics and Genomics, 2010, 284(1):45-54.
[4] ZHOU L, ZENG Y, ZHENG W, et al. Fine mapping a QTL qCTB7 for cold tolerance at the booting stage on rice chromosome 7 using a near-isogenic line[J]. Theoretical and Applied Genetics,2010,121(5):895-905.
[5] LIU H, MA Y, CHEN N, et al. Overexpression of stress-inducible OsBURP16, the β subunit of polygalacturonase 1, decreases pectin content and cell adhesion and increases abiotic stress sensitivity in rice[J]. Plant, Cell & Environment, 2014, 37(5):1144-1158.
[6] XIAO N, HUANG W, ZHANG X, et al. Fine mapping of qRC10-2, a quantitative trait locus for cold tolerance of rice roots at seedling and mature stages[J]. PloS One, 2014, 9(5):46-60.endprint
[7] 方珊茹,吳春珠,劉玉芹,等.分子標記輔助選擇改良Ⅱ-32B的外觀品質[J].分子植物育種,2013,11(6):673-679.
[8] 朱玉君,樊葉楊,王惠梅,等.應用分子標記輔助選擇培育兼抗稻瘟病和白葉枯病的水稻恢復系[J].分子植物育種,2014,12(1): 17-24.
[9] 曹 ?可,秦玉芝,高琪昕,等.硒對低溫脅迫下植物抗寒性影響的研究進展[J].中國農學通報,2014,30(11):200-204.
[10] 王春萍,雷開榮,李正國,等.低溫脅迫對水稻幼苗不同葉齡葉片葉綠素熒光特性的影響[J].植物資源與環境學報,2012, ?21(3):38-43.
[11] 張 ?蕊,高志明,呂 ?俊,等.外源水楊酸對水稻幼苗耐寒性的影響[J].江蘇農業科學,2012,40(6):62-65.
[12] 朱 ?珊,熊宏亮,黃仁良,等.低溫脅迫對水稻生理指標的影響[J]. 江西農業學報,2013,25(7):10-12.
[13] 陸婷婷.水稻芽期耐冷性的QTL初步定位[D].長沙:中南大學, 2012.
[14] 宋廣樹,孫忠富,孫 ?蕾,等.東北中部地區水稻不同生育時期低溫處理下生理變化及耐冷性比較[J].生態學報,2011,31(13):3788-3795.
[15] 韓龍植,高熙宗,樸鐘澤.水稻耐冷性遺傳及基因定位研究概況與展望[J].中國水稻科學,2002,16(2):193-198.
[16] NISHIYAMA I. Effects of temperature on the vegetative growth of rice plants[A]. Proceedings of the Symposium on Climate and Rice[C]. Manila: IRRI,1976.159-185.
[17] 樓巧君.水稻耐冷性遺傳基礎研究[D].武漢:華中農業大學,2000.
[18] 簡水溶.東鄉野生稻苗期耐冷性QTL定位[D].南昌:江西師范大學,2011.
[19] 韓龍植,張三元.水稻耐冷性鑒定評價方法[J].植物遺傳資源學報,2004,5(1):75-80.
[20] SANG-IC K, THOMAS H T. Evaluation of seedling cold tolerance in rice cultivars: a comparison of visual ratings and quantitative indicators of physiological changes[J]. Euphytica, 2011,178(3):437-447.
[21] CHUNG G S. The rice cold tolerance program in Korea[A]. Report of a Rice Cold Tolerance Workshop[C]. Manila: IRRI.1979.7-19.
[22] 王尚明,賀浩華,肖葉青,等.水稻東野1號苗期耐冷性遺傳分析[J].湖北農業科學,2008,47(1):1-4.
[23] JUN B T, KIM J I, CHO S Y. Studies on the inheritance of quantitative characters in rice. VIII. Analysis on the low temperature germination in diallel cross of F2 generation[J]. Korean Journal of Breeding,1987,19(3):240-244.
[24] 戴陸園,葉昌榮,徐福榮,等.云南稻種昆明小白谷耐冷性指標性狀的遺傳分析[J].中國水稻科學,1999,13(2):73-76.
[25] 楊樹明,王 ?荔,曾亞文,等.粳稻麗江新團黑谷近等基因系孕穗期耐冷性指標性狀的遺傳分析[J].華北農學報,2013,28(1):7-11.
[26] 饒玉春,楊窯龍,黃李超,等.水稻耐冷脅迫的研究進展[J].分子植物育種,2013,11(3):443-450.
[27] TAKEUCHI Y, HAYASAKA H, CHIBA B, et al. Mapping quantitative trait loci controlling cool-temperature tolerance at booting stage in temperate Japonica rice[J]. Breeding Science, 2001,51(3):191-197.
[28] ANDAYA V C, MACKILL D J. Mapping of QTLs associated with cold tolerance during the vegetative stage in rice[J]. Journal of Experimental Botany,2003,54(392):2579-2585.
[29] KASHIWAGI T, ISHIMARU K. Identification and functional analysis of a locus for improvement of lodging resistance in rice[J]. Plant Physiology,2004,134(2):676-683.endprint
[30] ANDAYA V, MACKILL D. QTLs conferring cold tolerance at the booting stage of rice using recombinant inbred lines from a japonica× indica cross[J]. Theoretical and Applied Genetics, 2003,106(6):1084-1090.
[31] ABE F, SAITO K, MIURA K, et al. A single nucleotide polymorphism in the alternative oxidase gene among rice varieties differing in low temperature tolerance[J]. FEBS Letters, 2002,527(1):181-185.
[32] 嚴長杰,李 ?欣,程祝寬,等. 利用分子標記定位水稻芽期耐冷性基因[J].中國水稻科學,1999,13(3):134-138.
[33] CAI H, MORISHIMA H. QTL clusters reflect character associations in wild and cultivated rice[J]. Theoretical and Applied Genetics,2002,104(8):1217-1228.
[34] 聶元元,蔡耀輝,顏滿蓮,等. 水稻低溫冷害分析研究進展[J]. 江西農業學報,2011,23(3):63-66.
[35] SEO E, LEE H, JEON J, et al. Crosstalk between cold response and flowering in Arabidopsis is mediated through the flowering-time gene SOC1 and its upstream negative regulator FLC[J]. The Plant Cell Online, 2009,21(10):3185-3197.
[36] GILMOUR S J, THOMASHOW M F. Cold acclimation and cold-regulated gene expression in ABA mutants of Arabidopsis thaliana[J]. Plant Molecular Biology,1991,17(6):1233-1240.
[37] ISHITANI M, XIONG L, STEVENSON B, et al. Genetic analysis of osmotic and cold stress signal transduction in Arabidopsis: interactions and convergence of abscisic acid-dependent and abscisic acid-independent pathways[J]. The Plant Cell Online,1997,9(11):1935-1949.
[38] CHINNUSAMY V, ZHU J, ZHU J K. Gene regulation during cold acclimation in plants[J]. Physiologia Plantarum, 2006, 126(1):52-61.
[39] YANG T, ZHANG L, ZHANG T, et al. Transcriptional regulation network of cold-responsive genes in higher plants[J]. Plant Science,2005,169(6):987-995.
[40] SEO P J, JUNG J H, PARK M J, et al. Controlled turnover of CONSTANS protein by the HOS1 E3 ligase regulates floral transition at low temperatures[J]. Plant Signaling & Behavior, 2013,8(4):43277-43287.
[41] ZHANG F, HUANG L, WANG W, et al. Genome-wide gene expression profiling of introgressed indica rice alleles associated with seedling cold tolerance improvement in a japonica rice background[J]. BMC genomics,2012,13(1):461.
[42] 楊小紅, 嚴建兵, 鄭艷萍, 等. 植物數量性狀關聯分析研究進展[J]. 作物學報,2007,33(4):523-530.
[43] LU Y, ZHANG S, SHAH T, et al. Joint linkage-linkage disequilibrium mapping is a powerful approach to detecting quantitative trait loci underlying drought tolerance in maize[J]. Proceedings of the National Academy of Sciences, 2010, 107(45):19585-19590.
[44] YU J, HOLLAND J B, MCMULLEN M D, et al. Genetic design and statistical power of nested association mapping in maize[J]. Genetics,2008,178(1):539-551.
[45] EATHINGTON S R, CROSBIE T M, EDWARDS M D, et al. Molecular markers in a commercial breeding program[J]. Crop Science,2007,47(S3):154-163.endprint

