大孔吸附樹脂純化山刺玫果總黃酮的工藝研究
楊揚 胡雪媛 王曉林 薛健飛 鐘方麗
摘要:對山刺玫(Rosa davurica Pall.)果總黃酮的大孔樹脂純化工藝進行了優化研究,以比吸附量和比解吸量為考察指標,進行了D-101大孔樹脂純化工藝的優化。結果表明,其最佳工藝條件為生藥濃度0.025 g/mL;最佳上樣量為0.23 g/g(生藥量/樹脂量);最佳吸附時間為30 min;上柱液pH為2.0~4.0;吸附速率為1 BV/h;洗脫液為3 BV 70%乙醇,洗脫流速為1 BV/h。在此最佳條件下得到的山刺玫果提取物總黃酮含量由20%提高到85%左右。采用D-101型大孔樹脂純化山刺玫果總黃酮的效果較好,且操作簡單,為山刺玫果的綜合利用提供了依據。
關鍵詞:山刺玫(Rosa davurica Pall.);果實;D-101型大孔樹脂;總黃酮;純化
中圖分類號:R284.2 ? ? ? ?文獻標識碼:A ? ? ? ?文章編號:0439-8114(2015)02-0412-04
DOI:10.14088/j.cnki.issn0439-8114.2015.02.039
Purification of Total Flavonoids in Rosa davurica Fruit with Macroporous Adsorption Resin
YANG Yang1,2, HU Xue-yuan1,WANG Xiao-lin1, XUE Jian-fei1, ZHONG Fang-li1
(1.School of Chemistry and Pharmaceutical Engineering, Jilin Institute of Chemical Technology, Jilin 132022, Jilin,China;2. College of Chemistry, Jilin University , Changchun 130012,China)
Abstract: The purification of total flavonoids(TS) in Rosa davurica Pall. fruit with macroporous adsorption resin was optimized. The conditions of purification with D-101 macroporous adsorption resin were optimized using absorption ratio and eluation ratio of TS as evaluating indicators. The TS content of the sample, optimum loading quantity of sample(crude drugs weight/D-101 resin weight), optimum adsorption time, pH value of sample, adsorption rate, ethanol content, desorption rate, the volume of eluant was 0.025 g/mL, 0.23 g/g, 30 min, pH 2 to 4, 1 BV/h, 70% methanol solution and elution volume 3 BV, respectively. Under these conditions the TS purity changed from about 20% to 85%. The purification efficiency of TS with D-101 macroporous adsorption resin was good and easy to operate, which will provide basis for the comprehensive utlization of R. davurica fruit.
Key words: Rosa davurica Pall.; fruit; D-101 macroporous absorption resin; total flavonoids; purification
山刺玫果又名野薔薇果,系薔薇科薔薇屬植物山刺玫(Rosa davurica Pall.)的成熟果實,是一種食藥同源、經濟價值極高的野生果類[1,2],廣泛分布在我國東北、華北、西北等地。山刺玫全身是寶,《中藥大辭典》謂其果實有健脾理氣、養血調經的作用,且酸甜可食,可治消化不良、食欲不振,民間大量采食或用于泡酒、泡茶等[3,4],山刺玫果的活性成分主要有三萜類化合物、黃酮、多種維生素、微量元素及人體必需的氨基酸等[5]。山刺玫花大而美麗,為優美的綠化觀賞和綠籬樹種。山刺玫根有止咳祛痰、 抗菌止痢及止血功能。黃酮類化合物具有抗菌、抗炎、保肝、擴冠、消除體內自由基、抗衰老、增強人體免疫力等多種生理活性,還可以降低血液黏度,加快血液循環,臨床上用于腦血栓、腦動脈硬化的治療,具有高效、低毒副作用的優勢[6-9]。
大孔吸附樹脂是一類具有多孔立體結構的非離子型人工合成的有機高分子聚合物吸附劑,具有化學穩定性高、再生處理簡單、選擇性好、吸附速率快、吸附容量大、比表面積大、節省費用等諸多優點,被廣泛用于天然產物的分離和純化[10-12]。本試驗使用D-101型大孔吸附樹脂對山刺玫果總黃酮進行純化,并優化了D-101型大孔吸附樹脂純化山刺玫果總黃酮的工藝條件,為更有效地利用山刺玫果,發揮其最大經濟效益提供依據。
1 ?材料與方法
1.1 ?材料
1.1.1 ?植物材料 ?山刺玫果采自吉林市豐滿區白山鄉,經吉林化工學院藥學系薛健飛博士鑒定為薔薇科薔薇屬植物山刺玫的成熟果實。
1.1.2 ?試劑 ?蘆丁標準品,中國食品藥品檢定研究院(批號:100800-200707);D-101型大孔吸附樹脂,西安藍曉科技有限公司;硝酸鋁、氫氧化鈉、亞硝酸鈉、無水乙醇均為分析純,天津市大茂化學試劑廠;水為去離子水。
1.1.3 ?儀器 ?TU-1810型紫外分光光度計,北京普析通用儀器有限公司;JY2002型電子天平,上海精密科學儀器有限公司;RE-52AA型旋轉蒸發儀,上海亞榮生化儀器廠;SHZ-D型循環水式真空泵,河南省鞏義市英峪儀器廠;CS101-AB型電熱鼓風干燥箱,中國重慶實驗設備廠。
1.2 ?試驗方法
1.2.1 ?標準曲線的制備 ?精密稱取干燥至恒重的蘆丁標準品10.0 mg于50 mL容量瓶中,加60%乙醇溶解并稀釋至刻度,搖勻,即得濃度為0.20 mg/mL的蘆丁標準品溶液,分別吸取0.5、1.0、2.0、3.0、4.0、5.0、6.0 mL溶液于25 mL容量瓶中,在30 ℃水浴下,加5% NaNO2溶液 1.0 mL,搖勻,放置6 min,加10% Al(NO3)3溶液 1.0 mL,搖勻,放置6 min,加4% NaOH 10.0 mL,再加60 %乙醇定容至刻度,搖勻,放置15 min。以相應的試劑為空白,按照分光光度法,在505 nm處測定其吸光度A,以吸收度A為縱坐標,蘆丁標準品濃度C(mg/mL)為橫坐標,繪制標準曲線[13,14],進行直線回歸,回歸方程:A=11.868C+0.003 5,R=0.999 7,結果表明,蘆丁在0.004~0.048 mg/mL范圍內呈良好線性關系。
1.2.2 ?樣品溶液的制備 ?取粉碎的山刺玫果25 g,加6倍75%乙醇,85 ℃回流提取3次,每次5 h,過濾,合并濾液,減壓濃縮,用去離子水定容至250 mL,備用。
1.2.3 ?總黃酮含量測定 ?取樣品溶液、樹脂吸附后液和解吸液各適量,分別置于10 mL容量瓶中,以不加供試品的平行樣為空白。按“1.2.1”的方法,于505 nm處測定吸光度,根據標準曲線計算出樣品中總黃酮的含量。
1.2.4 ?樹脂的預處理 ?取D-101樹脂加入燒杯中,先以95%乙醇浸泡24 h后濕法上柱,用醇洗至流出液加水不混濁為止,后用去離子水沖洗至無醇味;然后用2 BV 2% NaOH溶液以2 BV/h的流速洗滌1 h,用去離子水洗至中性;再用1 BV 5%HCl溶液以4~6 BV/h的流速洗滌,用去離子水洗至中性,減壓抽濾干,放入廣口瓶中貼簽備用[15]。
2 ?結果與分析
2.1 ?D-101型樹脂純化工藝優化
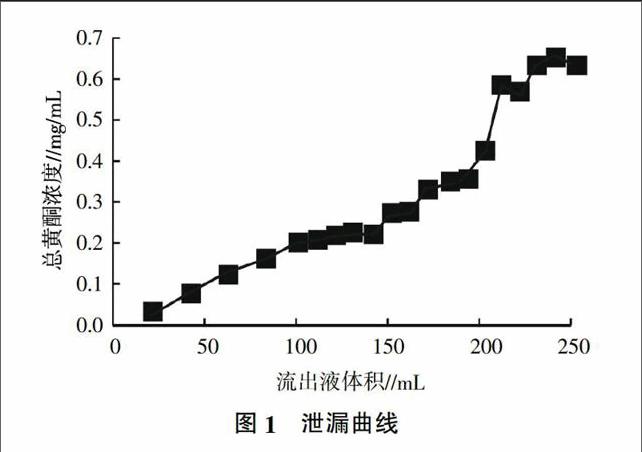
2.1.1 ?泄漏曲線 ?取處理好的D-101型大孔樹脂15 g,濕法裝柱,取生藥濃度為0.025 g/mL山刺玫果上樣液270 mL,緩慢上柱,以3 BV/h流速進行動態吸附,收集流出液,計算總黃酮濃度,泄漏曲線見圖1。由圖1可知,其泄漏點在第9個點附近,由此確定上樣量為0.23 g/g(生藥量/樹脂量)。
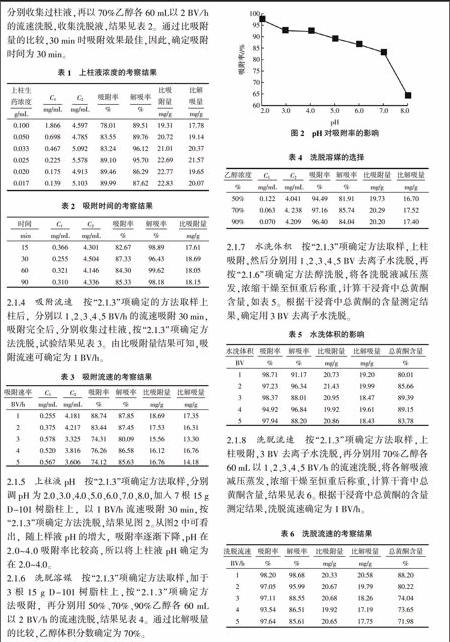
2.1.2 ?上柱液濃度 ?吸取樣品溶液適量,分別稀釋2、3、4、5、6倍,將上述樣品液加入5根15 g D-101樹脂柱上,靜止30 min,以3 BV/h的流速進行吸附,收集過柱液,再以70%乙醇60 mL以2 BV/h的流速洗脫,收集洗脫液,測定溶液中總黃酮濃度(C1為過柱液總黃酮濃度、C2為解吸液總黃酮濃度),計算比吸附量(mg/g)、比解吸量(mg/g),結果見表1 ,計算公式如下:
比吸附量=■
比解吸量=■
從解吸率和比解吸量等綜合考慮,將上樣濃度確定為原液稀釋3倍,即生藥濃度0.025 g/mL。
2.1.3 ?吸附時間 ?取生藥濃度為0.025 g/mL山刺玫果上樣液140 mL,分別加入4根15 g D-101樹脂柱上,以3 BV/h的流速分別吸附15、30、60、90 min,分別收集過柱液,再以70%乙醇各60 mL以2 BV/h的流速洗脫,收集洗脫液,結果見表2。通過比吸附量的比較,30 min時吸附效果最佳,因此,確定吸附時間為30 min。
2.1.4 ?吸附流速 ?按“2.1.3”項確定的方法取樣上柱后,分別以1、2、3、4、5 BV/h的流速吸附30 min,吸附完全后,分別收集過柱液,按“2.1.3”項確定方法洗脫,試驗結果見表3。由比吸附量結果可知,吸附流速可確定為1 BV/h。
2.1.5 ?上柱液pH ?按“2.1.3”項確定方法取樣,分別調pH為2.0、3.0、4.0、5.0、6.0、7.0、8.0,加入7根15 g D-101樹脂柱上,以1 BV/h流速吸附30 min,按“2.1.3”項確定方法洗脫,結果見圖2。從圖2中可看出,隨上樣液pH的增大,吸附率逐漸下降,pH在2.0~4.0吸附率比較高,所以將上柱液pH確定為在2.0~4.0。
2.1.6 ?洗脫溶媒 ?按“2.1.3”項確定方法取樣,加于3根15 g D-101樹脂柱上,按“2.1.3”項確定方法吸附,再分別用50%、70%、90%乙醇各60 mL以2 BV/h的流速洗脫,結果見表4。通過比解吸量的比較,乙醇體積分數確定為70%。
2.1.7 ?水洗體積 ?按“2.1.3”項確定方法取樣,上柱吸附,然后分別用1、2、3、4、5 BV去離子水洗脫,再按“2.1.6”項確定方法醇洗脫,將各洗脫液減壓蒸發,濃縮干燥至恒重后稱重,計算干浸膏中總黃酮含量,如表5。根據干浸膏中總黃酮的含量測定結果,確定用3 BV去離子水洗脫。
2.1.8 ?洗脫流速 ?按“2.1.3”項確定方法取樣,上柱吸附,3 BV去離子水洗脫,再分別用70%乙醇各60 mL以1、2、3、4、5 BV/h的流速洗脫,將各解吸液減壓蒸發,濃縮干燥至恒重后稱重,計算干膏中總黃酮含量,結果見表6。根據干浸膏中總黃酮的含量測定結果,洗脫流速確定為1 BV/h。
2.1.9 ?洗脫體積 ?按“2.1.3”項確定方法取樣,上柱吸附,3 BV去離子水洗脫,再用70%乙醇60 mL以1 BV/h的流速洗脫,按0.5個樹脂床體積(即10 mL)收集洗脫液,共收集16個流份,測定收集溶液中總黃酮質量,以洗脫液中總黃酮質量為縱坐標,流份收集編號為橫坐標作圖(圖3)。從圖3中可以看出,第6個流份以后溶液中總黃酮量基本不變,故用3 BV(60 mL)70%乙醇即可洗脫完全。
2.2 ?工藝驗證性試驗
取已處理好的D-101型吸附樹脂3份,各15 g,濕法裝柱,分別加入生藥濃度為0.025 g/mL的山刺玫果樣品液各140 mL,以1 BV/h的流速進行吸附,3 BV去離子水洗脫,然后用60 mL70%乙醇以1 BV/h的流速進行洗脫,收集洗脫液,再取樣品液、洗脫液減壓蒸發,濃縮干燥至恒重后稱重,經D-101大孔吸附樹脂處理山刺玫果總黃酮樣品溶液后,干浸膏中總黃酮含量由20%左右提高到85%左右。
2.3 ?樹脂的重復使用試驗
取已處理好的D-101型吸附樹脂3份,各15 g,濕法裝柱,按“2.2”項確定的方法,取樣上柱吸附,水洗,醇洗,收集洗脫液,按“2.2”項下制備干浸膏并測定干浸膏中總黃酮的含量,在試驗條件確定后,D-101型大孔吸附樹脂重復使用6次后,比吸附量、比解吸量變化均較小,干浸膏中總黃酮含量隨重復次數的增加有所降低,在樹脂柱使用6次后總黃酮含量由84.60%下降到74.19%。
3 ?結論
本試驗通過對D-101型大孔吸附樹脂對山刺玫果總黃酮純化試驗的研究,通過對影響大孔吸附樹脂吸附及解吸各種因素的系統研究,篩選出了D-10l型大孔吸附樹脂純化山刺玫果總黃酮的最佳工藝條件為上柱藥液濃度為0.025 g/mL,藥液pH為2.0~4.0,吸附時間30 min,吸附速率為1 BV/h,吸附后用3 BV去離子水洗脫,再用3 BV 的70%乙醇以1 BV/h的流速洗脫,純化后山刺玫果干浸膏中總黃酮含量由原來的20%提高到85%左右,樹脂可以重復使用6次,表明D-101型大孔樹脂對山刺玫果總黃酮具有較好的純化性能,D-101大孔吸附樹脂純化山刺玫果總黃酮的工藝不僅具有比吸附量、比解吸量高等特點,而且具有洗脫率較高、樹脂再生簡便等優點,在含有山刺玫果總黃酮的產品分析和生產中具有一定的推廣應用價值,為山刺玫果總黃酮在食品、藥品領域的綜合應用提供了依據。
參考文獻:
[1] 鐘方麗,王曉林,敬采月.高效液相色譜法測定刺玫果中金絲桃苷的含量[J].食品科學,2010,31(24):281-284.
[2] 鐘方麗,陳 ?帥,關曉俠.微波法提取刺玫果總黃酮工藝研究[J].江蘇農業科學,2010(6):449-451.
[3] 程東巖,王隸書,范艷君,等.刺玫果總黃酮純化工藝研究[J].時珍國醫國藥,2011,22(3):664-665.
[4] 俞作仁,王文莉,呂娟濤.刺玫果化學成分及藥理作用研究進展[J].中草藥,2002,33(2):188-190.
[5] 劉冠群,阮文輝,王曉燕.刺玫果中黃酮成分的檢測方法研究進展[J].山西中醫,2012,28(8):56-59.
[6] 王曉林.高效液相色譜法測定刺玫果槲皮素的含量[J].食品工業科技,2011,32(4):370-372.
[7] 莊志軍,鐘方麗,楊英杰,等.刺玫果中總黃酮的提取與分析[J].中成藥,2007,29(9):1394-1395.
[8] 龔麗霞,丁卓平,鄒乾林.大孔樹脂純化葎草黃酮類化合物的特性研究[J].江蘇農業科學,2009(4):314-316.
[9] 李勝華,伍賢進,牛友芽,等.大孔樹脂純化多穗柯總黃酮的工藝研究[J].江蘇農業科學,2009(5):266-268,290.
[10] 何 ?偉,李 ?偉.大孔樹脂在中藥成分分離中的應用[J].南京中醫藥大學學報,2005,21(2):134-136.
[11] 吳浩瑄,任大明,陳紅漫,等.大孔吸附樹脂對桑氏鏈霉菌HP- 47抗真菌活性物質的吸附工藝[J].江蘇農業科學,2011(4):117-120.
[12] 徐 ?耀.不同型號大孔吸附樹脂對草珊瑚黃酮的富集作用[J].江蘇農業科學,2013(5):262-265.
[13] 阿布力克木·阿布力孜,阿布力米提·阿布都卡德爾,迪麗努爾·塔力甫.新疆野生蒼耳葉中總黃酮的超聲波提取工藝研究[J].食品科學,2009,30(16):131-134.
[14] 李維莉,馬銀海,張亞平,等.菱角殼總黃酮超聲輔助提取工藝研究[J].食品科學,2009,30(14):140-142.
[15] 白奪龍,楊開華.大孔吸附樹脂分離純化技術及應用[J].海峽藥學,2007,19(9):96-99.

