接骨丹介導成骨細胞增殖促進骨折愈合的觀察
翟獻斌 吳方云
(山東省泰安市中醫醫院骨科,泰安,271000)
接骨丹介導成骨細胞增殖促進骨折愈合的觀察
翟獻斌 吳方云
(山東省泰安市中醫醫院骨科,泰安,271000)
目的:觀察接骨丹對新西蘭乳兔成骨細胞增殖的影響,探討接骨丹促進骨折愈合的機制。方法:普通級新西蘭大白乳兔,耳緣靜脈空氣栓塞處死,無菌條件下取顱蓋骨,Ⅰ型膠原酶消化法獲取成骨細胞并進行體外培養、鑒定及傳代。將鑒定后的第二代成骨細胞隨機分為正常對照組及實驗組,正常對照組應用正常兔血清培養,實驗組應用接骨丹含藥血清培養,MTT法觀測2組細胞的生長曲線;不同血清干預48 h后,倒置顯微鏡觀測接骨丹對成骨細胞堿性磷酸酶及Ⅰ型膠原表達的影響,Elisa法觀測接骨丹對成骨細胞培養上清液中骨鈣素表達的影響。結果:Ⅰ型膠原酶消化法成功獲取并建立成骨細胞體外培養體系,MTT觀測顯示實驗組能夠顯著促進成骨細胞的增值,倒置顯微鏡觀測實驗組中堿性磷酸酶及Ⅰ型膠原的表達要優于正常對照組,并能夠促進成骨細胞分泌骨鈣素。結論:接骨丹能夠促進骨折的愈合,其機制可能與促進成骨細胞中堿性磷酸酶、Ⅰ型膠原及骨鈣素的表達進而促進成骨細胞增殖和分化有關。
接骨丹;含藥血清;成骨細胞;骨折愈合
骨折是臨床最常見的多發病,具有極其復雜的修復過程,受諸多因素的影響,包括患者本身因素,醫源性因素等。從微觀來看還受內分泌激素、生物化學和生物物理因子的調控和微量元素的影響。臨床流行病學最新調查顯示約5%~10%骨折可因各種原因發生骨折遲緩愈合和不愈合,因此臨床針對如何促進骨折愈合、縮短愈合時間的研究方興未艾。骨折屬于中醫學“血瘀證”的范疇,而骨科疾病首載于《黃帝內經》,認為骨折耗損氣血,致其運行不暢,瘀積不散,因此“活血化瘀”是治療骨折的核心治則。
接骨丹具有“祛瘀、生新、合骨”的作用,亦是治療骨折的基本方劑,前期不乏研究證實接骨丹對骨折的治療具有理想療效,但關于接骨丹促折愈合的機理研究仍未明了,使得臨床上應用接骨丹缺乏實驗研究基礎,因此本研究旨在觀察接骨丹對體外培養的新西蘭兔成骨細胞增殖分化的影響,從而為接骨丹治療骨折提供基礎數據。
1 材料與方法
1.1 材料
1.1.1 實驗動物 10只普通級新西蘭大白乳兔,雌雄各半,體重4.1~5.4 kg,平均(4.8±0.8)kg,購自軍事醫學科學院實驗動物中心提供,動物合格證號為No.SCXK-(軍)2007-004。
1.1.2 主要試劑 接骨丹(規格10 g/包,由山東省泰安市中醫醫院制劑室提供)并加工成每毫升含生藥0.1 g的藥液,密封4 ℃保存備用、DMEM培養基(美國Gibco公司);MTT(Sigma公司);山羊抗小鼠IgG標記二抗(Biosharp公司);DMSO(Sigma公司);ECL發光液(碧云天);β-acting(博奧森);胰酶(Biosharp公司);堿性磷酸酶、Ⅰ型膠原及BGP單克隆抗體(北京中杉)。
1.1.3 含藥血清的制備 換算人與動物的藥物等效劑量[1],人與新西蘭兔的折算系數(W)為6.25,接骨丹等效給藥劑量(g)=人體用藥劑量(g/kg)×W×新西蘭兔的體重(g)/1 000 g=(20 g/60 kg)×6.25×新西蘭兔體重(g)/1 000 g。新西蘭兔連續灌胃5 d,于最后一次灌胃后3 h腹主動脈采血,2 500 r/min離心25 min,于56 ℃水浴滅活30 min,過濾、分裝,-20 ℃保存備用。
1.1.4 主要儀器 超凈工作臺(蘇州安泰公司);CO2培養箱(日本SANYO公司);倒置顯微鏡(日本OLYMPUS);酶標定量測定儀(Thermo Multiskan AsCant公司);低溫高速離心機(美國Sigma公司)。
1.2 方法
1.2.1 成骨細胞分離、培養、純化、傳代 普通級新西蘭大白乳兔,耳緣靜脈空氣栓塞處死,無菌條件下取顱蓋骨后立即置于預冷的0.01MPBS溶液中,將結締組織剔除干凈后再次使用0.01MPBS溶液清洗3次,隨后將顱蓋骨置于盛有DMEM培養基的培養皿中,用無菌剪刀將顱蓋骨剪成大小約0.5 mm×0.5 mm的碎塊,再加入5 mL 0.25%的胰酶消化20 min,隨后加入5 mL完全培養基(10%胎牛血清)終止消化,摒棄上清液后加入10 mLⅠ型膠原酶,置于37 ℃、5%CO2孵箱中孵育90 min,隨后離心1 000 r/min×3 min,棄去上清,再用0.01MPBS溶液清洗3次后利用200目濾網過濾顱蓋骨碎片,加入5 mL完全培養基(10%胎牛血清),用巴士吸管輕輕吹大,使細胞懸浮,接種于培養瓶中,置于37 ℃、5%CO2孵箱中孵育,24 h換液,以后隔天換液1次,棄去沒貼壁的細胞,繼續培養,待細胞鋪滿瓶底80%以上時,以0.25%的胰酶消化傳代,取第2代以后的細胞用于實驗。
1.2.2 成骨細胞鑒定 細胞進入對數生長期后接種于干凈無菌蓋玻片上,正常培養,待細胞生長匯合率達到50%~80%時棄去培養液,PBS清洗1遍,丙酮:甲醇(1∶1)室溫固定30 min,3%H2O2去離子水室溫孵育10 min,封閉用山羊血清室溫孵育30 min,滴加一抗4 ℃孵育過夜,滴加山羊抗小鼠IgG標記二抗37 ℃孵育30 min,避光,隨后置于倒置顯微鏡下觀察。每部操作之間均用PBS洗3×5 min。
1.2.3 MTT法測細胞增殖情況 將處于對數生長期的細胞密度調整為2×104個/ mL,接種于24孔板,37 ℃5%CO2培養箱培養,將實驗分為正常組及實驗組,各組6個復孔,24 h后用培養基進行同步消化24 h。正常對照組:給予不含藥DMEM完全培養液;實驗組:含體積分數為10%的接骨丹含藥血清的DMEM完全培養液。分別于加藥1、2、3、4、5、6、7、8、9、10 d后,每孔加入20 μL 5 g/L MTT,繼續孵育4 h后,吸棄上清,每孔加入DMSO150 μL,振蕩10 min,酶標儀在490 nm波長處讀取OD值。
1.2.4 堿性磷酸酶及Ⅰ型膠原表達情況 將處于對數生長期的細胞密度調整為2×104個/ mL后制成細胞涂片,4%多聚甲醛40 ℃固定過夜,0.01M PBS充分沖洗、晾干,3%H2O2室溫孵育20 min,0.01M PBS沖洗,滴加30 μL/片羊血清封閉液,室溫30 min后傾去,滴加1∶100稀釋的一抗30 μL/片(0.01M PBS稀釋),置濕盒內4 ℃過夜,0.01M PBS洗(5 min×3),滴加1∶200稀釋的生物素化二抗30 μL/片(0.01M PBS稀釋),37 ℃濕盒內溫育30 min,0.01M PBS洗(5 min×3),加辣根過氧化物酶標記的鏈霉卵白素30 μL/片,37 ℃孵育30 min,0.01M PBS洗(5 min×3),DAB顯色,鏡下觀察顯色后充分水洗,常規脫水、透明、中性樹膠封片,隨后置于倒置顯微鏡下觀察。
1.2.5 骨鈣素(BGP)的表達情況 干預成骨細胞48 h后,將收集的細胞在4 ℃條件下進行3 000 g離心5 min后用高壓槍頭吸取離心后的上清液,使用酶聯免疫吸附試驗(ELISA)進行檢測,利用抗原、抗體的特異性反應與酶對底物的高效催化作用相結合原理進行相關因子濃度的檢測,具體步驟如下:用0.05M pH9.6碳酸鹽包被緩沖液將抗體稀釋至蛋白質含量為1~10 μg/mL。在每個聚苯乙烯板的反應孔中加0.1 mL,4 ℃過夜。次日,棄去孔內溶液,用洗滌緩沖液洗3次,每次3 min。加一定稀釋的待檢樣品0.1 mL于上述已包被之反應孔中,置37 ℃孵育1 h。然后洗滌。同時做空白孔,陰性對照孔及陽性對照孔。隨后在各反應孔中加入新鮮稀釋的酶標抗體(經滴定后的稀釋度)0.1 mL。37 ℃孵育0.5~1 h,洗滌。再于各反應孔中加入臨時配制的TMB底物溶液0.1 mL,37 ℃10~30 min。于各反應孔中加入2M硫酸0.05 mL。試劑盒由廣州達安基因股份有限公司提供,顯色后采用492 nm波長,TMB反應產物檢測需要450 nm波長。檢測時一定要首先進行空白孔系統調零,用測定標本孔的吸收值與一組陰性標本測定孔平均值的比值(P/N)表示。以空白對照孔調零后測各孔OD值,若大于規定的陰性對照OD值的2.1倍,即為陽性。操作過程全部按照試劑盒說明書進行檢測。
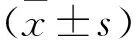
2 結果
2.1 成骨細胞的培養與鑒定 分離的成骨細胞在培養24 h后,活細胞貼壁生長,死細胞懸浮在培養液中。培養第5天,骨膜成骨細胞成放射狀貼壁生長,形態多為梭形和多邊形,核內可見兩三個核仁,輪廓清晰,飽滿透明,立體感強,培養10 d左右基本鋪滿整個瓶,見圖1。
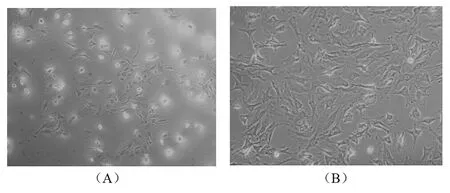
圖1 第二代成骨細胞的鏡下形態
注:A:第二代成骨細胞(100倍);B:第二代成骨細胞(200倍)
2.2 接骨丹含藥血清對成骨細胞增殖的影響 MTT法檢測發現:加入接骨丹含藥血清培養后對成骨細胞具有明顯的增殖作用,且呈現一定的時間依賴性,見圖2。
2.3 接骨丹含藥血清對成骨細胞中Ⅰ型膠原表達的影響 免疫組化染色顯示,正常對照組及實驗組中成骨細胞胞漿均呈棕黃色,其中可見黃褐色顆粒,細胞外也可見到棕黃色染色。與正常對照組比較,實驗組中成骨細胞不僅數量增多,而且經免疫組化染色后其陽性表達顏色變深,見圖3。
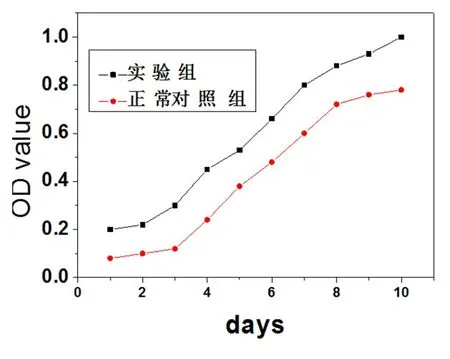
圖2 接骨丹對成骨細胞增殖的影響

圖3 Ⅰ型膠原免疫組化染色(200×)
注:(A)為實驗組;(B)為正常對照組
2.4 接骨丹含藥血清對成骨細胞中堿性磷酸酶表達的影響 免疫組化染色顯示,正常對照組及實驗組中成骨細胞中均有灰黑至深黑色的顆粒狀或片狀沉淀。與正常對照組比較,實驗組中成骨細胞不僅數量增多,而且經免疫組化染色后其陽性表達顏色變深,見圖4。
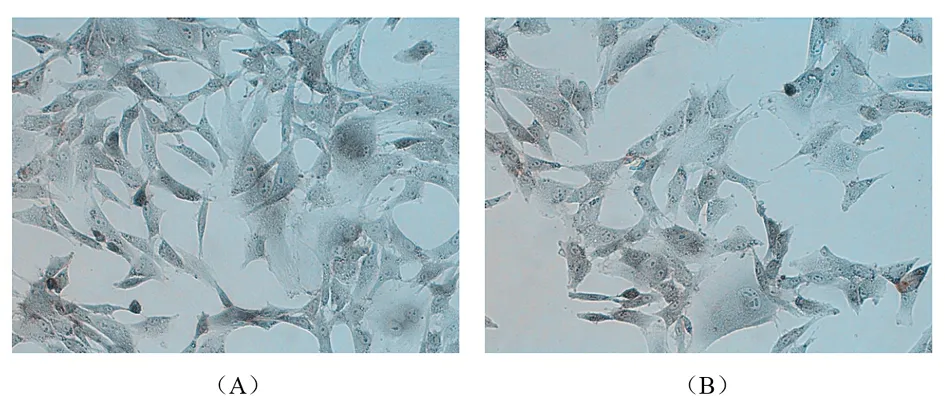
圖4 堿性磷酸酶疫組化染色(200×)
注:(A)為實驗組;(B)為正常對照組
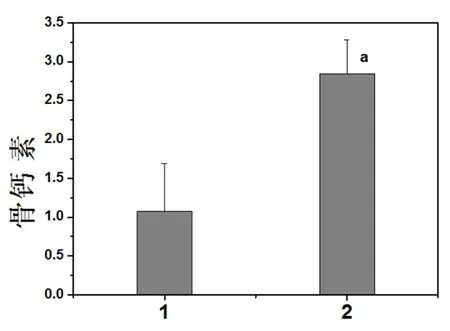
圖5 48 h時各組成骨細胞培養上清液中骨鈣素表達的比較
注:2為實驗組成骨細胞培養上清液中骨鈣素蛋白表達柱狀圖,與正常對照組比較aP<0.05。1:正常對照組;2:實驗組
2.5 接骨丹含藥血清對成骨細胞中BGP表達的影響 采用Elisa法檢測成骨細胞培養上清液中骨鈣素的表達,研究結果表明2組細胞上清液中均有骨鈣素的表達,與正常對照組相比,實驗組的骨鈣素的表達明顯增高(P<0.05),見圖5。
3 討論
自春秋戰國時期起已有中醫藥治療骨折的記載,中醫角度認為骨折的愈合經歷“瘀去、新生、骨合”三個環節,在整體觀和辨證論治的指導下中醫強調綜合運用整復、外固定、練功及內外用藥綜合運用,此四大療法隨著現代醫學進步而不斷更新,其中內外用藥已然成為各醫家研究的重點[2-3]。中醫理論認為肝主筋,腎主骨生髓,骨的生長愈合依賴精血的濡養,肝腎虧虛可導致骨生化無源,筋骨失養,而筋骨斷損容易傷及肝腎,補肝益腎是促進骨折愈合的重點。接骨丹主要成分補碎骨、續斷及杜仲均是補肝益腎之良藥,共奏接骨續筋之功;龜甲、熟地黃滋陰降火,補腎健骨;自然銅接骨續筋;土鱉蟲、乳香、沒藥活血祛瘀止痛合為臣藥;云茯苓、白術、陳皮健脾和胃為佐使藥。現代藥理檢測發現骨碎補具有促進蛋白多糖合成的效應,而蛋白多糖是促進鈣化的主要因子,起通過加速鈣磷沉積促進骨的生長發育[4];二氧化硫是自然銅的主要成分可加速骨痂形成及增強骨的抗撕力;有研究人員通過透射電鏡發現土鱉蟲提取物可以促進組織血管新生,促進骨周圍組織的血供,促進肉芽組織的生長[5]。接骨丹全方實現活血養血、接骨連筋通絡的功效。
近年來不少學者基于中醫理論體系,以現代科學檢測手段為媒介,從不同視角探討中醫藥促進骨折愈合的機理[6-11]。以往不少報道從病理切片、影像學、血液流變學等宏觀角度探討干預手段促進骨折愈合的機理,近些年,隨著分子生物學的日益發展,使從細胞水平探討接骨丹作用機理成為可能。我們以成骨細胞為研究對象,成骨細胞是一類具有多向分化能力的充質干細胞,它的分化是骨形成的關鍵環節,因此促進成骨細胞的成骨功能是治療骨折的基礎。我們采用MTT法檢測含有接骨丹血清對新西蘭兔成骨細胞增殖的影響發現加入接骨丹含藥血清培養后對成骨細胞具有明顯的增殖作用,且呈現一定的時間依賴性。再進一步檢測成骨細胞分化功能中我們檢測了堿性磷酸酶在不同組別的表達,堿性磷酸酶是一種公認的鑒定成骨細胞分化的重要表型之一,成骨細胞分泌堿性磷酸酶可促使無機磷酸鹽水解,從而減輕其對骨鹽形成抑制效應,有利于骨形成。隨著成骨細胞的不斷分化堿性磷酸酶表達不斷增加,堿性磷酸酶的活性越強預示著成骨細胞骨形成狀況越理想[12-15]。研究中我們證實雖然不同組別均有堿性磷酸酶表達,但是經過含有接骨丹血清培養后的細胞堿性磷酸酶表達更明顯,且Ⅰ型膠原表達越高,說明接骨丹可以通過促進堿性磷酸酶的合成、Ⅰ型膠原表達的增加而發揮誘導成骨細胞增殖分化。BGP是一種由成骨細胞合成和分泌的非膠原蛋白,其在調控軟骨礦化發揮重要作用,研究中我們還發現含接骨丹血清可上調成骨細胞BGP的濃度,說明接骨丹提高了成骨細胞的礦化能力,促使膠原鈣化,從而達到增加骨量的目的。
總之,接骨丹能夠促進骨折的愈合,其機制可能與促進成骨細胞中堿性磷酸酶、Ⅰ型膠原及骨鈣素的表達進而促進成骨細胞增殖和分化有關。
[1]李稻.醫學功能學科實驗原理與方法[M].北京:人民衛生出版社,2008,3:34.
[2]周正新,劉安平,王峰,等.接骨續筋膠囊促進骨折愈合作用的實驗研究[J].中醫藥臨床雜志,2008,20(2):124-126.
[3]周成剛.正骨丹促進骨折愈合療效觀察[J].中國中醫骨傷科雜志,2003,11(1):19-21.
[4]宋淵.李盛華.何志軍.骨碎補含藥血清對成骨細胞增殖、成骨的影響[J].中國骨質疏松雜志,2014,3(2):45-47.
[5]許小志,徐志強,方耀忠,等.骨九方促進骨折愈合臨床研究[J].新中醫,2010,42(11):52-54.
[6]徐建平,郭文榮.骨折愈合影響因素及中醫藥治療的研究進展[J].生物骨科材料與臨床研究,2010,7(6):35-37.
[7]王力,鄭甦,楊鳳云,等.壯筋續骨湯對大鼠成骨細胞ALP比活性、BGP含量和Cbfl基因表達影響[J].中國中醫骨傷科雜志,2008,16(12):24-26.
[8]王力,鄭甦,楊鳳云,等.壯筋續骨湯促進大鼠脛骨骨折愈合:RT-PCR法檢測核心結合子a1基因表達的驗證[J].中國組織工程研究與臨床康復,2010,14(20):3678-3681.
[9]鄒培.長骨液促進骨延長區骨礦化研究[J].中國骨傷,1998,11(5):15.
[10]陳伯儀.無名異沖劑促進去卵巢大鼠骨質疏松性骨折的機制研究[J].福建中醫學院學報,2004,14(5):50-52.
[11]李紅專.生骨再造散對家兔骨折愈合影響的實驗研究[J].中國骨傷,2005,18(5):272-274.
[12]賴建章.補陽還五湯對兔骨折成份和生物力學性能的影響[J].中國中醫骨傷科雜志,2001,9(4):32-33.
[13]張俐,楊宗宇.活血化瘀湯對大鼠骨折愈合過程中血清骨鈣素和Ⅰ型膠原表達的影響[J].中國骨傷,2007,20(8):527-528.
[14]熊輝.桃紅四物湯千預骨癡血管新生及VEGF表達的實驗研究[J].中國醫師雜志,2014,6(2):195-197.
[15]Yu,P.B.,Beppu,H.,Kawai,N.,Li,E.,and Bloch,K.D.(2005)Bone morphogenetic protein(BMP)type II receptor deletion reveals BMP ligand-specific gain of signaling in pulmonary artery smooth muscle cells[J].J.Biol.Chem,280,24443-24450.
(2015-05-12收稿 責任編輯:徐穎)
The Observation of Bone-Joining Elixir Mediated Osteoblast Proliferation to Promote Fracture Healing
Zhai Xianbin, Wu Fangyun
(DepartmentofOrthopedics,TaianChineseMedicineHospital,Tai'an271000,China)
Objective: To observe the effect of Bone-Joining Elixir on New Zealand newborn rabbit osteoblast proliferation, and explore the promoting fracture healing mechanism of Bone-Joining Elixir. Methods: Conventional grade New Zealand big and white newborn rabbits were put to death by ear venous air embolism, the craniums were taken down in aseptic conditions, and the osteoblasts were gained by collagenase type Ⅰ digestion method for in vitro culture, identification and passages. After identification, the second generation of osteoblasts was randomly divided into normal control group and experimental group. And the normal control group was cultured in normal rabbit serum, the experimental group was cultured in Bone-Joining Elixir medicated serum, MTT method was taken to observe the cell growth curves of the two groups. After the intervention for 48 h, the two serums were observed to achieve the influence of Bone-Joining Elixir on the expression of osteoblast alkaline phosphatase and collagen typeⅠ under the inverted microscope, and to achieve the influence of Bone-Joining Elixir on the expression of osteocalcin in the supernate in the osteoblast culture by Elisa method.Results: The osteoblast culture system in vitro has been successfully obtained and established by the collagenase type Ⅰ digestion method, MTT observation indicated the experimental group show significant promotion on the proliferation of osteoblasts, and the inverted microscope indicated the expression of alkaline phosphatase and collagen type Ⅰ in the experimental group was superior to the normal control group, and the osteoblast was promoted to secrete osteocalcin. Conclusion: The Bone-Joining Elixir can promote the healing of fracture, the mechanism may be related to the promotion of the expression of alkaline phosphatase, collagen type Ⅰ and osteocalcin in osteoblasts to help osteoblasts proliferate and differentiate.
Bone-Joining Elixir; Medicated Serum; Osteoblast; Fracture Healing
山東省中醫藥科技發展計劃項目(編號:2011-284)
翟獻斌(1970.2—),男,漢族,山東泰安人,副主任醫師,本科學歷,研究方向:中西醫結合治療脊柱病,E-mail:13853880212@163.com
R242
A
10.3969/j.issn.1673-7202.2015.10.033

