華支睪吸蟲硫氧還蛋白跨膜蛋白基因的生物信息學(xué)分析
周晨慧,徐道華,汪肖云,陳文君,李 珊
(廣東醫(yī)學(xué)院護(hù)理學(xué)院,廣東東莞523808)
華支睪吸蟲硫氧還蛋白跨膜蛋白基因的生物信息學(xué)分析
周晨慧,徐道華,汪肖云,陳文君,李 珊
(廣東醫(yī)學(xué)院護(hù)理學(xué)院,廣東東莞523808)
目的對華支睪吸蟲硫氧還蛋白跨膜蛋白(Cs TMX)基因進(jìn)行生物信息學(xué)分析。方法利用生物信息學(xué)方法(InterProScan、SignalP、TMHMM和SWISS-MODEL等相關(guān)軟件)對Cs TMX基因及相應(yīng)氨基酸序列的同源性、理化性質(zhì)、保守結(jié)構(gòu)域、信號肽、親水性/疏水性、三級結(jié)構(gòu)進(jìn)行預(yù)測分析。結(jié)果Cs TMX基因的開放閱讀框(ORF)包含414 bp,編碼137個氨基酸,理論分子質(zhì)量為16.04×103,等電點為5.16。TMHMM和SignalP3.0分析結(jié)果顯示Cs TMX含信號肽,其在第19~20位氨基酸之間有1個切割位點;InterProScan和SWISS-MODEL分析結(jié)果顯示,TMX特征性結(jié)構(gòu)域位于第21~ 27位氨基酸之間,并且具有高度保守的CPAC基因序列。結(jié)論利用生物信息學(xué)知識和各種分析軟件對Cs TMX所編碼的cDNA序列及理論蛋白質(zhì)的理化性質(zhì)、結(jié)構(gòu)和功能域等進(jìn)行預(yù)測和分析,能夠為開展Cs TMX的表達(dá)及其功能研究提供理論依據(jù)。
華支睪吸蟲病; 硫氧還蛋白質(zhì)類; 膜蛋白質(zhì)類; 基因; 計算生物學(xué)
華支睪吸蟲病是由華支睪吸蟲感染引起的一種食源性人獸共患寄生蟲病,是當(dāng)前我國最嚴(yán)重的食源性寄生蟲病之一。華支睪吸蟲囊蚴在十二指腸脫囊移入人或動物肝膽管中寄生,蟲體攝食和遷移產(chǎn)生的機械損傷及其分泌代謝產(chǎn)物引起的化學(xué)損傷,均可引起宿主一系列肝膽管組織的病理改變。患者在急性期可表現(xiàn)為膽囊炎、膽管炎、黃疸型肝炎等,慢性感染易導(dǎo)致膽結(jié)石、肝纖維化,晚期可發(fā)生肝硬化,甚至原發(fā)性膽管癌和肝癌[1-3]。在全球范圍內(nèi)有近3 500萬人感染華支睪吸蟲,給人們的健康帶來巨大威脅[4-5]。因此,有必要通過對華支睪吸蟲基因組和功能基因組的研究,尋找合適的疫苗候選分子并深入研究其保護(hù)機制。
硫氧還蛋白跨膜蛋白(TMX)屬于硫氧還蛋白超家族的成員之一,具有還原酶的特性,且廣泛分布于多細(xì)胞生物。有研究報道,TMX可阻斷主要組織相容性復(fù)合體Ⅰ類重鏈,從而在炎癥或感染等病理狀態(tài)下發(fā)揮免疫保護(hù)作用[6-8]。本研究主要運用生物信息學(xué)方法對華支睪吸蟲TMX(Cs TMX)基因及相應(yīng)氨基酸序列的同源性、理化性質(zhì)、保守結(jié)構(gòu)域、信號肽、跨膜結(jié)構(gòu)域、親水性/疏水性、三級結(jié)構(gòu)及活性位點進(jìn)行預(yù)測分析,為研究Cs TMX的功能提供理論參考。
1 材料與方法
1.1 材料 從華支睪吸蟲全基因組數(shù)據(jù)庫中搜索CsTMX基因同源序列。
1.2 方法
1.2.1 Cs TMX基因的識別 將目的基因序列在美國國立生物技術(shù)信息中心(NCBI)網(wǎng)站(http://www.ncbi.nlm. nih.gov/BLAST/)和基因數(shù)據(jù)庫(GenBank)中的同源序列進(jìn)行比對,判斷該基因是否是全長基因。從中選取編碼Cs TMX(GAA50073.1)的全長基因,應(yīng)用NCBI網(wǎng)站open reading frame(ORF)finder確定其完整的編碼序列(coding sequence,CDS)。
1.2.2 生物信息學(xué)分析
1.2.2.1 通過ExPASy(http://ca.expasy.org/)所提供的Prot Param、SignalP、InterProScan、TMHMM及SWISS-MODEL等在線工具預(yù)測蛋白質(zhì)的理化性質(zhì)、分泌信號肽、理論蛋白質(zhì)一級結(jié)構(gòu)中包含的結(jié)構(gòu)和功能域特征序列、氨基酸序列跨膜區(qū)、理論蛋白功能位點,預(yù)測并模擬蛋白質(zhì)的空間構(gòu)象。
1.2.2.2 B細(xì)胞表位分析 利用B細(xì)胞表位在線分析軟件(http://tools.immuneepitope.org/tools)預(yù)測蛋白質(zhì)的B細(xì)胞表位。
2 結(jié) 果
2.1 CsTMX基因BlASTx的分析結(jié)果 BLASTx結(jié)果分析顯示,該基因cDNA全長456 bp,編碼區(qū)在1~414 bp,起始密碼子為ATG,終止密碼子為TAA,編碼137個氨基酸。Cs TMX屬于硫氧還蛋白超家族同源基因,與GenBank中的曼氏血吸蟲蛋白質(zhì)二硫鍵異構(gòu)酶(PDI)的氨基酸序列的相似性為92%,一致性達(dá)51%,見圖1。

圖1 用NCBI的BLASTx程序進(jìn)行Cs TMX同源性分析結(jié)果
2.2 蛋白質(zhì)的理化性質(zhì) 通過ProtParam程序(http:// web.expasy.org/protparam/)對Cs TMX進(jìn)行理化性質(zhì)預(yù)測,Cs TMX編碼序列一級結(jié)構(gòu)分析顯示,該序列編碼137個氨基酸,理論相對分子質(zhì)量為16.04×103,等電點為5.16,偏酸性。該蛋白序列的N末端為甲硫氨酸,其在哺乳動物網(wǎng)狀紅細(xì)胞體外表達(dá)的半衰期為30 h,在酵母體內(nèi)表達(dá)的半衰期大于20 h,在大腸桿菌中表達(dá)的半衰期大于10 h。在溶液中的不穩(wěn)定指數(shù)為55.56,高于域值40。疏水指數(shù)為82.47,總親水性0.135,蛋白質(zhì)總體疏水性較低。
2.3 信號肽序列分析 SignalP3.0分析結(jié)果顯示Cs TMX可能含信號肽,其切割位點在第19~20位氨基酸之間,見圖2。
2.4 InterProScan 掃描一級結(jié)構(gòu)中包含的結(jié)構(gòu)和功能域特征序列,分析結(jié)果顯示,Cs TMX屬于硫氧還蛋白超家族,硫氧還蛋白特征性結(jié)構(gòu)域位于第21~27位氨基酸之間,見圖3。
2.5 TMHMM預(yù)測Cs TMX氨基酸序列的跨膜區(qū) 結(jié)果顯示,ans體疏水性較低,TMHMM預(yù)測氨基酸序列的跨膜區(qū),Cs TMX有1個跨膜結(jié)構(gòu),位于第1~20位氨基酸之間,見圖4。

圖2 Cs TMX信號肽SignalP3.0分析結(jié)果
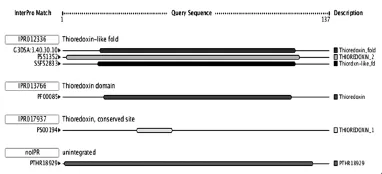
圖3 InterProScan分析Cs TMX一級結(jié)構(gòu)中的功能域

圖4 TMHMM預(yù)測C s TMX氨基酸序列的跨膜區(qū)
2.6 B細(xì)胞線性表位分析 利用http://tools.immuneepitope.org/tools的BepiPred分析工具預(yù)測Cs TMX的B細(xì)胞線性表位,分值較高的線性表位區(qū)域位于第27~32位氨基酸、第58~65位氨基酸、第74~77位氨基酸、第121~124位氨基酸之間(圖5),相應(yīng)表位的氨基酸序列見表1。

圖5 C s TMXB細(xì)胞線性表位預(yù)測
2.7 SWISS-MODEL分析Cs TMX的三維結(jié)構(gòu) SWISSMODEL將Cs TMX與蛋白結(jié)構(gòu)數(shù)據(jù)庫中的蛋白質(zhì)三維結(jié)構(gòu)進(jìn)行匹配,得到模擬的華支睪吸蟲Cs TMX三維結(jié)構(gòu)圖,左上角圓圈部分為其高度保守CPAC基因序列,見圖6。

表1 C s TMX組成B細(xì)胞表位氨基酸序列

圖6 SWI SS-MODEL分析華支睪吸蟲Cs TMX的三維結(jié)構(gòu)
3 討 論
隨著分子寄生蟲學(xué)的不斷發(fā)展,從分子水平認(rèn)識寄生蟲及其致病機制已成為寄生蟲研究領(lǐng)域的熱點之一。作者旨在研究Cs TMX及其編碼蛋白質(zhì)的結(jié)構(gòu)與功能,為解決華支睪吸蟲病的防治問題提供基礎(chǔ)理論性研究。
生物信息學(xué)是涵蓋生命科學(xué)、計算機科學(xué)及數(shù)學(xué)等學(xué)科,包含生物信息的獲取、處理、儲存、分發(fā)、分析和解釋的一門學(xué)科,目的在于了解大量的生物學(xué)意義[9]。本研究通過利用美國NCBI和歐洲ExPASy網(wǎng)站所提供的大量在線分析程序[10-11],對華支睪吸蟲成蟲cDNA文庫硫氧還蛋白超家族同源序列與NCBI網(wǎng)站進(jìn)行多序列比對,從中選取編碼Cs TMX全長cDNA序列并對其編碼的氨基酸序列進(jìn)行全面的生物信息學(xué)分析,包括其理化性質(zhì)、功能域、跨膜結(jié)構(gòu)、信號肽和三級結(jié)構(gòu)等,為Cs TMX基因的后續(xù)研究提供線索和依據(jù)。
將Cs TMX與NCBI網(wǎng)站中的同源序列進(jìn)行多序列比對,發(fā)現(xiàn)Cs TMX編碼序列理論蛋白相對分子質(zhì)量為16.04×103,等電點為5.16,偏酸性,重組蛋白在溶液中性質(zhì)較不穩(wěn)定。TMHMM預(yù)測Cs TMX氨基酸序列的跨膜結(jié)構(gòu)提示,Cs TMX含有1個跨膜區(qū),跨膜結(jié)構(gòu)位于第1~ 20位氨基酸之間。SignalP3.0分析結(jié)果顯示,Cs TMX含信號肽,其在第19~20位氨基酸之間有1個切割位點。TMHMM和SignalP3.0分析結(jié)果提示,在對Cs TMX進(jìn)行原核系統(tǒng)表達(dá)時,應(yīng)將Cs TMX氨基酸序列中編碼信號肽的部分取出,以有利于r Cs TMX在原核系統(tǒng)中的表達(dá)。目前已有研究證實,與Cs TMX同屬于硫氧還蛋白家族的PDI是日本血吸蟲、曼氏血吸蟲、肝片吸蟲和牛血吸蟲等的分泌排泄抗原[12]。Blastx結(jié)果顯示Cs TMX與曼氏血吸蟲PDI高度同源,那么Cs TMX是否可以分泌到細(xì)胞外成為華支睪吸蟲的分泌排泄抗原(Cs ESAs)組成之一,還有待于進(jìn)一步研究。Cs TMX的B細(xì)胞線性表位預(yù)測發(fā)現(xiàn)有4個分值較高的線性表位區(qū)域。
總之,利用生物信息學(xué)知識和各種分析軟件對Cs TMX所編碼的cDNA序列及理論蛋白質(zhì)的理化性質(zhì)、結(jié)構(gòu)和功能域等進(jìn)行預(yù)測和分析,有利于了解Cs TMX潛在的生物學(xué)功能,并為選擇和設(shè)計實驗方案提供一定的理論依據(jù)和策略。
[1]Yang GJ,Liu L,Zhu HR,etal.China′s sustained drive to eliminate neglected tropicaldiseases[J].Lancet InfectDis,2014,14(9):881-892.
[2]Fried B,Reddy A,Mayer D.Helminths in human carcinogenesis[J].Cancer Lett,2011 305(2):239-249.
[3]Chen T,Ning D,Sun H,etal.Sequence analysis andmolecular characterization of Clonorchis sinensis hexokinase,an unusual trimeric 50-kDa glucose-6-phosphate-sensitive allosteric enzyme[J].PLoS One,2014,9(9):e107940.
[4]Xu LL,Jiang B,Duan JH,etal.Efficacy and safety of praziquantel,tribendimidine andmebendazole in patientswith co-infection of Clonorchis sinensisand other helminths[J].PLoSNegl Trop Dis,2014,8(8):e3046.
[5]Qian MB,Chen YD,F(xiàn)ang YY,etal.EpidemiologicalprofileofClonorchis sinensis infection in one community,Guangdong,People′s Republic of China[J].ParasitVectors,2013,6:194.
[6]Matsuo Y,Irie K,KiyonariH,etal.The protective role of the transmembrane thioredoxin-related protein TMX in inflammatory liver injury[J]. Antioxid Redox Signal,2013,18(11):1263-1272.
[7]PasettoM,Barison E,CastagnaM,etal.Reductiveactivation of type2 ribosome-inactivating proteins is by promoted transmembrane thioredoxinrelated protein[J].JBiolChem,2012,287(10):7367-7373..
[8]IshiiT,F(xiàn)unato Y,MikiH.Thioredoxin-related protein 32(TRP32)specifically reducesoxidized phosphatase of regenerating liver(PRL)[J].JBiol Chem,2013,288(10):7263-7270.
[9]尹一兵.分子診斷學(xué)[M].北京:高等教育出版社,2007:182.
[10]Bao Y,F(xiàn)ederhen S,Leipe D,et al.National center for biotechnology information viralgenomesproject[J].JVirol,2004,78(14):7291-7298.
[11]WilkinsMR,Gasteiger E,Bairoch A,etal.PProtein identification and analysis tools in the ExPASy server[J].MethodsMol Biol,1999,112:531-552.
[12]Hu Y,Huang L,Huang Y,et al.Molecular cloning,expression,and immunolocalization of protein disulfide isomerase in excretory-secretoryproducts from Clonorchissinensis[J].Parasitol Res,2012,111(3):983-989.
Bioinformaticsanalysisof thioredoxin transmembrane-related protein from clonorchis sinensis
Zhou Chenhui,Xu Daohua,Wang Xiaoyun,ChenWenjun,LiShan(SchoolofNursing,GuangdongMedicalCollege,Dongguan,Guangdong523808,China)
ObjectiveTo analyze protein characteristicsof thioredoxin-related transmembrane protein gene of clonorchis sinensis(Cs TMX)by bioinformation.MethodsThe homology,physicochemicalproperty,conserved domain,signal peptide,hydrophilcity,hydrophobicity and the tertiary structure of Cs TMX and amino acid sequencewere predicted by bioinformatic analysis software such as InterProScan,SignalP,TMHMM and SWISS-MODEL.ResultsThe open reading frame of Cs TMX cDNA included 414 bp,coded 137 amino acidswith theoreticalmolecularweightbeing16.04×103and isoelectric pointbeing 5.16.TMHMM and SignalP3.0 analysis showed that Cs TMX contained signal peptide,having a cleavage site between 19th and 20th aminoacids.InterproScan and SWISS-MODEL analysis indicated the characterized TMX domainwas found in the position of21st-27th amino acidsbeing possesswith highly conserved CPAC gene sequence.ConclusionThe bioinformatics analysis and various softwaremay predictand analyze cDNA sequences coded by Cs TMX and physicochemicalproperty,structure and function domain of theoreticalprotein,which isavailable forproviding theoreticalbasisofexpression of Cs TMX.
Clonorchiasis; Thioredoxin; Membrane protein; Gene; Computationalbiology
10.3969/j.issn.1009-5519.2015.07.005
:A
:1009-5519(2015)07-0969-03
2014-10-13
2014-12-08)
廣東醫(yī)學(xué)院科研基金面上項目(M2011022)。
周晨慧(1974-),女,山西太原人,博士研究生,講師,主要從事病原生物學(xué)研究;E-mail:chenhuizh6@126.com。

