枯草芽孢桿菌對綿羊瘤胃上皮細胞β-防御素-1表達的影響
王 佩,范燕茹,金 鑫,楊銀鳳*
(1.內蒙古農業大學 獸醫學院,呼和浩特 010018; 2.農業部動物疾病臨床診療技術重點實驗室,呼和浩特 010018)
枯草芽孢桿菌對綿羊瘤胃上皮細胞β-防御素-1表達的影響
王 佩1,2,范燕茹1,2,金 鑫1,2,楊銀鳳1,2*
(1.內蒙古農業大學 獸醫學院,呼和浩特 010018; 2.農業部動物疾病臨床診療技術重點實驗室,呼和浩特 010018)
選用益生枯草芽孢桿菌研究其對體外培養的綿羊瘤胃上皮細胞β-防御素表達的調節作用。首先,在體外成功培養綿羊瘤胃上皮細胞,然后用枯草芽孢桿菌對體外培養的綿羊瘤胃上皮細胞進行不同濃度、不同時間的刺激,利用熒光定量PCR技術(Real-time fluorescence quantitative PCR,RT-PCR)從mRNA水平檢測刺激后上皮細胞中綿羊β-防御素-1(Sheep beta-defensin-1,SBD-1)基因表達水平的差異。結果表明:當菌液濃度為1010cfu·mL-1刺激上皮細胞8 h后,SBD-1的表達量達到最高;不同的菌液濃度誘導下SBD-1的表達量均有顯著增加,109、1010、1011cfu·mL-1菌液濃度刺激下,SBD-1的表達量與空白相比差異極顯著(P<0.01)。結果表明,枯草芽孢桿菌能夠誘導綿羊瘤胃上皮細胞內SBD-1基因的表達。
β-防御素-1;瘤胃上皮細胞;枯草芽孢桿菌;熒光定量PCR
抗菌肽(Antimicrobial peptides,AMPs)是一種小分子多肽,是存在于各種生物如哺乳動物、節肢動物、植物中的一種天然抗生素,具有對革蘭陽性菌、革蘭陰性菌、真菌和病毒的廣譜抗微生物活性[1],是許多生物的先天性免疫防御機制的一部分。防御素是一類富含半胱氨酸的陽離子內源性抗菌肽,是抗菌肽中的一個大家族。哺乳動物中,防御素主要分為3大類:α-防御素、β-防御素、θ-防御素[2]。β-防御素在牛、羊、豬和人類等許多物種中被發現,主要是由各器官的上皮細胞產生[3]。在綿羊體內發現有兩種β-防御素存在,即綿羊β-防御素-1(SBD-1)和綿羊β-防御素-2(SBD-2)。綿羊β-防御素的表達大多在上皮細胞中,且主要在消化道和呼吸道中表達,在消化道中,SBD-2只表達于舌和遠端回腸,而SBD-1表達較廣,在整個消化道(從舌到結腸)都有,并且在瘤胃中表達量最多[4-6]。
益生菌是一類對宿主有益的活性微生物。在反芻動物中,益生菌可促進生長、提高飼料利用效率[7],而且,益生菌還能夠改善胃腸道功能,參與機體免疫調節,然而,益生菌的作用機理還尚未明確。最近的研究表明,益生菌能夠通過誘導抗菌肽比如防御素等來穩定胃腸道屏障功能。2007年,M.Schlee等[8]發現,益生大腸桿菌Nissle 1917可誘導人β-防御素-2表達量的增加;2008年,M.Schlee等[9]研究表明,乳酸菌菌株也能夠誘導人β-防御素-2的表達。截至目前,研究者多使用的是腸上皮細胞及乳桿菌,而關于胃上皮細胞、枯草芽孢桿菌與β-防御素相互關系尚未見報道。大量研究表明,枯草芽孢桿菌對動物的生長繁殖和正常生理狀態的維持都有重要意義,T.Marubashi等[10]發現,枯草芽孢桿菌能有效地改善鯪魚的生長和免疫力,J.H.Lee等[11]發現,枯草芽孢桿菌可通過抑制人乳腺癌細胞內細菌的生長而抑制癌細胞生長,芽孢桿菌作為益生菌開發應用的潛力很大,并且,我國芽孢桿菌資源豐富[12]。因此,本研究采用RT-PCR技術檢測益生菌枯草芽孢桿菌對綿羊瘤胃上皮細胞中SBD-1表達的影響,為在分子水平上揭示益生菌對防御素的調控機理提供一定的基礎及依據。
1 材料與方法
1.1 材料
1.1.1 主要試劑和儀器 細胞培養基:DMEM/F12培養基(Hyclone)。細菌培養基:LB培養基,1 L蒸餾水中加入10.0 g 胰蛋白胨、5.0 g 酵母提取粉、5.0 g NaCl、15.0 g 瓊脂,121 ℃ 滅菌15 min。細胞角蛋白一抗(Sigma)、飛捷FAST200 RNA提取試劑盒(飛捷公司)、TaKaRa反轉錄試劑盒(DRR037A)、TaKaRa熒光定量PCR酶(RR820A)、CO2培養箱(Thermo)、顯微成像系統(CKX41,Olympus)、凈化工作臺(杭州蘇凈)、多功能酶標儀(SynergyTMH4,Biotek)、普通PCR儀、實時熒光定量PCR儀(VIIA7,ABI)等。
1.1.2 綿羊瘤胃上皮細胞的獲取 試驗材料來自于呼和浩特市北亞屠宰場的綿羊。
1.1.3 供試菌株 枯草芽孢桿菌CMCC63501購于中國微生物菌種網。
1.2 試驗方法
1.2.1 綿羊瘤胃上皮細胞的培養及鑒定 將取來的瘤胃組織用滅菌生理鹽水沖洗去除瘤胃內容物后,鈍性分離組織的黏膜上皮層和固有層,然后將其放入PBS溶液中帶入細胞間,所用PBS溶液中含 1 mg·mL-1青霉素、 500 μg·mL-1鏈霉素、100 μg·mL-1慶大霉素、50 μg·mL-1兩性霉素。帶入細胞間后,再用上述PBS溶液反復清洗3次,之后,用0.25% Trypsin-0.02% EDTA消化液于37 ℃ 消化,于顯微鏡下觀察,至消化液中出現上皮細胞為止,收集,于37 ℃、5% CO2培養箱中靜置培養,所用培養基為含20% 胎牛血清、 200 μg·mL-1青霉素、 100 μg·mL-1鏈霉素、50 μg·mL-1慶大霉素、25 μg·mL-1兩性霉素 、2 μg·mL-1胰島素-轉鐵蛋白-硒添加劑、β-巰基乙醇的F12液體培養基。
當原代細胞數量達到細胞培養瓶的80%~90%后,便可將細胞傳于12孔板,進行傳代培養。傳代細胞生長至80%~90%后,對細胞進行形態學觀察及免疫細胞化學鑒定[13],鑒定為上皮細胞后,則可用于刺激試驗。
1.2.2 枯草芽孢桿菌的培養 將枯草芽孢桿菌接種于LB培養基中,37 ℃、200 r·min-1氧培養24 h。按照倍比稀釋法用無抗生素DMEM/F12培養基將枯草芽孢桿菌菌液的濃度調為:1012、1011、1010、109、108cfu·mL-1,即可用于細胞刺激試驗。
1.2.3 瘤胃上皮細胞和枯草芽孢桿菌的共培養 將傳代細胞用PBS洗滌3次,每孔加入1 mL 無血清無抗生素DMEM培養基進行孵育。孵育24 h后,向細胞板中每孔加入900 μL 的無血清無抗生素的DMEM培養基,并分別加入100 μL濃度為1010、109、108、107、106cfu·mL-1的枯草芽孢桿菌菌液和DMEM/F12作為空白對照,置37 ℃ 培養2 h。刺激2 h后,用含雙抗的PBS沖洗3次,加入含雙抗無血清的DMEM培養基,分別培養2、4、8、12和24 h。
1.2.4 瘤胃上皮細胞總RNA的提取 用含雙抗的PBS將共培養后的瘤胃上皮細胞沖洗3次后,按照FAST200RNA提取試劑盒說明書進行RNA的提取:①加入RA2液500 μL,充分顛倒混勻5~10次,靜置1 min。②將樣本裂解物全部吸入或倒入內套管,離心1 min。 ③取出內套管,吸取外套管中液體后放回內套管,加入500 μL洗液,離心1 min,重復一次。④取出內套管,吸取外套管中液體后放回內套管,不加洗液,離心1 min。⑤將內套管移入新的1.5 mL Eppendorf管,在膜中央加入洗脫液25~50 μL。⑥室溫靜置1 min后,離心1 min,獲得總RNA。所提RNA用1.5%瓊脂糖凝膠電泳來檢測RNA質量,同時,用酶標儀測A260 nm和A280 nm及其比值,以檢測RNA濃度和純度。
1.2.5 總RNA的反轉錄 以提取的瘤胃上皮細胞總RNA為模板,用TaKaRa反轉錄試劑盒(DRR037A)進行反轉錄反應,所用反應體系為10 μL:5×Prime Script Buffer 2 μL,Prime Script RT Enzyme Mix 0.5 μL,OLigo dT Primer(50 μmol·mL-1) 0.5 μL,Random 6 mers(100 μmol·mL-1) 0.5 μL,樣品RNA 6.5 μL。反應條件為37 ℃ 15 min,85 ℃ 5 s。RT產物cDNA于-20 ℃保存備用。
1.2.6 RT-PCR 根據GenBank中提供的SBD-1基因(U75250)和內參因β-actin(U39357)序列,用DNAStar軟件設計特異性引物,并由上海生工生物公司合成。SBD-1基因引物:上游P1:5′-GGCTCCATCACCTGCTCCTC-3′,下游P2:5′-CGTCTTCGCCTTCTGTTACTTCTT-3′,β-actin基因引物:上游P3:5′-GTCACCAACTGGGA-CGACA-3′,下游P4:5′-AGGCGTACAGGGACAGCA-3′,以cDNA為模板,進行RT-PCR反應。
反應體系為20 μL:SYBR Premin Ex Taq(2×) 10 μL,Up primer(10 μmol·mL-1) 0.8 μL,Down primer(10 μmol·mL-1) 0.8 μL,cDNA模板2 μL,dH2O 6.4 μL。擴增程序:95 ℃ 預變性30 s;95 ℃ 變性5 s,63 ℃ 退火34 s,50個循環;熔解程序:95 ℃ 5 s;60 ℃ 30 s;95 ℃ 15 s,每個樣品的目的基因及內參基因分別設置3個重復。反應結束后,根據擴增曲線的Ct值計算定量結果,并對數據進行統計學分析,然后通過應用統計學分析軟件SPSS 17.0的統計程序和單因子方差分析中的最小顯著法(Least significant difference)對每組試驗數據進行綜合統計分析。
將cDNA以10倍濃度進行梯度倍比稀釋,將5個濃度的樣品分別進行SBD-1和β-actin實時熒光定量PCR擴增,則可得到不同濃度下SBD-1和β-actin基因表達的標準曲線。
1.3 數據處理
SBD-1基因的相對表達量采用ΔΔCt法計算:ΔCt(目的基因)=Ct(目的基因)-Ct(內參基因);ΔΔCt=Ct(枯草芽孢桿菌刺激組)-Ct(對照組)。目的基因的相對表達量=2-ΔΔCt,當擴增效率接近等于1時,可簡化為2-ΔCt公式進行目的基因相對表達量的計算。
2 結 果
2.1 綿羊瘤胃上皮細胞培養
2.1.1 綿羊瘤胃上皮細胞原代培養 用0.25% 胰蛋白酶對綿羊瘤胃上皮組織連續消化后,在顯微鏡下觀察,可看到大小均一、單個存在的折光度較高的細胞,且數量較多(圖1A),即可收集培養。培養4 d后,貼壁細胞有的單個存在,有的呈島嶼狀分布,形態多呈中間厚四周薄的圓形或橢圓形(圖1B)。培養6 d后,小島嶼狀的細胞團生長成大片細胞(圖1C)。8 d后,片狀細胞相互連接在一起,細胞數量達80%~90%,幾乎將整個細胞瓶鋪滿,細胞成鵝卵石鋪路狀,形狀多為圓形或多角形,界限較為清晰,有個別細胞因生長密度大導致形態有所變化(圖1D),可以進行傳代培養。
2.1.2 綿羊瘤胃上皮細胞傳代培養 傳代后的細胞,培養2 d后,細胞呈鋪路石狀的單個細胞(圖2A),與原代細胞相比,形態更加清晰,上皮樣細胞鵝卵石鋪路狀更為明顯,且相鄰距離較近。4 d后,細胞量可達到80%~90%,鏡下觀察基本沒有空余的位置,細胞界限明顯(圖2B),可以進行后續試驗。
2.1.3 綿羊瘤胃上皮細胞的鑒定 傳代培養后的細胞,細胞呈鋪路石狀,是典型的的上皮細胞形態(圖3A)。經免疫細胞化學染色法鑒定,細胞胞漿呈黃褐色,即角蛋白陽性反應,細胞核經H.E染色呈現藍色(圖3B)。經鑒定所培養細胞為上皮細胞,可用于后續試驗。

A.消化后的綿羊瘤胃上皮細胞;B.培養4 d后的綿羊瘤胃上皮細胞;C.培養6 d后的綿羊瘤胃上皮細胞;D.培養8 d后的綿羊瘤胃上皮細胞A.The ruminal epithelial cells in sheep after digestion; B.The ruminal epithelial cells in sheep after 4 days primary culture; C.The ruminal epithelial cells in sheep after 6 days primary culture; D.The ruminal epithelial cells in sheep after 8 days primary culture圖1 綿羊瘤胃上皮細胞的原代培養結果 100×Fig.1 The primary culture of ruminal epithelial cells in sheep 100×
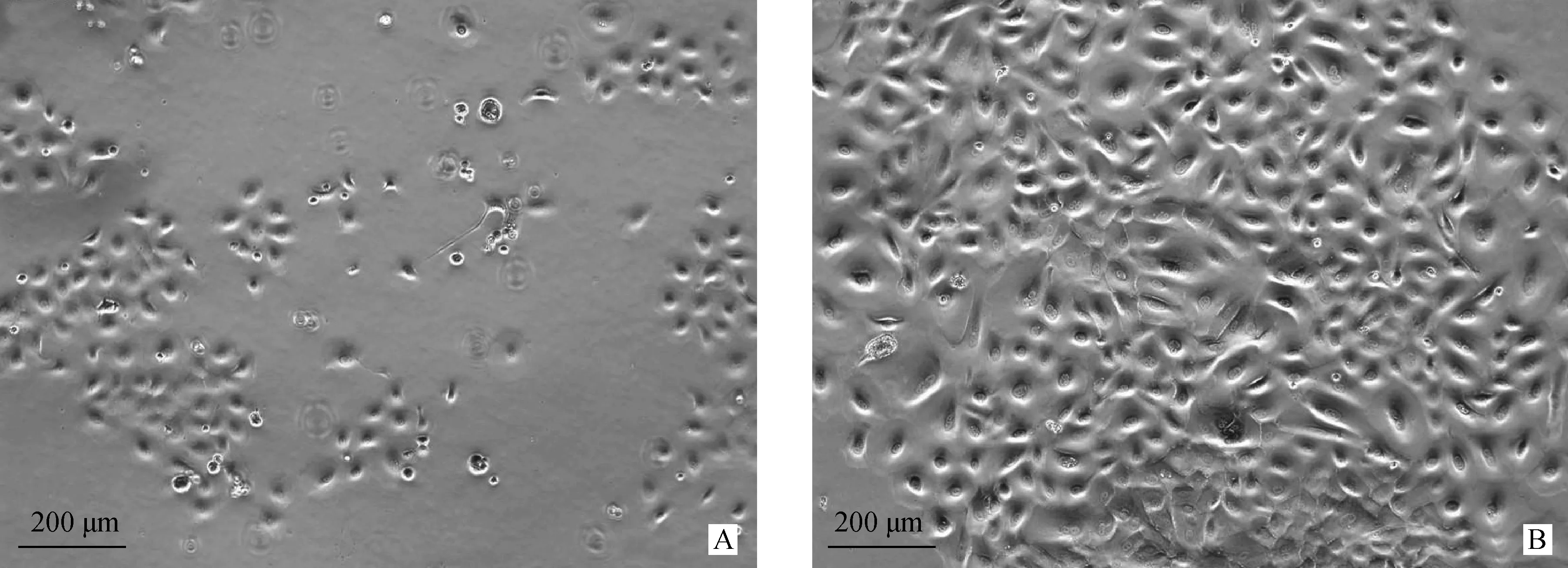
A.傳代培養2 d后的綿羊瘤胃上皮細胞;B傳代培養4 d后的綿羊瘤胃上皮細胞A.The ruminal epithelial cells in sheep after 2 days subculture; B.The ruminal epithelial cells in sheep after 4 days subculture圖2 綿羊瘤胃上皮細胞的傳代培養結果 100×Fig.2 The subculture of ruminal epithelial cells in sheep 100×
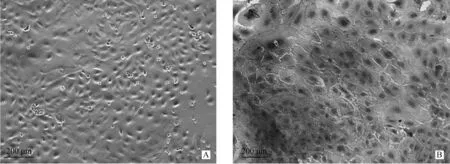
A.傳代培養4 d后的綿羊瘤胃上皮細胞(100×);B.綿羊瘤胃上皮細胞免疫細胞化學染色結果(200×)A. The ruminal epithelial cells in sheep after 4 days subculture(100×); B.The ruminal epithelial cells in sheep by immunocytochemical staining(200×)圖3 綿羊瘤胃上皮細胞的鑒定結果Fig.3 The verification of ruminal epithelial cells in sheep
2.2 瘤胃上皮細胞總RNA的檢測
將所提取的總RNA用瓊脂糖凝膠電泳進行檢測,可見28S rRNA和18S rRNA條帶清晰完整,5.8S條帶隱約可見,均無拖尾(圖4),說明所提RNA無降解。酶標儀檢測樣品A260 nm/A280 nm比值在2.0左右,表明幾乎無蛋白質和多糖污染,RNA滿足試驗要求。
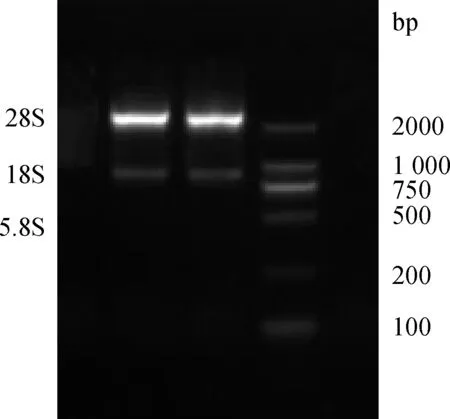
圖4 瘤胃上皮細胞總RNA電泳結果Fig.4 The total RNA of ruminal epithelial cells
2.3 實時熒光定量PCR結果
2.3.1 瘤胃上皮細胞SBD-1和β-actin基因的實時熒光定量PCR擴增效率曲線 將5個濃度的樣品分別進行SBD-1和β-actin基因實時熒光定量PCR擴增后,儀器會自動給出PCR擴增效率曲線圖(圖5)。從擴增效率曲線圖中得出,SBD-1和β-actin基因擴增曲線的回歸系數分別為R2=0.994 0和R2=0.997 4。從待測基因SBD-1和β-actin基因表達量的對數值(x軸)和Ct值(y軸)的關系可以看出,二者之間存在著反比例的關系,且擴增效率接近等于1,待測基因表達量的對數值與Ct值呈現明顯的線性關系,表明可以用熒光定量PCR相對定量法檢測SBD-1基因的表達,并可以通過運用2-ΔCt公式進行目的基因相對表達量的計算。
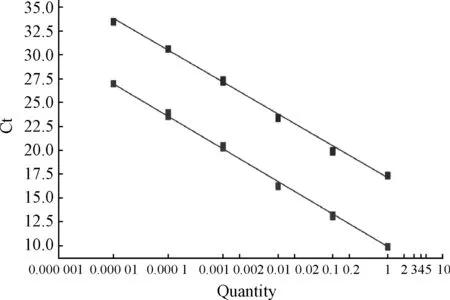
圖5 SBD-1和β-actin基因的擴增效率曲線Fig.5 The real-time PCR amplification efficiency curve of SBD-1 and β-actin genes
2.3.2 瘤胃上皮細胞SBD-1和β-actin基因的實時熒光定量PCR擴增曲線及熔解曲線 綿羊瘤胃上皮細胞中SBD-1和β-actin基因表達的熒光定量PCR擴增曲線均表現出標準指數曲線特征(圖6)。
從熔解曲線上看(圖7),SBD-1和β-actin基因的熒光定量PCR擴增產物分別在86和88.5 ℃時出現單一峰,均沒有出現雜峰,也沒有出現異常增寬的主峰,同時主峰(熔解峰)對應的Tm值與擴增產物的理論Tm值相近,說明熒光定量PCR的擴增產物為單一的具有特異性的產物。

圖6 β-actin和SBD-1基因的擴增曲線Fig.6 The real-time PCR amplification curve of SBD-1 and β-actin genes
2.3.3 枯草芽孢桿菌對瘤胃上皮細胞SBD-1表達影響的時間與濃度之間的關系 根據公式對數據處理后,運用軟件進行圖形處理。當刺激2、4、8、12和24 h后,隨菌液濃度的增加,SBD-1的表達量增大,當菌液濃度為1010cfu·mL-1時,表達量達到峰值,之后,隨菌液濃度的增大,表達量逐漸減少,且菌液濃度為109、1010、1011cfu·mL-1時,SBD-1的表達量與空白相比,均為極顯著性差異(圖8)。對于不同濃度不同時間刺激下,SBD-1的表達量從整體水平上看,菌液濃度為1010cfu·mL-1、刺激時間為8 h時,表達量達到最大值(圖9)。
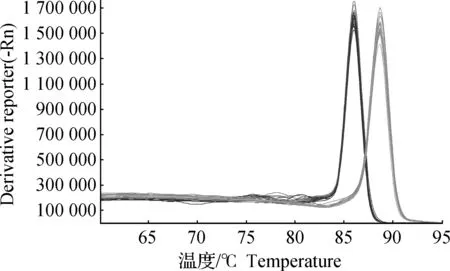
圖7 SBD-1和β-actin熔解曲線Fig.7 The real-time PCR melt peak curve of SBD-1 and β-actin genes
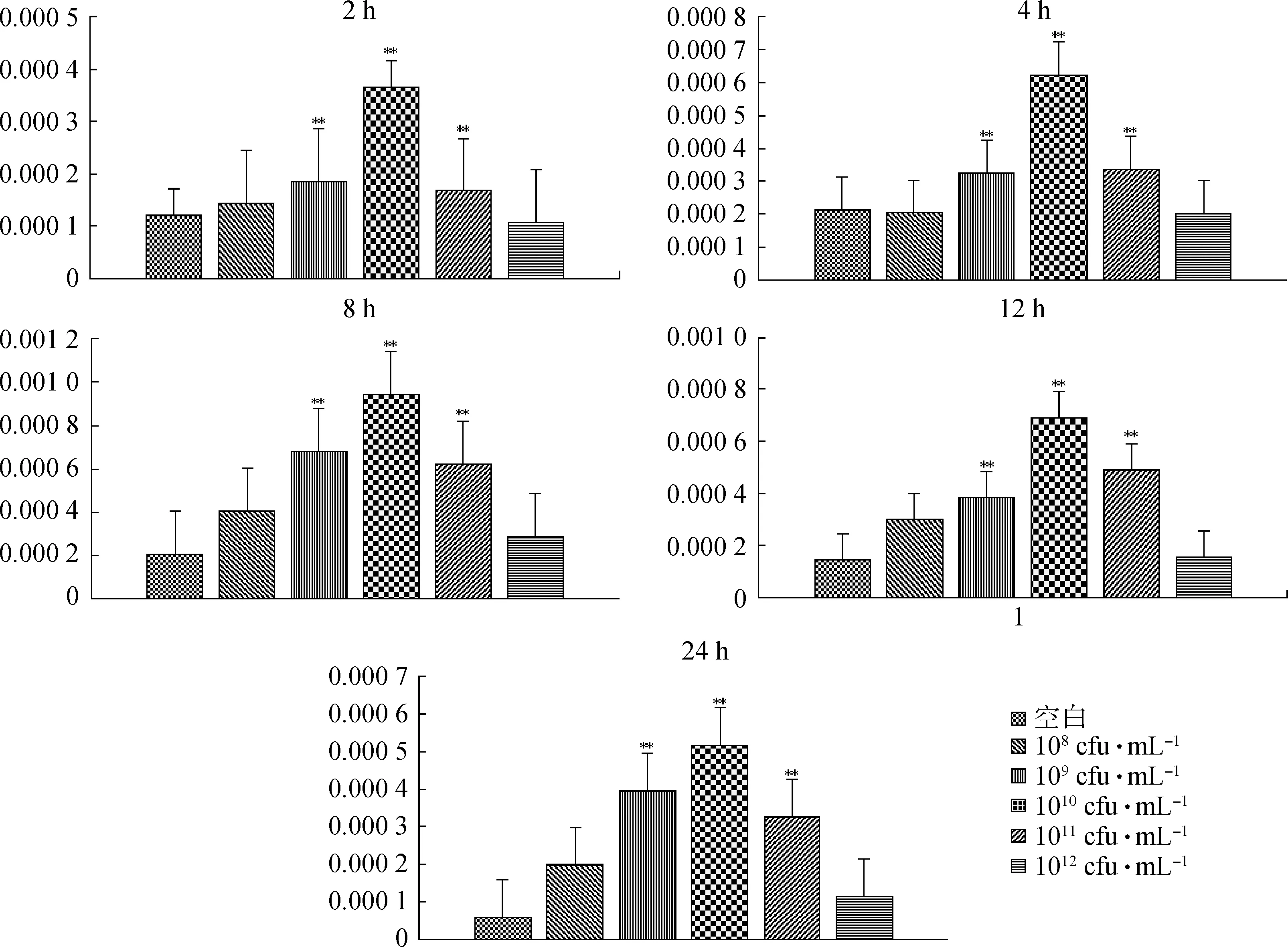
**.P<0.01圖8 不同枯草芽孢桿菌濃度刺激瘤胃上皮細胞2、4、8、12和24 h后SBD-1的表達量Fig.8 SBD-1 gene expression in ruminal epithelial cells stimulated by Bacillus subtilis with different concentrations after 2,4,8,12 and 24 h
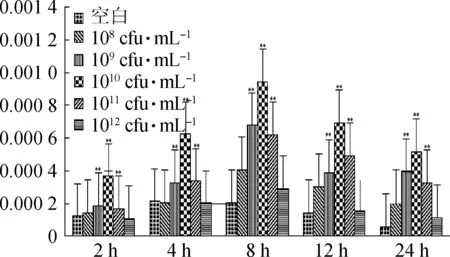
**.P<0.01圖9 枯草芽孢桿菌對瘤胃上皮細胞SBD-1表達的時間和濃度依賴關系Fig.9 SBD-1 gene expression in rumen epithelial cells stimulated by Bacillus subtilis with different concentrations at different times
3 討 論
綿羊瘤胃上皮屬于復層扁平上皮,由外到內依次為角質細胞層、顆粒細胞層、棘狀細胞層和基底層,基底層和棘狀層細胞是瘤胃上皮最重要的細胞,也是體外研究瘤胃上皮的最佳細胞,但是堅實的角質層細胞會影響胰蛋白酶的消化作用。P.Galfi等[14]首次應用胰蛋白酶連續消化法去除角質層,成功的培養了瘤胃上皮細胞;J.L.Klotz等[15]對消化緩沖液和胰蛋白酶濃度進行了優化,獲得大量活細胞比例極高的瘤胃上皮細胞;孫志洪等[16]培養瘤胃上皮細胞時,在微生物去除、消化酶的選用和使用方面進行了優化;F.Stumpff 等[17]設計了特制的尤斯灌流室式的裝置來分離瘤胃上皮細胞。本試驗借鑒前人的經驗,用青霉素、鏈霉素、慶大霉素、兩性霉素去除瘤胃內微生物,并鈍性分離瘤胃黏膜得到上皮層,然后用0.25% 胰蛋白酶對所得上皮組織連續消化,獲得了可培養的瘤胃上皮細胞。
益生菌已經由糧食及農業組織/世界衛生組織定義為活的微生物,可通過改善胃腸道微生物平衡有利地影響宿主動物,可以促進生長,提高飼料利用效率,保護宿主免受腸道感染。有研究表明,在反芻動物中,益生菌可提高動物增長率及飼料利用效率[7]。枯草芽孢桿菌是革蘭陽性細菌生理學的研究代表[18],最近的研究表明,枯草芽孢桿菌的益生作用在人、植物和動物中都有所體現。2012年,J.H.Lee等[11]發現,枯草芽孢桿菌可以使人乳腺癌細胞內細菌的生長得到抑制;2004年,H.P.Bais等[18]研究表明,枯草芽孢桿菌可以形成一個穩定的、廣泛的生物膜來抵抗病原菌,從而保護植物;2010年,D.Shahnaz等[19]發現,枯草芽孢桿菌在作物根部感染真菌方面具有防治作用。本試驗研究發現,枯草芽孢桿菌可提高體外培養的綿羊瘤胃上皮細胞內抗菌肽防御素的表達,表明枯草芽孢桿菌可提高機體免疫力。
2007年德國學者M.Schlee等[8]研究發現,在培養的人腸上皮細胞Caco-2中加入益生菌大腸桿菌Nissle1917可以誘導人β-防御素-2的表達,之后,M.Schlee等[9]研究發現,不同的益生菌乳酸菌株也能夠誘導人β-防御素-2的表達。劉佳明等[20]發現,乳酸桿菌細胞壁成分可上調小鼠陰道組織β-防御素-2的表達,黎觀紅等[21]發現,鼠李糖乳酸桿菌LGA能夠促進雞小腸上皮細胞β-防御素-9的表達。在試驗中,M.Schlee等[9]所用的為不同的菌株,選取了4個濃度:106、107、108、109cells·mL-1,發現刺激6 h、菌液濃度為109cells·mL-1時表達量最大。劉佳明研究表明,防御素的表達量隨乳桿菌濃度增大而增多,5、20、100 mg·L-1濃度的乳桿菌細胞壁成分處理下,100 mg·L-1濃度的乳桿菌細胞壁成分對β-防御素-2表達的增加最為明顯。黎觀紅等[21]則研究了其中的3個濃度:105、106、107cfu·mL-1,發現菌液濃度為106cfu·mL-1、刺激時間為12 h時,表達量達到峰值。試驗中,M.Schlee等[9]和劉佳明等[20]的結果均表明,菌液對防御素的作用存在劑量依賴關系,隨菌液濃度增大而表達量增加,而黎觀紅則僅研究了3個濃度。本試驗在前人研究的基礎上,選用了108、109、1010、1011、1012cfu·mL-15個濃度,并且發現在不同時間不同濃度菌液的刺激下,SBD-1的表達量均有所不同,當菌液濃度為1010cfu·mL-1刺激上皮細胞8 h后,SBD-1的表達量達到最高,之后,隨菌液濃度的增加表達量反而降低,菌液濃度的增加使本試驗的結論更具說服力。試驗結果的不同可能與不同菌種其菌體的有效成分有關,有效成分的鑒定仍需進一步研究。
4 結 論
本研究利用體外培養的綿羊瘤胃上皮細胞,從基因水平探討了枯草芽孢桿菌誘導綿羊瘤胃上皮細胞內SBD-1基因的表達的可能性,結果表明,適宜濃度的枯草芽孢桿菌可顯著提高綿羊瘤胃上皮細胞內SBD-1基因的表達。
[1] TAVARES L S,SILVA C S,DESOUZA V C,et al.Strategies and molecular tools to fight antimicrobial resistance:resistome,transcriptome,and antimicrobial peptides[J].FrontMicrobiol,2013,4(412),doi:10.3389/fmicb.2013.00412.
[2] YANG Y F,WANG C Y,ZHAO Y F,et al.Reindeer beta-defensin-1:full-length cDNA cloning and tissue expression[J].VetImmunolImmunopathol,2009,131(1-2):137-139.
[3] ZHAO P W,CAO G F.Production of bioactive sheep β-defensin-1 in Pichia pastoris[J].JIndustrialMicrobiolBiotechnol,2012,39(1):11-17.
[4] 李 硯,楊銀鳳.家畜體內防御素的多態性和表達[J].中國畜牧獸醫,2013,40(3):160-168. LI Y,YANG Y F.The polymorphisms and expression of defensins in domestic animal[J].ChinaAnimalHusbandry&VeterinaryMedicine,2013,40(3):160-168.(in Chinese)
[5] 楊銀鳳,火 焱,王秀梅.抗微生物肽家族成員—防御素[C]//中國畜牧獸醫學會動物解剖學及組織胚胎學分會、華中農業大學.中國畜牧獸醫學會動物解剖學及組織胚胎學分會第十四次學術研討會.武漢:中國畜牧獸醫學會,2006:334-344. YANG Y F,HUO Y,WANG X M.Antimicrobial peptide family members-defensin[C]//Chinese Association of Animal Science and Veterinary medicine of Anatomy and Embryology Branch,uazhong Agticultural university.The proceedings in the fourteenth symposium of Chinese Association of Animal Science and Veterinary medicine of Anatomy and Embryology Branch.Wuhan:Chinese Association of Animal Science and Veterinary medicine,2006:334-344.(in Chinese)[6] 盛金良,陳創夫,楊 霞,等.綿羊防御素(sBD1)mRNA在不同發育階段的組織分布和定量分析[J].畜牧獸醫學報,2009,40(1):20-25. SHENG J L,CHEN C F,YANG X,et al.Distribution and quantitative analysis of sheep defensin(sBD1) mRNA in different developmental stages[J].ActaVeterinariaetZootechnicaSinica,2009,40(1):20-25.(in Chinese)
[7] EZEMA C.Probiotics in animal production:A review[J].AcadJ,2013,5(11):308-316.
[8] SCHLEE M,WEHKAMP J,ALTENHOEFER A,et al.Induction of human beta-defensin 2 by the probiotic Escherichia coli Nissle 1917 is mediated through flagellin[J].InfectImmun,2007,75(5):2399-2407.
[9] SCHLEE M,HARDER J,KTEN B,et al.Probiotic lactobacilli and VSL#3 induce enterocyte beta-defensin 2[J].ClinExpImmunol,2008,151(3):528-535.
[10] MARUBASHI T,GRACIA M I,VILA B,et al.The efficacy of the probiotic feed additive Calsporin(BacillussubtilisC-3102)in weaned piglets:combined analysis of four different studies[J].JApplAnimNutr,2013,1(2):1-5.
[11] LEE J H,NAM S H,SEO W T,et al.The production of surfactin during the fermentation of cheonggukjang by potential probioticBacillussubtilisCSY191 and the resultant growth suppression of MCF-7 human breast cancer cells[J].FoodChem,2012,131(4):1347-1354.
[12] 蔡 雁.動物益生芽胞桿菌的篩選和生物學特性及益生效果[D].武漢:華中農業大學,2006. CAI Y.The screening,biological characteristics and effect of the animal probioticBacillussubtilis[D].Wuhan:Huazhong Agticultural University,2006.(in Chinese)
[13] 范燕茹,王 佩,金 鑫,等.中國馴鹿瘤胃上皮細胞的體外分離培養[J].黑龍江畜牧獸醫,2014,11:8-10. FAN Y R,WANG P,JIN X,et al.China reindeer rumen epithelial cells isolated and culturedinvitro[J].HeilongjiangAnimalScienceandVeterinaryMedicine,2014,11:8-10.(in Chinese)
[15] KLOTZ J L,BALDWIN R L,GILLIS R C,et al.Refinements in primary rumen epithelial cell incubation techniques[J].JDairySci,2001,84(1):183-193.
[16] 孫志洪,張慶麗,賀志雄,等.山羊瘤胃上皮細胞和空腸黏膜上皮細胞原代培養技術研究[J].動物營養學報,2010,22(3):602-610. SUN Z H,ZHANG Q L,HE Z X,et al.The research of primary culture of rumen epithelial cells and jejunal epithelial cells[J].ChineseJournalofAnimalNutrition,2010,22(3):602-610.(in Chinese)
[17] STUMPFF F,GEORGI M I,MUNDHENK L,et al.Sheep rumen and omasum primary cultures and source epithelia:barrier function aligns with expression of tight junction proteins[J].ExpBiol,2011,214(17):2871-2882.
[18] BAIS H P,FALL R,VIVANCO J M.Biocontrol of Bacillus subtilis against infection of arabidopsis roots by pseudomonas syringae is facilitated by biofilm formation and surfactin production1[J].AmSocPlantBiol,2004,134(1):307-319.
[19] SHAHNAZ D,SAMREEN W,MARIUM T,et al.Application ofBacillusspeciesin the control of root rot diseases of crop plants[J].ArchPhytopatholPlantProt,2010,43(4):412-418.
[20] 劉佳明,丁 卉,樓永良.乳桿菌細胞壁成分對小鼠陰道組織β-防御素2誘導表達的影響[J].中國微生態學雜志,2011,23(4):306-309. LIU J M,DING H,LOU Y L.The affect of mice β- defensin-2 in vaginal tissue by lactobacillus cell wall components[J].ChineseJournalofMicroecology,2011,23(4):306-309.(in Chinese)
[21] 黎觀紅,洪智敏,賈永杰,等.鼠李糖乳酸桿菌LGA對雞小腸上皮細胞β-防御素-9基因表達的影響[J].畜牧獸醫學報,2012,43(4):634-641. LI G H,HONG Z M,JIA Y J,et al.The influence of chicken β-defensin-9 in intestinal epithelial cells by lactobacillus rhamnosus[J].ActaVeterinariaetZootechnicaSinica,2012,43(4):634-641.(in Chinese)
(編輯 郭云雁)
Effects ofBacillussubtilison the Expression of SBD-1 in Cultured Ruminal Epithelial Cells of Sheep
WANG Pei1,2,FAN Yan-ru1,2,JIN Xin1,2,YANG Yin-feng1,2*
(1.CollegeofVeterinaryMedicine,InnerMongoliaAgriculturalUniversity,Hohhot010018,China; 2.KeyLaboratoryofClinicalDiagnosisandTreatmentTechnologyinAnimalDiseaseofMinistryofAgriculture,Hohhot010018,China)
In this study,Bacillussubtiliswas selected to investigate its effect on the β-defensin expression of ovine ruminal epithelial cells culturedinvitro.Firstly,the ovine ruminal epithelial cells were culturedinvitro,then the epithelial cells were stimulated byBacillussubtiliswith different concentrations at different times,the expression ofSBD-1 mRNA was determined by real-time fluorescence quantitative PCR(RT-PCR).The results indicated that the expression peak ofSBD-1 mRNA was after 8 h treated byBacillussubtiliswith 1010cfu·mL-1.The expression ofSBD-1 was increased significantly after treated byBacillussubtiliswith different concentrations,and the expression at 109,1010,1011cfu·mL-1showed stronger induction response than the blank(P<0.01).This study reveals thatBacillussubtiliscan induce the expression ofSBD-1 in ovine ruminal epithelial cells.
β-defensin-1;ruminal epithelial cells;Bacillussubtilis;real-time fluorescence quantitative PCR
10.11843/j.issn.0366-6964.2015.05.011
2014-07-28
國家自然科學基金項目(31160491)
王 佩(1989-),女,山西靈石人,主要從事反芻動物消化道免疫研究,E-mail:wangpei1205@126.com
*通信作者:楊銀鳳,教授,博士,主要從事反芻動物消化道免疫研究,E-mail:julie1963@163.com
S826;S813.3
A
0366-6964(2015)05-0760-08

