肝纖維化診斷方法的現狀簡述
江訓猛 劉 楨
江西中醫藥大學2014 級研究生班 (江西 南昌,330000)
病毒性肝炎、酒精中毒、血吸蟲感染等導致的慢性肝病是我國最多發的常見病之一。肝纖維化是大多慢性肝病的共同病理過程,炎癥、肝星狀細胞和Kupffer 細胞激活、細胞外基質(ECM)的合成及降解能力的改變、某些細胞因子的釋放是啟動肝纖維化的重要因素。肝纖維化可進一步發展為肝硬化甚至肝癌,患者病死率相當高,生活質量也相當差。在世界范圍內,肝硬化的年發病率達100(25~400)/10 萬,每年約3%~6%的肝硬化患者會發生肝癌,我國每年死于肝癌人數約11 萬人,占全世界肝癌死亡人數45%[1]。目前公認,肝纖維化有時可以逆轉但肝硬化難以逆轉。如能阻斷、減輕乃至逆轉肝纖維化,就能在很大程度上改善各種肝病的預后,而肝纖維化的早期檢測是早期干預的前提。
1 肝組織活檢
肝組織活檢是肝纖維化檢測的“金標準”,但肝活檢仍有許多不足之處:①創傷性檢查的限制性:不易被患者接受,約0.3%發生肝穿刺后嚴重合并癥,難以反復檢測而不能判斷肝纖維化的進程[2]。②病變和評估系統的影響:肝纖維化的不均勻性及評估系統的差異[3~6]。③標本差異:肝活檢獲取的肝組織僅是整個肝臟的5 萬分之一,標本太小可出現纖維化分期低估,肝硬化的漏診可達15%~30%[7]。標本長度不夠和標本破碎造成的標本錯誤是病理診斷失敗的常見原因,由其引起的分級和分期假陰性分別占10.1%和4.5%,主要與標本太小有關;而纖維化分期的假陽性發生率3.5%則主要與標本破碎有關[8]。肝臟表面楔形活檢標本也可能給診斷帶來假象,正常肝包膜下纖維組織豐富,在低氧、缺血或免疫介導的肝損傷時,肝包膜下病變受累更明顯,易誤診肝纖維化或肝硬化。④觀察者差異:組織學分析活檢標本需有經驗和技能,但仍然存在主觀傾向,易在觀察者內和觀察者之間產生差異[9,10]。此外,肝纖維化是一個損傷和修復的動態過程,通過一次肝穿不能把肝纖維化發展的過程全程監測。另外,肝活檢無法量化纖維化的程度[11]。Poynard 等近來研究顯示,當肝活檢和血清學檢測結果不一致時肝活檢診斷的失敗率是血清標志物的7 倍以上[12]。
2 肝纖維化無創診斷方法
目前已建立的肝纖維化無創診斷方法主要有影像學檢查、血清學標記物和肝纖維化程度預測的簡易無創模型。
2.1 影像學檢查 包括超聲、CT 和核磁共振,常規的方法只能在肝纖維化晚期即發生肝硬化和門脈高壓時出現異常圖像[13],不利于早期診斷。最新應用的瞬時彈性超聲Fibroscan、彈性成像MRI 等已顯示出較高的診斷價值,是近年來受到廣泛關注的一種無創診斷方法。Sandrin 等[14]用瞬時彈性記錄儀來評估106 例慢性丙型肝炎(CHC)肝纖維化,認為彈性波傳播速度與肝纖維化(METAVIR 標準)直接相關。但最近研究證明,在慢性乙型肝炎(CHB)患者中,Fibroscan 檢測的彈性波傳播速度不能作為纖維化程度的預測因素,其與肝活檢有明顯不一致性[15]。另外,肥胖或超重的患者由于其彈性波或超聲逐漸減弱,導致肝臟硬度無法測定[16]。有文獻報道,高體質量指數、高年齡、肋間隙狹窄以及合并腹水的患者[13]測定成功率降低。此外,此檢測要求設備昂貴、操作技術難度大、主觀隨意性強,難以在臨床推廣普及。且目前的瞬時彈性成像主要針對丙型肝炎患者,而對CHB 患者或其他肝臟疾病的研究較少。
2.2 血清學診斷指標 血清生化指標可分為直接指標和間接指標。直接指標即ECM 以及與ECM 轉化有關的其他物質,如透明質酸(HA)、Ⅲ型前膠原氨基端肽(PⅢNP)、Ⅳ型膠原(Ⅳ-C)、層粘蛋白(LN)、基質金屬蛋白酶(MMPs)及其抑制劑組織金屬蛋白酶抑制劑(TIMPs)、轉化生長因子β1 等。間接指標是指可反映炎癥活動及纖維化程度的相關指標,如血小板(PLT)、丙氨酸氨基轉移酶(ALT)、α2 巨球蛋白、γ-谷氨酰轉肽酶(GGT)、總膽紅素(TBil)、載脂蛋白A1(ApoA1)等。其中HA為ECM 中最重要的糖胺多糖成分,可較準確靈敏地反映肝內已生成的纖維量及肝細胞受損、炎癥活動狀況,有研究認為HA 是反映肝纖維化最具價值的血清學標志物[16]。LN 為基底膜中特有的非膠原性糖蛋白,與肝纖維化活動程度及門靜脈壓力呈正相關,但用其判斷肝纖維化程度尚不夠敏感,只能作為活動性纖維化的指標[17]。經糖化及羥化的Ⅲ型前膠原在端肽酶的作用下切去氨基端及羧基端的球形肽,形成Ⅲ型膠原纖維沉積于細胞外間質中,因此血清中PⅢNP 可以間接反映肝臟膠原的合成代謝,動態監測肝臟纖維化的活動性。Ⅳ-C 可較靈敏地反映肝纖維化過程,是肝纖維化的早期標志之一。上述4 項直接指標的診斷價值雖已較明確,但這些診斷指標,不僅相對昂貴、比較單一,而且往往受到諸多因素如肝臟炎癥、肝臟代謝或清除能力下降等的影響而缺乏特異性,不能全面反映肝纖維化的嚴重程度,診斷價值有限,僅僅只能作為參考,不利于作為普通的臨床篩查指標推廣[18]。并且以往這些指標的檢測多采用是放射免疫分析法(radioimmunoassay,RIA)和酶聯免疫吸附試驗(enzyme-linked immunosorbent assay,ELISA),ELISA 法操作繁瑣,檢測過程中影響因素較多,結果重復性較差;RIA 法由于受標記物的穩定性、測量范圍、放射性污染、檢測周期較長等因素的影響,也存在一定的局限性。
2.3 肝纖維化程度預測的簡易無創模型 聯合應用多指標的數學診斷模式已成共識,目前國際上建立了較多肝纖維化無創診斷模型,一般分兩類:一類是以臨床常規檢查指標為參數構成的簡單模型,包括天冬氨酸氨基轉移酶/血小板比值指數(APRI)、FIB(纖維蛋白原)-4、FornS 指數等;另一類則是包含了血清肝纖維化指標的模型,包括Fibrotest(FT)、Fibro SpectⅡ、歐洲肝纖維化組模型、FibroMeter、Hepaseore、上海肝纖維化組模型(SLFG)、FibroIndex 等(其中SLFG 和FibroIndex 是我國學者以CHB 患者為研究對象所創立的)。由于疾病譜的差異,國際上各類模型絕大多數均在CHC 患者中建立并進行驗證,其次是酒精性肝病。而我國的慢性肝病病因以CHB 為主,由于病因的不同,國際上流行的相關診斷模型是否適合于我國CHB 患者,還是我國學者所建立的模型更符合國情,亦或是多模型的綜合運用診斷準確性更高,目前的文獻還沒有對此有明確的結論。這些方法中有的已經在辨別無或輕度纖維化,以及早期肝硬化方面成功地發揮了作用,但他們對中間階段肝纖維化(S2,S3)的判別仍有待提高。在美國肝臟病學會提出的肝損傷指標的臨床應用指南中,對肝纖維化的診斷提倡應用PLT、ALT、血清前白蛋白(PA)、凝血酶原時間(PT)等4 項(此4 項簡稱PAPP 指數)常規指標的組合,而且對于這4 項指標分別與肝纖維化的關系國內外均有報道[19~25]。血液中PLT 數量的減少與肝硬化的程度關系密切,如慢性肝炎患者的血小板計數逐步減低,很有可能正在向肝纖維化進展;血清ALT 與肝損傷程度的關系最為密切,是肝功能檢測的重要指標,當ALT 持續升高或持續恒定高于正常水平時,提示可能并發肝細胞壞死或肝纖維化且預后不良;PA 由肝細胞合成,測定其在血漿中的濃度對于了解蛋白質營養不良和肝功能不全有較高的敏感性,肝纖維化患者PA 水平均降低,且與嚴重程度相一致;PT 是檢測外源性凝血系統最常用的實驗學指標,當肝臟疾病引起肝細胞損害時,肝臟合成凝血因子功能減低,引起維生素K 依賴因子(Ⅱ、Ⅶ、Ⅸ、Ⅹ)等合成減少,血漿循環抗凝物質增多,FIB 含量減低,從而使PT 延長,PT 的測定值和異常率與肝功能損害程度均呈正相關。PAPP 指數在肝纖維化S0~S4期進展過程中呈逐漸升高趨勢,與肝損傷和肝纖維化程度成正相關。PAPP 指數判斷標準見表1。
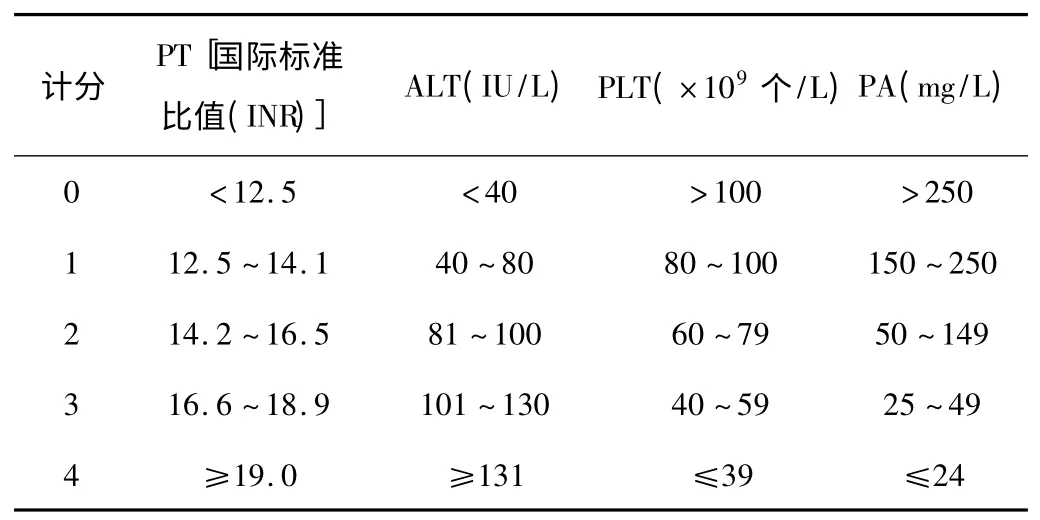
表1 PAPP 指數各項指標計分評判標準
3 展望
隨著肝纖維化基礎研究的不斷深入、血清學無創診斷模型的日益完善以及影像學技術的飛速發展,肝穿刺“金標準”越來越受到質疑。根據近年來研究所得出的各個血清學診斷模型的診斷價值,未來慢性肝病患者肝臟纖維化程度的診斷將可能采用血清學+影像學+肝穿刺的綜合模式。先用無創方法診斷一部分患者,無法診斷的患者行肝穿刺檢查。
值得提出的是,對于臨床決策而言,一個能反映纖維化發生(fibrogenesis)的檢驗比僅僅體現纖維化沉積(fibrosis)的檢驗更有意義,因為關鍵不在于有多少纖維化已經出現,而在于纖維化是否仍在形成發展中。靜止的肝纖維化即使相對廣泛,但如果去除損傷因子,肝臟也可代償以維持生命。因此,建立能監測纖維化發生發展的檢驗系統,將有助于及時發現處于肝功能代償狀態但有進展性肝纖維化的患者,當然也能隨訪治療的效果。炎癥壞死的發展加之纖維生成的進展正是疾病進展惡化的關鍵所在,這是今后研究無創診斷方法時所應關注的。
[1]Harkisoen S,Arends JE,van Erpecum KJ,et al.Hepatitis B viral load and risk of HBV-reiated liver disease:from East to West?[J].Ann Hepatol,2012,11(2):164 -171.
[2]Ziol M,Handra-Luca A,Kettaneh A,et al.Noninvasive assessment of liver fibrosis by measurement of stiffness in patients with chronic hepatitis C[J].Hepatology,2005,41(1):48 -54.
[3]Rosenberg WM,Voelker M,Thiel R,et al.Serum markers detect the presence of liver fibrosis:a cohort study[J].Gastroenterology,2004,127(6):1704 -1713.
[4]Rousselet MC,Michalak S,Dupre F,et al.Sources of variability in histological scoring of chronic viral hepatitis[J].Hepatology,2005,41(2):557 -264.
[5]Goldstein NS,Hastah F,Galan MV,et al.Fibrosis heterogeneity in nonalcoholic steatohepatitis and hepatitis C virus needle core biopsy specimens[J].Am J Clin Pathol,2005,123(3):382 -387.
[6]Siddique I,EI-Naga HA,Madda JP,et al.Sampling variability on percutaneous liver biopsy in patienis with chronic hepatitis C virus infection[J].Scand J Gastroenterol,2003,38(4):427 -432.
[7]Fontana RJ,Lok AS.Noninvasive monitoring of patients with chronic hepatitis C[J].Hepatology,2002,36(5 suppl 1):S57 -64.
[8]Poynard T,Munteanu M,Imbert-Bismut F,et al.Prospective analysis of discordant results between biochemical markers and biopsy in Patienis with chronic hepatitis C[J].Clin Chem,2004,50:1344 -1355.
[9]Seheuer PJ,Lefkowitch JH.Liver biopsy interpretation(6thed.)[M].London:WB Saunders,2002.
[10]Afdhal NH.Diagnosing fibrosis in hepatitis C:is the pendulum swinging from biopsy to blood tests?[J].Hepatology,2003,37(5):972 -974.
[11]Cales P,Oberti F,Michalak S,et al.A novel panel of blood markers to assess the degree of liver fibrosis[J].Hepatology,2005,42(6):1373 -1381.
[12]Poynard T,Munteanu M,Imbert-Bismut F,et al.Prospective analysis of discordant results between biochemieal markers and biopsy in patients with chronic hepatitis C[J].Clin Chem,2004,50:1344 -1355.
[13]Rockey D,Bissell D.Noninvasive measures of liver fibrosis[J].Hepatology,2006,43:S113 -S120.
[14]Sandrin L,Fourquet B,Hasquenoph JM,et al.Transient elastography:a new noninvasive method for assessment of hepatic fibrosis[J].Ultrasound Med Biol,2003,29:1705 -1713.
[15]Kim SU,Seo YS,Cheong JY,et al.Fibrosis measurement by FibroScan in patients with chronic Hepatitis B[J].Alimentary Pharmacology & Therapeutics,2010,32(3):498 -505.
[16]Foucher J,Castéra L,Bernard PH,et al.Prevalence and factors associated with failure of liver stiffness measurement using FibroScan in a prospective study of 2114 examinations[J].Eur J Gastroenterol Hepatol,2006,18:411 -412.
[17]王靜艷,高紅,王兆荃,等.Ⅲ型前膠原與層粘連蛋白在肝纖維化診斷中的意義[J].中國醫科大學學報,1997,26(2):177 -179.
[18]Liu T,Wang X,Karsdal MA,et al.Molecular serum markers of liver fibrosis[J].Biomark Insights,2012,7:105 -117.
[19]Schmidt LE,Dalhoff K.Alpha-fetoprotein is a predictor of outcome in acetaminophen-induced liver injury[J].Hepatology,2005,41(1):26 -31.
[20]Tran A,Hastier P,Barjoan EM,et al.Non invasive prediction of severe fibrosis in patients with alcoholic liver disease[J].Gastroenterol Clin Bio,2000,24(6 -7):626 -630.
[21]Shi HB,Chen Y,Han DK,et al.Dynamic changes of serum fibrosis indices and alpha fetoprotein and their relations with prognosis of patients with severe hepatitis[J].World Chin J Dig,2008,16(21):2408 -2411.
[22]Poynard T,Imbert-Bismut F,Ratziu V,et al.Biochemical markers of liver fibrosis in patients infected by hepatitis C virus:longitudinal validation in a randomized trial[J].J Viral Hepat,2002,9(2):128-133.
[23]Chen HG.Clotting in patients with cirrhosis related indicators analyze test results[J].Foreign Med Sci Clin Biochem Lab Med,2004,25(1):89,91.
[24]Tangkijvanich P,Kongtawelert P,Pothacharoen P,et al.Serum hyaluronan:a marker of liver fibrosis in patients with chronic liver disease[J].Asian Pac J Allergy Immunol,2003,21(2):115 -120.
[25]Hao JJ,Jiang FY.Cirrhosis of the liver four indicators of blood coagulation and platelet deermination of clinical significance[J].J North China Coal Med Coll,2008,10 (1):56 -57.

