COPD營養狀態模型對呼吸肌蛋白質分解代謝的影響
林志勇 梁志科
廣州市第一人民醫院呼吸內科,廣東廣州 510180
慢性阻塞性肺疾病(COPD)是臨床上常見的疾病,患者發病后臨床癥狀較多,且多數患者伴有營養不良等癥狀。根據相關研究結果顯示,營養不良是獨立于氣流阻塞程度的影響COPD患者治療預后、死亡率等重要危險因素之一。目前,醫學界普遍認為,COPD營養不良和炎癥因子關系密切的是一種腫瘤壞死因子(TNF-α)[1]。為了探討COPD營養狀態模型對呼吸肌蛋白質分解代謝的影響,本研究對2013年4月~2014年4月在我院進行的80例大鼠相關研究結果進行分析,現報道如下。
1 資料與方法
1.1 一般資料
對我院培育的80例健康Wistar大鼠相關資料進行分析,將這些大鼠隨機分為兩組,實驗中大鼠的平均體重為(210.52±10.34)g。研究中大鼠由湖南省人民醫院實驗動物中心提供;相關儀器如:TNF-αELISA檢測試劑盒、豬胰彈性蛋白酶、鄰苯二甲醛(OPA)、3-甲基組氨酸標準品、酪氨酸標準品、小動物肺功能儀等都由中南大學基礎醫學院機能學實驗中心提供。實驗人員拿到大鼠后將其放在有機玻璃箱內進行被動式吸煙,連續吸煙30d,并且在大鼠氣管內注射20μL/100g豬胰彈性蛋白酶。然后,根據大鼠進食量等建立COPD營養不良大鼠模型。
1.2 方法
實驗中將80只大鼠隨機分為兩組,對照組為營養正常大鼠,實驗大鼠隨機分為實驗組。模型組反復熏香煙及氣道內滴注胰蛋白酶方法建立COPD大鼠模型,采用氣管內注入豬胰彈性蛋白酶、熏香煙和限制營養等相關方法建立COPD營養狀態模型。對照組為營養正常大鼠,實驗組靜脈注射TNF-αMcAb進行干預。實驗中對C2C12成肌細胞進行培養,鼠類C2C12成肌細胞系中含有10%V胎牛血清和100U/mL青霉素,100mg/mL鏈霉素,2mML-谷氨酸氨的DMEM培養基中在37℃和5% CO2條件下進行培養[2]。兩組患者均滲生理鹽水灌胃,實驗組大鼠注入IND灌胃,連續干預14d后取尾靜脈血測定干預前血清TNF-α水平。干預完成后繼續飼養14d,測量各組大鼠干預后體重并處死全部動物,收取標本待測。
1.3 觀察指標
實驗中,觀察兩組大鼠PEF、FEV0.3、FEV0.3/FVC及其兩組大鼠血漿葡萄糖糖、白蛋白、甘油三酯、呼吸肌TNF-α水平等指標。
1.4 統計學方法
2 結果
本次研究中,實驗組大鼠PEF指標為(20.46±2.56)mL/S、FEV0.3指標為(3.69±0.37)mL、FEV0.3/FVC指標為(60.8±4.61)%,均低于對照組大鼠(P<0.05)。見表1。
表1 兩組大鼠肺功能的比較(±s)
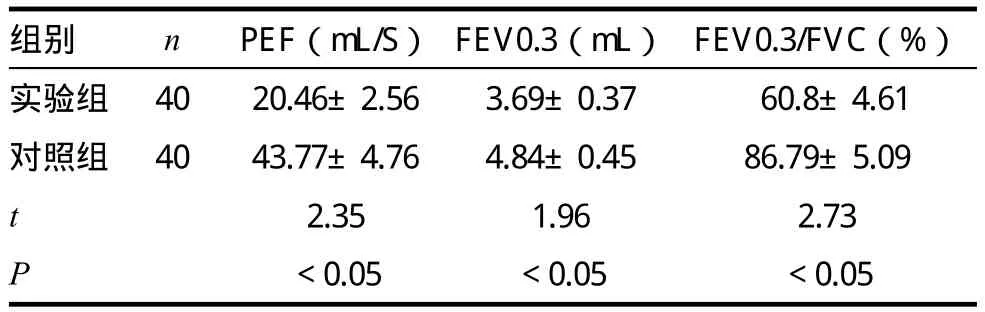
表1 兩組大鼠肺功能的比較(±s)
組別 n PEF(mL/S) FEV0.3(mL) FEV0.3/FVC(%)實驗組 40 20.46±2.56 3.69±0.37 60.8±4.61對照組 40 43.77±4.76 4.84±0.45 86.79±5.09 t 2.35 1.96 2.73 P<0.05 <0.05 <0.05
本次研究中,實驗組大鼠血漿葡萄糖為(7.1±0.9)mmol/L、甘油三脂指標為(0.98±0.11)mmol/L,均高于對照組(P<0.05);白蛋白指標為(27.6±1.0)g/L,低于對照組大鼠(P<0.05)。見表2。
表2 兩組血漿葡萄糖糖、白蛋白、甘油三酯測定結果比較(±s)

表2 兩組血漿葡萄糖糖、白蛋白、甘油三酯測定結果比較(±s)
組別 n 血漿葡萄糖糖(mmol/L)甘油三酯(mmol/L)實驗組 40 7.1±0.9 27.6±1.0 0.98±0.11對照組 40 5.6±0.3 33.7±1.6 0.83±0.05 t 2.18 1.78 2.36 P<0.05 <0.05 <0.05白蛋白(g/L)
本次研究中,實驗組大鼠膈肌TNF-α濃度為(31.58±0.98)pg/mL、肋間內肌勻漿中TNF-α濃度為(29.88±1.30)pg/mL,均高于對照組(P<0.05)。見表3。
表3 兩組呼吸肌TNF-α水平比較(±s,pg/mL)

表3 兩組呼吸肌TNF-α水平比較(±s,pg/mL)
組別 n 膈肌TNF-α濃度 肋間內肌勻漿中TNF-α濃度實驗組 40 31.58±0.98 29.88±1.30對照組 40 23.75±1.95 21.31±2.03 t 1.69 2.48 P<0.05 <0.05
3 討論
慢性阻塞性肺疾病是臨床上常見的疾病,這種疾病機制復雜,誘因也比較多,屬于常見的呼吸內科疾病,目前,這種疾病已經成為了一種公共衛生性疾病。對于慢性阻塞性肺疾病如果不采取積極有效的方法治療將會演變為肺心病,甚至威脅患者死亡。根據相關研究結果顯示:目前,我國COPD患者發病率較高,并且年齡在40歲以上者占84%[3]。本次研究中,建立的COPD模型具備人類COPD的最重要的兩個病理解剖學特征—氣道非特異性炎癥和肺氣腫,并具有人類COPD的最重要的病理生理學特征一阻塞性通氣障礙。
TNF-α是一種炎癥因子,該因子能夠有效的誘導腫瘤組織出血壞死,并且具有相當復雜的生物活性,能夠在人體免疫和非免疫等狀態下發揮作用。這種因子除了有效的抑制腫瘤發生外,還能夠參與炎癥、蛋白質的分解代謝等活動。TNF-α還可以引起機體負氮平衡,促進肌肉蛋白質分解。本次研究中,實驗組大鼠膈肌TNF-a濃度為(31.58±0.98)pg/mL、肋間內肌勻漿中TNF-a濃度為(29.88±1.30)pg/mL,均高于對照組(P<0.05),這個結果和相關研究結果類似。
本次研究中,實驗組大鼠血漿葡萄糖為(7.1±0.9)mmol/L、甘油三脂指標為(0.98±0.11)mmol/L,均高于對照組(P<0.05);白蛋白指標為(27.6±1.0)g/L,低于對照組大鼠(P<0.05),這個結果和相關研究結果類似。由此可以看出:TNF-α在COPD營養不良發生中發揮重要作用。但是,TNF-αMcAb不能夠將COPD模型大鼠營養狀態達到與對照組相同的水平,可以看出在COPD營養不良中還可能于其他因素關系密切[4]。但是,我們可以看出:靜脈注射TNF-α能夠增加人體骨骼肌蛋白分解代謝,能夠有效的抑制蛋白質的何從,從而引起人體骨骼肌蛋白質質量下降。
綜上所述,TNF-α是引起COPD大鼠發生營養不良以及呼吸肌蛋白質分解代謝率升高的原因之一,治療時應該采取積極有效的方法提高臨床治愈率。
[1] 徐衛國,羅勇,吳靖川,等.不同營養狀態COPD腫瘤壞死因子-α測定及其臨床意義[J].中國實用內科雜志,1999,22(11):854-855.
[2] 林樺,孫圣華,高健,等.吲哚美辛對慢性阻塞性肺疾病大鼠腫瘤壞死因子α和骨骼肌蛋白質分解代謝的影響[J].中華內科雜志,2010,49(9):776-780.
[3] 宋小蓮,王昌惠,白沖.脂多糖結合熏煙法和單純熏煙法建立慢性阻塞性肺病大鼠模型的比較[J].第二軍醫大學學報,2010,30(3):246-249.
[4] 賀英,朱明,曲海,等.咪達唑侖和嗎啡聯合治療COPD有創通氣患者的臨床效果觀察[J].昆明醫學院學報,2011,11:115-117.
[5] 陳逶,余曉丹.慢性阻塞性肺疾病患者營養狀況分析及對預后的影響[J].中國基層醫藥,2012,19(2):223-224.
[6] 李復紅,楊德昌.慢性阻塞性肺疾病急性加重期伴甲功異常42例臨床分析[J].實用醫技雜志,2007,14 (21):2945-2946.
[7] 劉建明,廖前德,唐文祥,等.TNF-α對慢性阻塞性肺疾病模型鼠營養狀態和呼吸肌蛋白質分解代謝的影響[J].南方醫科大學學報,2012,32(4):116-120.
[8] 孫圣華,唐文祥,劉純,等.腫瘤壞死因子α對慢性阻塞性肺疾病大鼠模型呼吸肌蛋白質分解代謝的影響[J].中華結核和呼吸雜志,2007,30(3):186-191.
[9] 單麗囡,劉小虹,鐘亮環.培土生金法配合西藥治療慢性阻塞性肺疾病穩定期的臨床觀察[J].湖北中醫雜志,2007,29(4):26-27.
[10] 張鴻,王秋月,侯剛,等.慢性阻塞性肺疾病患者血清瘦素水平與營養不良的關系[J].中國醫科大學學報,2006,35(2):168-170.
[11] 郭韶梅,王愛平,蔡金蓮.老年COPD急性加重期患者免疫及營養狀況臨床分析[J].實用臨床醫學,2006,12(7):75-76.
[12] 周新,白春學.慢性阻塞性肺疾病的預防與治療[M].北京:人民衛生出版社,2009:4.
[13] 余曉丹,汪俊.COPD營養狀況與炎癥反應的關系研究[J].中國現代醫生,2012,50(8):72-74.

