淺談硝酸的氧化性
李慧
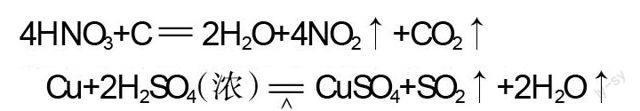

摘 要:眾所周知,硝酸是一種強氧化性酸。除具有酸的通性外,氧化性是它最主要的特性,且隨其濃度的增加,氧化性加強,故也稱作一種強氧化劑。
關鍵詞:硝酸;氧化性;分析
一、硝酸的不穩定性和貯存方法
實驗一:把少量的濃硝酸(濃度69%)裝入試管后加熱。觀察現象:有紅棕色并有刺激性氣味的氣體產生。這種現象說明:硝酸不穩定,易分解。
純凈的硝酸或濃硝酸在正常溫度下見光就會分解,受熱時分解得更快。反應方程式為:
大量實驗證明:硝酸越濃,就越容易分解。而分解放出的二氧化氮溶于硝酸使硝酸呈黃色。所以將硝酸盛在棕色瓶里,存放在低溫、黑暗處,可防止硝酸分解。
二、硝酸與金屬反應
1.硝酸的濃度與它的氧化能力
實驗二:在兩支放有銅片的試管里,分別加入濃度為69%的濃硝酸和濃度為16%的稀硝酸。
據科學資料介紹:上述反應中當硝酸的濃度為8摩/升以上時,還原的主要產物是NO2,而我們加入試管中的濃硝酸(69%)超過了8摩/升,所以有紅棕色氣體NO2生成。這是因為硝酸越濃,氧化性越強,反應過程中生成的低價氮的化合物在強的氧化氣氛中不能存在,繼續被氧化成了高價氮的氧化物NO2。在加入稀硝酸的試管中,稀硝酸的氧化性比較弱,氮的低價氧化物能夠存在,所以主要產物是NO2。而該氣體到試管口卻變成了紅棕色氣體,原因是它與空氣中的氧氣發生了反應,生成了二氧化氮。
兩者電位接近,所以在同一反應中,產生NO2和NO的機會相近,在溶液中能達到以下平衡:
3NO2+H2O?葑2HNO3+NO+138.1千焦
結合上述實驗二,當濃硝酸跟銅反應時,最初可能生成一氧化氮,但由于硝酸濃度較大,使平衡強烈地向左移動,所以主要產物為二氧化氮;當稀硝酸與銅反應時,由于硝酸濃度小,平衡向右移動,主要產物是一氧化氮。
大量事實證明,在金屬活動性順序中,位于氫后的金屬銅、汞、銀等,跟濃硝酸反應時,主要得到二氧化氮;跟稀硝酸反應時,主要得到一氧化氮。所以說,當硝酸與銅、汞、銀等金屬反應時,濃硝酸比稀硝酸的氧化性強。
2.不同濃度的硝酸與鎂、鋅等金屬的反應
實驗三:在兩支放有鋅片的試管里分別加入濃度為30%的稀硝酸和5%的稀硝酸。
觀察現象:前者有氣體產生,后者沒有。兩者反應的方程式分別為:
這就說明:當活潑金屬鋅、鎂等跟稀硝酸反應時,硝酸濃度HNO3不同,還原產物不同;前者有氣體(NO2)產生,而后者則有銨鹽生成。
鐵與稀硝酸的反應與上述情況類似。上圖示鐵與不同濃度HNO3反應時的還原產物,從上圖中可以看出,當其他條件一致時,如溫度、還原劑一致時,在濃硝酸(密度為1.35)中,主要產物是NO2,隨著HNO3濃度逐漸下降,產物NO2逐漸減少,而一氧化氮的相對含量逐漸增多。當密度是1.30時,主要產物是NO,其次是NO2及少量N2O;當密度是1.15時,NO與NH3的相對含量幾乎相當;HNO3的密度為1.05時,NH3成為主要的產物。
實驗四:在放有上述金屬片的試管中分別加入濃度為80%的濃硝酸。
觀察結果:無現象發生。
這說明Fe、CO、Ni、Al等金屬遇到濃硝酸會產生鈍化現象。是因為在常溫下,濃硝酸跟這些金屬接觸,能夠使金屬表面生成一薄層致密的氧化物保護膜阻止內部金屬繼續跟硝酸反應。
Sn、Sb、W、V等金屬跟濃硝酸作用,生成金屬氧化物,而不是硝酸鹽。因為這些金屬氧化物不溶于硝酸反應不再繼續發生,Au、Pt、Ir、Rb等金屬跟濃、稀硝酸都不反應,因為它們特別的穩定,不易被氧化。
王水的組成和它的氧化性:濃硝酸和濃鹽酸的混合物(物質的量之比為1:3)叫做王水,二者的反應為:
所以,王水中含有硝酸、氯氣和氯化亞硝酰等一系列強氧化劑,同時,還有高濃度的氯離子。王水的氧化能力比硝酸強,一些不溶于硝酸的金屬,如,鉑、金都可以被王水溶解。反應的化學方程式如下:
金和鉑不溶于單獨的濃硝酸,而溶于王水,這是因為高濃度的氯離子與金屬離子形成穩定的絡離子,從而使金或鉑的標準電位減少,有利于反應向金屬溶解的方向進行。
由以上可以看出,凡有硝酸參與的反應都很復雜,往往同時生成多種還原產物,硝酸除了氧化性外,還有一種硝化性。
三、硝酸與非金屬反應
濃硝酸不僅能與金屬反應,而且還能與許多非金屬反應。
實驗五:把一塊紅熱的木炭浸入發熱的發煙硝酸里,實驗裝置見圖B。
觀察現象:木炭燃燒得更加劇烈,同時放出紅棕色的二氧化氮(NO2)氣體。反應的化學方程式如下:
該實驗說明,硝酸還可以氧化非金屬。
四、濃硝酸與酸堿指示劑的反應
實驗六:在分別盛有少量濃、稀硝酸的試管里,分別滴入幾滴紫色石蕊試液并加熱。
觀察現象:前者溶液先變成紅色,過一會紅色消失。后者溶液變成紅色,但不消失。
這是由于濃硝酸具有強氧化劑,而使紅色退去。反應出濃硝酸比稀硝酸氧化性強。
五、濃硝酸與濃硫酸、濃鹽酸氧化性比較
實驗七:在放有銅片的兩支試管里分別加入少量的濃硫酸和濃鹽酸。
觀察現象:無現象。分別加熱時,前者有刺激性氣味的氣體產生,將氣體通入品紅試液中,品紅試液褪色;而后者無現象。
前者反應的化學方程式為:
在實驗二中我們看到,濃硝酸在常溫下就能與銅反應,而濃硫酸只有在加熱的條件下才能與銅發生反應。這充分說明:濃硝酸的氧化性比濃硫酸、濃鹽酸都強。
大量的實驗和理論分析說明:硝酸是一種強氧化性酸,不僅具備了酸的通性,而且氧化性隨其濃度的增加而增強。濃硝酸比濃硫酸、濃鹽酸的氧化性都強。
編輯 薛直艷

