鴨坦布蘇病毒囊膜蛋白抗原表位的串聯表達與抗原性分析
韓凱凱, 李 銀, 黃欣梅, 趙冬敏, 劉宇卓, 謝星星, 安鳳嬌
(江蘇省農業科學院獸醫研究所,農業部獸用生物制品工程技術重點實驗室,國家獸用生物制品工程技術研究中心,江蘇 南京210014)
2010 年春季以來,上海、浙江、江蘇等地相繼爆發一種導致鴨、鵝產蛋急劇下降的新發疾病。發病鴨、鵝主要表現為高熱、運動障礙、食欲下降、產蛋下降甚至停止,死亡率可達5 % ~10%[1];該病典型的病理變化表現為卵巢出血、萎縮、破裂,患病后期出現神經癥狀,倒地震顫,最終衰竭死亡;該病傳播迅速、波及面廣,幾乎席卷了整個水禽養殖密集地區,給中國鴨鵝養殖業造成了巨大損失[2]。目前已經證明引起該病的病原為坦布蘇病毒(Tembusu virus,TMUV)[3]。
坦布蘇病毒屬于黃病毒科(Flaviviridae)不分節段的單股正鏈RNA 病毒,含有單一的開放讀碼框,編碼結構蛋白(C、prM 和E)和非結構蛋白(NS1、NS2A、NS2B、NS3、NS4A、NS4B 和NS5)。其中,E 蛋白是坦布蘇病毒的囊膜蛋白,由500 個氨基酸組成,它在病毒的吸附、融合、細胞趨向性、病毒毒力和誘導保護性免疫反應中起重要作用[4]。在黃病毒屬病毒E 蛋白研究中,發現其攜帶有可以產生中和抗體的B 細胞表位,當中和抗體與E 蛋白結合后就可以阻斷病毒與細胞上相應受體的結合,或者阻止病毒與細胞膜發生融合。Li 等[5]構建了含有日本腦炎病毒E 基因T、B 細胞表位的多表位基因,利用Balb/c 小鼠評價構建的DNA 疫苗和重組蛋白疫苗的免疫效力,結果顯示,所構建的DNA 疫苗和重組蛋白質疫苗都能誘導產生針對日本腦炎病毒的特異性體液免疫和細胞免疫應答。Wei 等[6]運用生物信息學技術從日本腦炎病毒E 蛋白序列中選取6 個B細胞表位和2 個T 細胞表位,串聯入原核表達載體中,所表達的蛋白免疫小鼠后,能夠誘導機體產生極高水平的中和抗體。
本研究通過生物信息學技術,對鴨坦布蘇病毒E 蛋白序列進行分析,篩選6 段B 細胞表位和2 段T 細胞表位,將以上8 條多肽進行拼接,人工合成串聯表位基因并進行表達及抗原性分析,為建立鴨坦布蘇病血清學診斷方法及制備高效合成肽疫苗奠定基礎。
1 材料與方法
1.1 試驗材料
坦布蘇病毒分離株(JS804)由作者實驗室分離保存;E. coli DH5α、E. coli BL21(DE3)菌株由作者實驗室保存;pMD18-T 載體購自大連寶生物有限公司,原核表達載體pET-32a(+)由本實驗室保存;坦布蘇病毒陽性血清、陰性血清均由作者實驗室制備。
1.2 主要試劑
限制性內切酶、Ex Taq 酶、T4 DNA Ligase、蛋白質相對分子質量標準等購自大連寶生物工程有限公司;DAB 底物顯色試劑盒購自武漢博士德生物技術有限公司;辣根過氧化物酶(HRP)標記山羊抗兔IgG 購自北京中杉金橋生物技術有限公司;質粒小量提取試劑盒、PCR 產物純化試劑盒購自Axygen 生物科技有限公司;其余試劑均為國產分析純。基因序列合成、引物合成和測序由南京金斯瑞生物科技有限公司完成。
1.3 方法
1.3.1 鴨坦布蘇病毒E 蛋白抗原表位的篩選 以鴨坦布蘇病毒囊膜蛋白(Envelope,E)基因序列為基礎,采用生物信息學技術,Chou-Fasman 法、Garnier-Robson 法和Karplus-Schulz 法預測蛋白質的二級結構;按Kyte-Doolittle 方案、Emini 方案和Jameson-Wolf 方案綜合考慮二級結構、親水性、抗原指數等因素,篩選出6 段B 細胞表位與2 段T 細胞表位。
1.3.2 多表位串聯基因的構建與人工合成 以篩選出的6 段B 細胞表位多肽氨基酸序列與2 段T 細胞表位多肽氨基酸序列為依據,在兩個不同表位間分別引入柔性氨基酸Gly-Ser(甘氨酸-絲氨酸)作為柔性肽,串聯構成一個連續的閱讀框,基因密碼子的選擇兼顧大腸桿菌的偏愛性,將稀有氨基酸密碼子進行替換,并在DNA 序列的兩端加上EcoR I 和Sal I酶切位點,DNA 全長由南京金斯瑞生物科技有限公司合成,新基因命名為TEM,其DNA 序列所編碼的氨基酸序列見表1。將TEM 連接至pMD18-T中,命名為pMD18-T-TEM。
1.3.3 重組表達載體的構建 用EcoR I 和Sal I分別對pMD18-T-TEM、pET32a 質粒進行雙酶切,分別回收載體片段與目的基因片段,用T4 DNA 連接酶將目的基因片段連接到原核表達載體pET32a上,然后轉化至DH5α 感受態細胞中,構建pET32a-TEM,將酶切鑒定正確的重組質粒送南京金斯瑞生物科技有限公司測序。
1.3.4 串聯基因的表達及產物的純化 將測序正確的pET32a-TEM/DH5a 菌液提取質粒,轉入E.coli BL21(DE3)感受態細胞,取150 μl 涂布于含Amp(100 μg/ml)的LB 瓊脂平板中,37 ℃培養過夜,挑取單個菌落于含Amp 的LB 液體培養基中振蕩培養過夜。然后按1∶ 100 比例擴大振蕩培養,待OD 值達到0.6 左右時,加入IPTG 至終濃度為0.8 mmol/L,37 ℃振蕩培養5 h,SDS-PAGE 電泳檢測表達產物。反復凍融表達菌體3 次,超聲波破碎菌體,對破碎后的菌液4 ℃10 000 r/min 離心20 min,分離裂解液的上清液和沉淀,SDS-PAGE 電泳分析重組蛋白的表達形式。采用洗滌包涵體的方法在變性條件下去除雜蛋白,將變性的純蛋白在不同尿素濃度下透析逐步復性。經SDS-PAGE 電泳檢測純化重組蛋白,最后用核酸蛋白儀測定純化的重組蛋白濃度。
1.3.5 原核表達產物的Western blot 分析 重組蛋白經SDS-PAGE 電泳后,于半干式轉移電泳儀以恒壓1 V/cm2轉移60 min,取出硝酸纖維素膜,TBST漂洗,5%脫脂牛奶封閉1 h 后,TBST 漂洗,加入兔抗坦布蘇病毒陽性血清,孵育1 h,TBST 漂洗,再加入HRP 標記的羊抗兔IgG,TBST 漂洗,將NC 膜放入HRP-DAB 顯色液中,出現條帶后立即用雙蒸水終止顯色,觀察結果。
1.3.6 動物免疫 6 周齡雌性BALB/c 小鼠分為3組,每組10 只,第1 組和第2 組分別免疫pET32a-TEM、pET32a 原核表達的蛋白(每只100 μg),蛋白首先與等量弗氏完全佐劑混合并乳化,通過皮下多點注射法初次免疫,14 d 后用弗氏不完全佐劑乳化抗原進行二次免疫,二次免疫14 d 后進行三次免疫,抗原乳化方法、抗原劑量同上,每次免疫前需要采血,第3 組皮下注射100 μl PBS 作為對照。三次免疫10 d 后眼球采血,分離血清,獲得陽性血清。ELISA 方法檢測各組小鼠的血清效價。
2 結果
2.1 鴨坦布蘇病毒E 蛋白抗原表位的篩選
應用DNAStar 軟件對鴨坦布蘇病毒囊膜蛋白(Envelope,E)基因進行分析。理論上應該選取親水性大于0,抗原性大于0,表面可及性大于1 的序列。同時根據預測結果,對該基因的二級結構、親水性、抗原性、表面可及性等因素進行綜合分析,篩選出6 段B 細胞表位與2 段T 細胞表位(表1)。
2.2 坦布蘇病毒多表位串聯基因TEM 的構建與人工合成
將篩選好的坦布蘇病毒多表位基因用柔性氨基酸的核苷酸序列串聯得到多表位基因TEM,由南京金斯瑞生物科技有限公司合成。
表1 TEM 的氨基酸序列Table 1 The amino acids sequences of TEM
2.3 pET32a-TEM 重組質粒的構建
用EcoR I 和Sal I 分別對pMD18-T-TEM、pET32a 質粒進行雙酶切,構建重組表達質粒pET32a-TEM。為確認該片段插入質粒,對重組質粒進行了雙酶切鑒定。結果如圖1 所示,獲得約5 900 bp 和500 bp 的兩條片段,分別與pET32a 和TEM 的基因片段大小相符,表明重組質粒的構建獲得成功。
圖1 重組質粒pET32a-TEM 的酶切鑒定Fig.1 Identification of recombinant plasmid by enzyme digestion
2.4 TEM 基因片段的原核表達純化及可溶性鑒定
將重組質粒pET32a-TEM 轉化入大腸桿菌BL21 中,經IPTG 誘導培養后,對表達蛋白進行了電泳鑒定和表達形式的檢測。在SDS-PAGE 圖譜中,與未誘導的空質粒所表達蛋白帶比較,經誘導的重組質粒表達產物約為38 000。可溶性分析結果顯示,融合蛋白以包涵體的形式存在,通過鎳柱純化,得到較為純凈的蛋白(圖2)。

圖2 融合蛋白特性分析Fig.2 Characteristics of recombinant protein
2.5 Western blotting 分析
為確定融合蛋白中TEM 多肽的免疫原性,用純化的坦布蘇病毒抗原免疫小鼠,并用免疫印跡檢測在免疫小鼠血清中是否存在相應抗體。結果表明,免疫小鼠血清中有與融合蛋白結合的抗體,而空載體誘導對照無此特異性反應帶(圖3)。

圖3 融合蛋白Western blotting 檢測結果Fig.3 Identification of the prokaryoticly expressed protein by Western blotting
2.6 抗體檢測
免疫前后各組特異性IgG 消長情況如圖4 所示,免疫前,三個組特異性IgG 抗體水平相近;首次免疫后,pET32a-TEM 重組蛋白免疫組小鼠的特異性抗體IgG 開始升高,在首次免疫后14 d,重組蛋白免疫組特異性抗體IgG OD 值極顯著地高于PBS 對照組(P <0.01);在試驗的28 d,免疫組特異性抗體IgG OD 值達到峰值;三次免疫后,重組蛋白免疫組特異性抗體IgG OD 值有所下降,但仍顯著高于空載體蛋白組和PBS 對照組。重組蛋白免疫組血清特異性抗體IgG 水平從首免后14 d 一直到試驗結束均顯著地高于空載體蛋白組和PBS 對照組(P <0.05)。
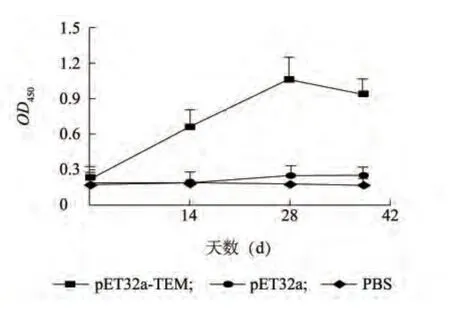
圖4 免疫鼠特異性抗體IgG 消長情況Fig.4 The growth and decline of specific antibody IgG in immuned mouse
3 討論
抗原表位是抗原分子中免疫細胞識別、與免疫細胞表面抗原受體結合、誘導特異性免疫應答的最基本結構和功能單位,每一種表位決定一種抗原特異性。與傳統的保護性抗原單獨表達相比,串聯表達技術有其自身的優點和特殊性,將抗原表位進行串聯既純化了抗原性,又減少了無關干擾序列的影響。目前,表位串聯這種手段已經廣泛應用于診斷抗原、免疫原的制備[7-8]。將串聯技術與基因合成及融合表達技術結合起來,在目的分子中加入一些柔性氨基酸作為連接肽,還可以改良蛋白質性質,最大限度地保證各表位原有的天然構象,不因融合串聯而影響其功能。通常用的連接肽為Gly-Ser(即表達甘氨酸和絲氨酸的序列),因為這兩個氨基酸最簡單,對目的蛋白影響最小,甘氨酸是分子質量最小、側鏈最短的氨基酸,不會形成空間位阻,可增加側鏈的柔性;絲氨酸是親水性最強的氨基酸,可增加串聯肽段的親水性。在先前研究中,Kulkarni 等[9]通過生物信息學技術構建了日本腦炎病毒E 基因和NS1基因的多表位疫苗,體外免疫Balb/c 小鼠能夠產生特異性中和抗體,同時發現通過調整、優化其空間構象,能獲得更高的免疫保護力。劉志國等[10]在西尼羅病毒表位疫苗研究中發現構建的西尼羅病毒多表位基因重組質粒DNA 免疫小鼠后,能夠在小鼠體內誘導產生保護性中和抗體,效價達到1∶ 50,并可顯著提高細胞免疫水平。
坦布蘇病毒是在我國首次發現的對水禽致病的新型黃病毒,傳播迅速、對鴨鵝危害大,已給中國水禽業造成巨大的經濟損失,由于坦布蘇病毒在中國爆發時間短,所以在該病毒的致病機理、跨物種傳播機制及疫苗研制方面還存在很多迫切需要解決的難題。E 蛋白是黃病毒的囊膜蛋白,也是主要的結構蛋白,同時研究結果表明,E 蛋白是體外中和作用的主要靶點和病毒特異性抗體的作用位點,具有中和活性,能夠刺激機體產生抗體引發特異性免疫。在本研究中,首先通過生物信息學軟件分析預測,篩選出坦布蘇病毒E 蛋白可能的抗原表位,為使重組后的8 個表位蛋白不會形成空間位阻,且都能保持各自的活性,在每個表位后面引入1 個Gly-Ser 連接肽,能使目的蛋白具有較好的穩定性與生物活性。送生物試劑公司合成后,選用pET32a 作為原核表達載體,在大腸桿菌中成功表達了坦布蘇病毒E 蛋白主要抗原表位基因融合蛋白,通過融合蛋白與抗坦布蘇病毒陽性血清進行Western blotting 檢測,結果表明人工合成的TEM 蛋白可以被坦布蘇病毒多克隆抗體識別,具有良好的抗原性,采用融合蛋白免疫小鼠后的免疫原性檢測結果也證明了這一點。本試驗證明所合成的串聯多肽TEM 是一個良好的坦布蘇病毒抗原,這個結果為研究更加簡單有效的坦布蘇病毒亞單位疫苗提供了依據。
[1] YUN T,YE W,ZHANG N,et al. Identification and molecular characterization of a novel flavivirus isolated from Pekin ducklings in China[J]. Vet Microbiol,2012,157:311-319.
[2] HUANG X,HAN K,ZHAO D,et al. Identification and molecular characterization of a novel flavivirus isolated from geese in China[J]. Research in Veterinary Science,2013,94:774-780.
[3] YAN P,ZHAO Y,ZHANG X,et al. An infectious disease of ducks caused by a newly emerged Tembusu virus strain in mainland China[J].Virology,2011,417 (1):1-8.
[4] 朱麗萍,顏世敢.鴨坦布蘇病毒研究進展[J]. 中國預防獸醫學報,2012,34(1):79-82.
[5] LI P,CAO R B,ZHENG Q S,et al. Enhancement of humoral and cellular immunity in mice against Japanese encephalitis virus using a DNA prime-protein boost vaccine strategy [J]. Vet J,2010,183 (2):210-216.
[6] WEI J C,HUANG Y Z,ZHONG D K,et al. Design and evaluation of a multi-epitope peptide against Japanese encephalitis virus infection in BALB/c mice[J]. Biochem Bioph Res Co,2010,396 (4):787-792.
[7] 賈 瑩,李 巖,尹 鑫,等. 牛病毒性腹瀉病病毒NS3 表位串聯蛋白表達及抗體間接ELISA 方法的建立[J].畜牧獸醫學報,2011,42 (8):1120-1125.
[8] 魯 丹. 禽傳染性支氣管炎多基因串聯表位抗原的構建表達與ELISA 方法初探[D]. 雅安:四川農業大學,2010.
[9] KULKARNI R,SAPKAL G,MAHISHI L,et al. Design and characterization of polytope construct with multiple B and T(H)Epitopes of Japanese encephalitis virus[J]. Virus Res,2012,166(1-2):77-86.
[10] 劉志國,朱曉光,劉伯華,等. 西尼羅病毒多表位基因免疫保護研究[J]. 中國人獸共患病學報,2008,24 (4):285-289.

