趨化因子CXCL10啟動子區-201G/A多態性與慢性乙型肝炎易感相關性研究
李曉陽,張 強,易顯富,袁 情,唐文娟
(1.長沙泰和醫院檢驗科,湖南 長沙 410000;2.中南大學湘雅三醫院呼吸科,湖南 長沙 410000;3.湖北醫藥學院附屬太和醫院急診科,湖北 十堰 442000;4.廣州中醫藥大學第一附屬醫院檢驗科,廣東 廣州 510405;5十堰市婦幼保健院婦女保健科,湖北 十堰 442000)
趨化因子CXCL10啟動子區-201G/A多態性與慢性乙型肝炎易感相關性研究
李曉陽1,張 強2,易顯富3,袁 情4,唐文娟5
(1.長沙泰和醫院檢驗科,湖南 長沙 410000;2.中南大學湘雅三醫院呼吸科,湖南 長沙 410000;3.湖北醫藥學院附屬太和醫院急診科,湖北 十堰 442000;4.廣州中醫藥大學第一附屬醫院檢驗科,廣東 廣州 510405;5十堰市婦幼保健院婦女保健科,湖北 十堰 442000)
目的 研究趨化因子CXCL10啟動子區-201G/A位點單核苷酸多態性(SNP)與漢族人群慢性乙型肝炎(CHB)的易感相關性。方法采用聚合酶鏈反應-限制性片段長度多態性(PCR-RFLP)方法對142例慢性乙型肝炎患者(CHB組)和150名健康者(HC組)的CXCL10啟動子區-201G/A SNP進行基因分型,以血清丙氨酸氨基轉氨酶(ALT)、天冬氨酸氨基轉移酶(AST)、總膽紅素(T-Bil)、γ-谷氨酰轉肽酶(GGT)、白蛋白(ALB)、乙型肝炎E抗原(HBeAg)、乙型肝炎病毒(HBV-DNA)及其病毒載量、乙肝病毒大蛋白(HBV-LP)、乙型肝炎病毒前s1抗原(HBV-PreS1)作為檢測指標。結果與HC組比較,CHB組的CXCL10-201位點GA&AA基因型及A等位基因分布頻率顯著增加,組間差異具有統計學意義(P<0.05),且等位基因A可增加CHB易感風險(OR=1.940,OR95%CI:1.139~3.305)。CXCL10-201G/A多態性與ALT、AST、HBeAg、HBV-DNA、HBV-LP、HBV-PreS1陽性率無相關性(P>0.05);CHB組病毒載量在105~106取值范圍時,等位基因A與G分布頻率差異具有統計學意義(χ2=3.958,P=0.047)。結論CXCL10啟動子區-201G/A位點多態性與CHB患病風險有關聯,且等位基因A可能是HBV易感基因。
CXCL10;-201G/A;多態性;慢性乙型肝炎;易感性
慢性乙型肝炎(Chronic hepatitis B,CHB)是由乙型肝炎病毒(Hepatitis B virus,HBV)感染引起,遺傳、機體免疫和環境綜合作用導致的慢性傳染性疾病。趨化因子γ干擾素誘導蛋白10(CXCL10/IP-10)是趨化性細胞因子,可介導乙型肝炎過程中病毒清除與炎癥反應,在CHB的發生、發展和HBV感染相關肝臟疾病進程中起著重要作用[1-2]。CXCL10亦可強化肝細胞表面選擇素和整合素的表達,與細胞穿透血管定向遷移到炎癥部位以致肝細胞損傷密切相關[3-4]。研究表明趨化因子CXCL10基因存在多個SNP位點,包括rs56061981、rsl2979860、rsl2980275、rs8099917和rs1439490等,從而在功能上可改變核蛋白的親和力,影響CXCL10轉錄水平和表達[4-5],進而改變個體對HBV的易感性及CHB進程,且有研究發現CXCL10啟動子區-201G/A多態性與病毒性肝炎等免疫性疾病可能存在關聯性[6-7]。本研究通過比較CXCL10啟動子區-201G/A基因型及其等位基因在正常人、CHB患者中的分布頻率差異,探討CXCL10-201G/A多態性與CHB易感相關性。
1 資料與方法
1.1 一般資料 142例漢族病例組成員均為2010年5月至2012年11月門診與住院的CHB患者(CHB組),均符合《2010年慢性乙型肝炎防治指南》診斷標準。病例入選標準:①年齡20~70歲;②HbsAg陽性至少在6個月以上;③血清谷丙轉氨酶反復升高;④均接受過肝組織活檢,且病理性檢測均符合CHB。同時排除下列情況:前6個月接受過系統的抗病毒藥物治療;失代償期肝病重疊其他感染性疾病、酒精性肝病、脂肪肝和藥物性肝病等;合并精神病、自身免疫性肝炎、糖尿病、甲狀腺功能亢進、溶血性貧血;妊娠哺乳婦女或進行過器官移植;家族有精神病史,酗酒吸毒史。另選150例體檢正常的志愿者(漢族)為健康對照組(HC組),無心腦血管病史和肝腎血液病自身免疫性疾病,經檢測排除感染性疾病。本研究經醫院倫理學委員會批準,患者簽署知情同意書。
1.2 方法
1.2.1 標本采集 清晨空腹真空采集HBV感染者肘靜脈血3管(K2EDTA抗凝管),每管2 ml,其中一管在4℃保存,并在室溫下4 h內完成肝功能檢測。第2管在4 h內離心(3 000 r/m,5 min),分離并分裝血漿凍于-70℃低溫冰箱,以備檢測血漿HBV-DNA用;第3管用于分離提取外周血淋巴細胞以備提取基因組DNA。同時由專人用統一調查表記錄一般的人口學和流行病學資料。
1.2.2 患者基因組DNA提取 參照已建立的方法[8]。取EDTA-K2抗凝的全血200 μl與濃度6 mol/L碘化鈉(NaI)1:1混勻,加氯仿/異戊醇(24:1)400 μl,混勻,在15 000 r/min條件下離心15 min,吸取上清液400 μl,加入240 μl純異丙醇混勻,室溫靜置15 min,再在15 000 r/min條件下離心1 min,小心棄去上清液,沉淀物用70%乙醇洗滌3次,室溫干燥,加TE (Tris/EDTA)緩沖液50 μl溶解DNA,-20℃備用。
1.2.3 TNF-α啟動子區-863C/A基因型檢測①引物設計參照文獻[6],由生工生物工程(上海)有限公司合成。上游引物:5'-GCA GAT ACT GTC TCA GAA CCT GGT A-3';下游引物:5'-TGT CAC CAT CTC TCA TTT TGA TTG T-3'。②PCR擴增及瓊脂糖凝膠電泳:PCR反應總體系為25 μl,擴增循環參數:94℃先預變性5 min,然后按94℃40 s、58℃40 s和72℃90 s,共40個循環,最后72℃延長到5 min。PCR結束后再取10 μl進行2%瓊脂糖凝膠電泳(5 V/cm,電泳40 min),在紫外燈下觀察PC R擴增效率。③PCR產物鑒定分型-酶切+瓊脂糖凝膠電泳:酶切產物與10×loading buffer(3 μl)混勻,于瓊脂糖凝膠(3%)中電泳鑒定。以D2000作為DNA標記物,在1×TAE buffer中電泳30 min(恒壓140 V)。在紫外線下觀察和照相并記錄。④選取部分標本的PCR產物送上海英俊生物技術有限公司,使用ABI 3730測序儀測序,得到測序圖,以驗證PCR-FLP的結果。
1.2.4 觀察指標及檢測方法 肝功能指標定量檢測采用日立全自動生化分析儀及其配套試劑檢測,具體步驟嚴格按試劑盒說明書操作。陽性標準: ALT>40 U/L;AST>40 U/L。HbeAg檢測采用化學發光定量法,在美國Abbott公司ARCHITECT i2000SR全自動分析儀上進行,采用儀器配套試劑,按照Abbott化學發光免疫分析儀標準操作規程進行檢測,陽性標準:HbeAg>1.0 S/CO。HBV-DNA定量采用ABI 7500基因擴增儀、以實時熒光定量PCR法檢測(試劑由上海科華生物技術公司提供),PCR反應條件及步驟按試劑說明書要求設置操作,應用ABI 7500配套軟件分析HBV DNA載量。HBV DNA陰轉標準:<103copies/ml。HBV-LP、Pre-S1抗原采用ELISA雙抗體夾心法檢測,嚴格按照試劑盒操作說明書進行操作,選擇波長450 nm,通過酶標儀測定吸光度(A)值,按要求設定Cutoff值,測定結果大于Cutoff值為陽性。
1.3 統計學方法 采用SPSS17.0軟件包進行統計學分析,計量資料以均數±標準差(x-±s)表示,組間比較采用t檢驗,相關分析采用Spearman秩相關檢驗;計數資料采用χ2檢驗,以哈迪溫伯格(Hardy-Weinberg)遺傳平衡定律檢驗確認研究樣本的群體代表性,以OR及其OR95%CI表示患病風險;檢驗水準α= 0.05,雙側,以P<0.05為差異有統計學意義。
2 結 果
2.1 CXCL10-201G/A位點基因型和等位基因頻率分布 CHB組和HC組比較,性別、年齡、家族史、酗酒史和吸煙史等差異亦無統計學意義(P>0.05),且T-Bil、GGT和ALB差異亦無統計學意義(P>0.05),提示兩組均衡可比。但ALT和AST組間差異有統計學意義(P<0.01),見表1。經哈迪-溫伯格遺傳平衡定律檢驗,趨化因子CXCL10啟動子區-201G/A位點的基因型均符合分布(P>0.05),提示研究人群具有良好群體代表性(見表2)。-201G/A位點共有3種基因型,分別是GG、GA和AA,且以GG和GA多見(在CHB和HC組中分別占97.2%和99.3%)。CHB組與HC組基因型(GA+AA):GG比值分別約為1:2.84和1:5.52,差異具有統計學意義(χ2= 5.138,P=0.023),等位基因A:G比值分別約為1:5.88和1:11.50,差異具有統計學意義(χ2=6.111,P=0.013)。HC組與CHB組比較,GA&AA基因型與CHB存在統計學關聯(OR=1.946,OR95%CI為1.088~3.479),等位基因A可能是CHB的危險因素(OR=1.940,OR95%CI為1.139~3.305)。
表1 兩組人口基本情況及相關指標基線水平的比較(±s)
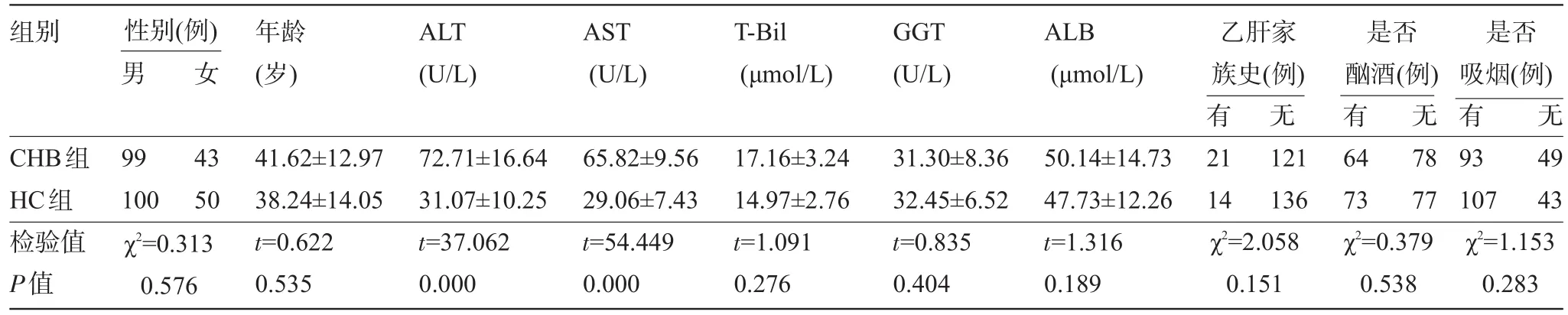
表1 兩組人口基本情況及相關指標基線水平的比較(±s)
注:丙氨酸氨基轉氨酶(ALT),天冬氨酸氨基轉移酶(AST),總膽紅素(T-Bil)、γ-谷氨酰轉肽酶(GGT),白蛋白(ALB)。
組別 性別(例)男女年齡(歲) ALT (U/L) AST (U/L) T-Bil (μmol/L) GGT (U/L) ALB (μmol/L)乙肝家族史(例)是否酗酒(例)是否吸煙(例)有無無有 無CHB組HC組檢驗值P值99 100 43 50 χ2=0.313 0.576 41.62±12.97 38.24±14.05t=0.622 0.535 72.71±16.64 31.07±10.25t=37.062 0.000 65.82±9.56 29.06±7.43t=54.449 0.000 17.16±3.24 14.97±2.76t=1.091 0.276 31.30±8.36 32.45±6.52t=0.835 0.404 50.14±14.73 47.73±12.26t=1.316 0.189有21 14 49 43 χ2=2.058 0.151 121 136 64 73 78 77 93 107 χ2=0.379 0.538 χ2=1.153 0.283
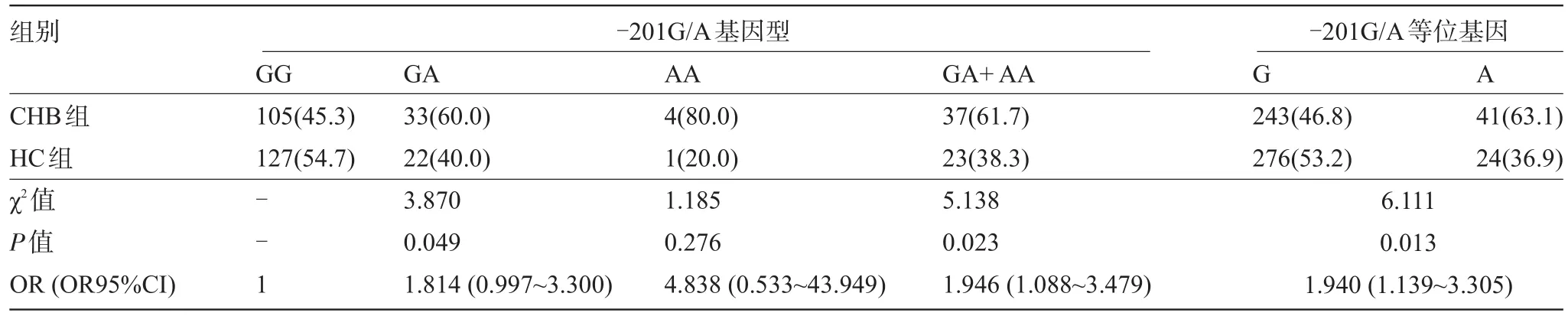
表2 趨化因子CXCL10啟動子區-201G/A基因型分布頻率的比較[例(%)]
2.2 CXCL10-201G/A多態性與AST、ALT、HbeAg的相關性 -201G/A的等位基因A與G相比,ALT和AST的陽性率差異均無統計學意義(P>0.05),見表3,OR及OR95%CI為1.174(0.604~2.281)和1.268(0.653~2.461),提示A等位基因可能與CHB患者ALT和AST陽性表達不相關;CHB組攜帶等位基因G和A的HbeAg陽性率分別為68.7%和80.5%,差異無統計學意義(P>0.05),提示等位基因A可能不是HbeAg陽性表達的危險因素(OR=1.877,OR95%CI:0.828~4.256)。
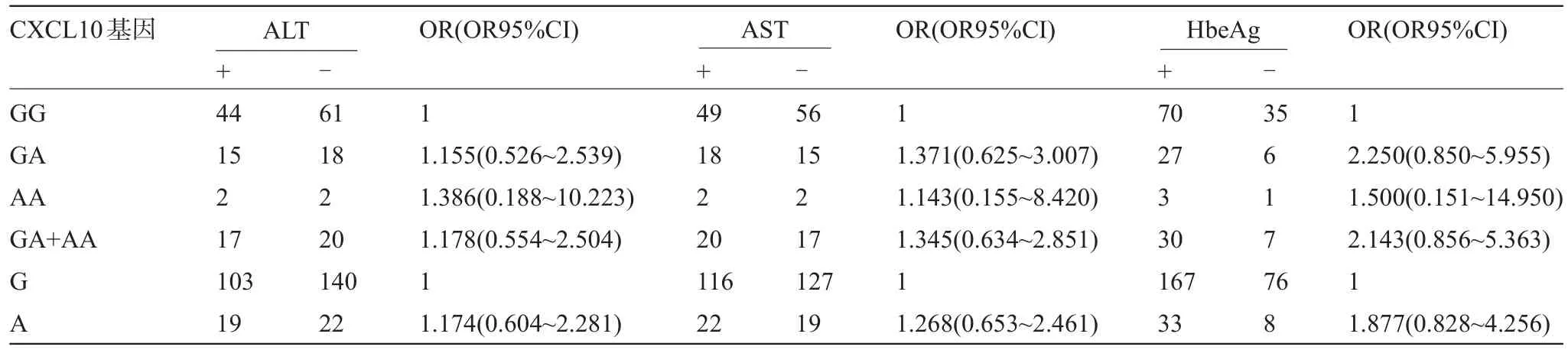
表3 多態性與AST、ALT、HbeAg的相關性
2.3 CXCL10-201G/A多態性與HBV-DNA、HBV-LP、HBV-PreS1的相關性 -201G/A的等位基因A與G相比,HBV-LP、HBV-PreS1及HBV-DNA的表達降低,但差異無統計學意義(P<0.05),見表4。同時等位基因A與HBV-LP、HBV-PreS1的表達不相關(OR95%CI分別為0.489~1.974、0.485~1.829和0.575~2.447),表明等位基因A可能不會是CHB的保護因素。-201G/A位點等位基因與HBV-DNA病毒載量相關性分析結果顯示:HBV-DNA病毒載量在105~106范圍時,等位基因A與等位基因G差異具有顯著統計學意義(P= 0.047),見表5,表明等位基因A可能與HBV-DNA病毒載量相關,提示等位基因A可能是CHB的危險因素。
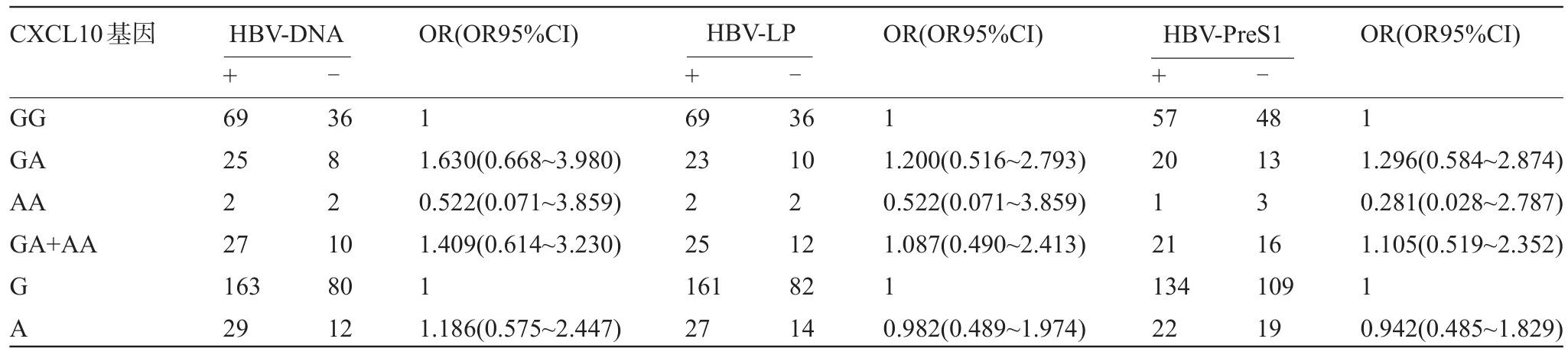
表4 CXCL10-201G/A多態性與HBV-DNA、HBV-LP、HBV-PreS1的相關性
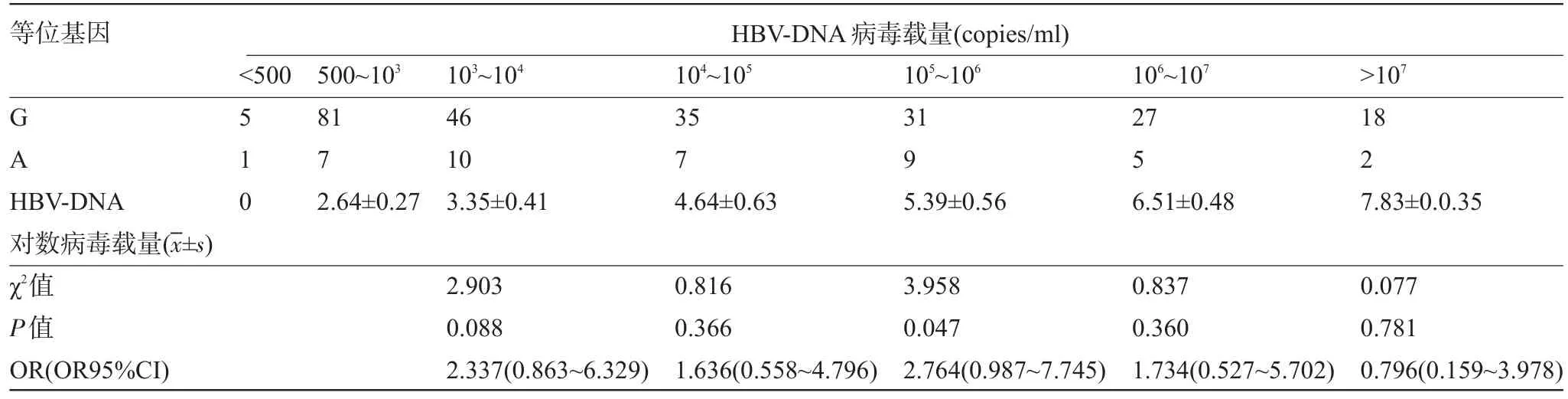
表5 CXCL10-201G/A等位基因與HBV-DNA病毒載量的相關性
3 討論
HBV感染可誘導已感染的肝細胞和血管內皮細胞內高表達趨化性CXCL10,CXCL10過度聚集可導致已表達CXCR3的T細胞遷移到受感染的肝細胞,因此CXCL10在病毒性肝炎的發展和轉歸及肝臟的免疫損傷中起重要作用[9-10]。有研究證實呈CXCL10的高表達和相應的受體相互作用可趨化白細胞向炎癥和感染部位遷移,影響正常生理條件下淋巴細胞的歸巢,也拮抗病理狀態下炎癥部位對淋巴細胞的募集[11]。位于CXCL10啟動子區域的201位點被認為具有SNP,γ干擾素刺激外周血單個核細胞時,擁有AA和GA基因型的患者更易發生CXCL10高轉錄[6,9]。有研究發現CXCL10啟動子區-201G/A位點SNP與CHB易感性有相關性,且-201G/A位點SNP可改變機體對HBV的易感性及疾病進展過程[6,9-10]。本研究結果顯示我國漢族人群趨化因子CXCL10啟動子區201位點基因型以(GG+GA)為主,等位基因頻率G>A,與相關研究結果報道一致[6,9]。同時,本研究證實-201G/A位點SNP與CHB易感性關聯,A等位基因與HBV感染的慢性化相關。
CHB患者的血清和肝組織中CXCL10水平均增高,且與血清HbeAg、ALT水平等相關[12]。血清AST/ ALT比值可判斷肝病的嚴重程度和預后[13]。本研究結果顯示:CHB組ALT和AST陽性率在各基因型及等位基因間差異均無統計學意義(P>0.05),雖未發現等位基因A能提高CHB患者ALT和AST的陽性率,但由于ALT和AST的升高與病情程度有一定的關系,在輕度肝炎時仍有患者的ALT和AST在正常范圍[14],因此不能排除CXCL10啟動子區-201G/A位點與CHB易感性有關聯。HbeAg可判定HBV復制程度及CHB患者預后[15]。但是HbeAg的轉陰并不能完全排除病毒的感染與復制的可能,本研究結果與此相符,等位基因A并不會使CHB患者HbeAg陽性率增加,且亦不能否認CXCL10啟動子區-201G/A位點與CHB的相關性。
HBV-DNA含量是判斷病毒復制活躍和具有傳染性最為直接可靠的依據,定量HBV-DNA可反映HBV基因水平的復制狀況[16]。有研究表明HBV-LP與HBV-PreS1可反映HBV蛋白水平的復制狀況[17-18]。HBV-LP與病毒復制、病毒顆粒組裝和從細胞內釋放調節密切相關。PerS1-Ag是HBV感染標志和復制依據,可體現病毒復制和病毒顆粒存在[17]。本研究結果顯示-201G/A位點與HBV-DNA、HBV-LP、HBV-PreS1陽性率的無相關性(P>0.05),且等位基因A可能不是CHB的保護因素。外周血HBV-DNA病毒載量水平提示病毒導致肝細胞損害、破壞,肝功能異常,肝纖維化進一步發展[19-20]。本研究結果顯示當HBV-DNA病毒載量在105~106時,等位基因A與等位基因G組間差異有統計學意義(P=0.047),攜帶有等位基因A的患病風險是攜帶有等位基因G的2.764倍,提示等位基因A可能與病毒HBV-DNA的復制相關,-201G/A多態性可能改變CHB患者體內病毒的復制狀況。
綜上所述,CXCL10啟動子區-201G/A多態性與CHB存在遺傳關聯,且等位基因A可能是易感基因,但本研究在設計研究方案及結果分析未充分考慮遺傳因素與環境因素之間的交互作用,且其作用機制尚不明確,今后仍需開展大樣本量和不同種族獨立的病例-對照研究和功能性研究去明確CXCL10啟動子變異體對基因表達以致CHB發展和轉歸的影響。
[1]Brownell J,Polyak SJ.Molecular pathways:hepatitis C virus,CXCL10,and the inflammatory road to liver cancer[J].Clin Cancer Res,2013,19(6):1347-1352.
[2]Heiberg IL,Winther TN,Paludan SR,et al.Pattern recognition receptor responses in children with chronic hepatitis B virus infection [J].J Clin Virol,2012,54(3):229-234.
[3]Huss RS,Huddleston JI,Goodman SB,et al.Synovial tissue-infiltrating natural killer cells in osteoarthritis and periprosthetic inflammation[J].Arthritis Rheum,2010,62(12):3799-3805.
[4]呂 娟.趨化因子IP-10及自然殺傷細胞在病毒性肝炎抗病毒治療過程中作用的研究[D].吉林:吉林大學,2013.
[5]楊廣德.趨化因子CXCL10單核苷酸多態性與HBV感染易感性的關聯研究[D].合肥:安徽醫科大學,2012.
[6]Deng G,Zhou G,Zhang R,et al.Regulatory polymorphisms in the promoter of CXCL10 gene and disease progression in male hepatitis B virus carriers[J].Gastroenterology,2008,134(3):716-726.
[7]Li JA,Chen ZB,Lv TG,et al.Genetic polymorphism of CCL2-2518, CXCL10-201,IL8+781 and susceptibility to severity of Enterovirus-71 infection in a Chinese population[J].Inflamm Res,2014,63 (7):549-556.
[8]胡春卉,陳 晉,楊 銳,等.MxA基因啟動子區-88G/T、-123C/A單核苷酸多態性與HCV易感性和IFN-α療效評價研究[J].細胞與分子免疫學雜志,2012,28(12):1307-1310.
[9]劉立明,許智慧,劉 妍,等.趨化因子CXCL10 G-201A單核苷酸多態性與HBV感染慢性化和重癥化關系的研究[J].解放軍醫學雜志,2011,36(1):39-41.
[10]劉立明,許智慧,劉 妍,等.限制性片段長度多態性分析法在CXCL10 G-201A位點變異檢測中的應用[J].傳染病信息,2011, 24(2):100-102.
[11]段鐘平,白 麗,翟 原,等.趨化因子CXCL10與肝病關系的研究進展[J].北京醫學,2010,32(3):227-230.
[12]何登明.慢性HBV感染不同臨床表型的免疫因子表達模式及免疫遺傳特征研究[D].重慶:第三軍醫大學,2013.
[13]Chanda D,Kim YH,Li T,et al.Hepatic cannabinoid receptor type 1 mediates alcohol-induced regulation of bile acid enzyme genes expression via CREBH[J].PLoS One,2013,8(7):e68845.
[14]林振忠,余雪平,蘇智軍,等.慢性乙型肝炎患者外周血Treg/Th17比率的檢測及其與肝功能的相關性研究[J].中國免疫學雜志, 2012,28(11):1036-1040.
[15]林國賢,黃慶華,郭伯棋,等.HbeAg陽性與HbeAg陰性慢性乙型肝炎患者的臨床和病理對照[J/CD].中華實驗和臨床感染病雜志(電子版),2010,4(1):27-32.
[16]鮑淑華,樓正青,高麗華.乙肝病毒標記物陽性表型血清標本HBV-DNA水平分析[J].中華全科醫學,2014,12(6):977-978.
[17]Meier A,Mehrle S,Weiss TS,et al.Myristoylated PreS1-domain of the hepatitis B virus L-protein mediates specific binding to differentiated hepatocytes[J].Hepatology(Baltimore,Md.),2013,58(1): 31-42.
[18]王 姣,鄧 洪,謝冬英,等.HBV特異性CTLs表面CD244和PD-1共表達與慢性乙型肝炎嚴重程度的相關性[J].中國病理生理雜志,2012,28(12):2254-2260.
[19]陳繼梅,呂 亮,丁雪芳.慢性乙型肝炎患者血清HBVDNA載量與肝功能指標關系研究[J].中華全科醫學,2012,10(4):618-619.
[20]Kennedy PT,Sandalova E,Jo J,et al.Preserved T-cell function in children and young adults with immune-tolerant chronic hepatitis B [J].Gastroenterology,2012,143(3):637-645.
Investigation of the association between the SNP in-201 loci of chemotactic factor CXCL10 gene promoter region and the susceptibility to chronic hepatitis B.
LI Xiao-yang1,ZHANG Qiang2,YI Xian-fu3,YUAN Qing4,TANG Wen-juan5.1.Department of Clinical Laboratory,Taihe Hospital of Changsha City,Changsha 410000,Hunan,CHINA; 2.Department of Respiration,the Third Xiangya Hospital of Central South University,Changsha 410000,Hunan,CHINA; 3.Department of Emergency,the Affiliated Taihe Hospital of Hubei University of Medicine,Shiyan 442000,Hubei, CHINA;4.Department of Clinical Laboratory,the First Affiliated Hospital of Guangzhou University,Shiyan 442000,Hubei,CHINA; 5.Women'sHealthDepartment,ShiyanMaternalandChildHealthHospital,Shiyan442000,Hubei,CHINA
ObjectiveTo investigate the association between the single nucleotide polymorphism(SNP) in-201 loci of chemotactic factor CXCL10 gene promoter region and the susceptibility to chronic hepatitis B(CHB).MethodsOne hundred and forty-two patients with chronic hepatitis B(CHB group)and 150 healthy controls(HC group)were included in our research.Genotypes of-201 loci in the chemotactic factor CXCL10 gene promoter were examined by the polymerase chain reaction and restriction fragment length polymorphism(PCR-RFLP).The serum levels of alanine aminotransferase(ALT),aspartate aminotransferase(AST),total bilirubin(T-Bil),gamma glutamyl transpeptidase(GGT),albumin(ALB),hepatitis B e antigen(HBeAg),hepatitis B virus(HBV-DNA)and the HBV-DNA viral load,hepatitis B virus large protein(HBV-LP)and hepatitis B virus S1 antigen(HBV-PreS1)were detected.ResultsCompared with HC group,the frequency distribution of the GA&AA genotype of CXCL10-201A/G was significantly increased in CHB group(P<0.05),as well as the frequency distribution of the A-allele.Moreover, the A-allele of-201 loci may be associated with the susceptibility to CHB virus(OR=1.940,OR95%CI:1.139~3.305). CXCL10-201A/G SNP was not associated with the positive rate of ALT,AST,HbeAg,HBV-DNA,HBV-LP, HBV-PreS1(P>0.05).When HBV-DNA viral load in the CHB group was in the range of 105~106 copies/ml,the frequency distribution of A-allele and G-allele was statistically significant(χ2=3.958,P=0.047).ConclusionSNPin-201 loci of CXCL10 gene promoter region is associated with susceptibility to chronic hepatitis B,and A-allele may be the susceptible factors of HBV infection.
CXCL10;-201G/A;Polymorphism;Chronic hepatitis B;Susceptibility
R512.6+2
A
1003—6350(2015)14—2093—05
10.3969/j.issn.1003-6350.2015.14.0755
2015-01-22)
湖北省教育廳資助課題(編號:鄂教科Z20082401)
唐文娟。E-mail:wenjuantangfuyou@163.com

