肝臟原發性神經內分泌癌的影像學表現(附2例報告并文獻復習)
付夢瀛,劉曉航,周良平
復旦大學附屬腫瘤醫院放射診斷科,復旦大學上海醫學院腫瘤學系,上海 200032
肝臟原發性神經內分泌癌的影像學表現(附2例報告并文獻復習)
付夢瀛,劉曉航,周良平
復旦大學附屬腫瘤醫院放射診斷科,復旦大學上海醫學院腫瘤學系,上海 200032
目的:探討肝臟原發性神經內分泌癌(PHNEC)的CT及MRI表現及鑒別診斷。方法:對2例經手術病理證實為PHNEC患者的影像學資料進行回顧性分析。結果:2例患者中,1例為肝右葉單發腫塊,CT平掃表現為不均質低密度腫塊伴囊變壞死,增強掃描表現為動脈期實性部分中度強化,門靜脈期強化程度減低;MRI表現為T1WI低信號,T2WI高信號,伴內部壞死區長T1長T2信號。另1例患者表現為大腫塊伴周圍衛星灶,CT掃描呈低密度,增強掃描動脈期輕度強化,門靜脈期強化程度減低。結論:PHNEC常表現為增強掃描動脈期輕至中度強化,門靜脈期強化程度減低。腫塊內囊變壞死及大腫塊周圍伴小結節可能為PHNEC較具特征性的表現。
肝臟;神經內分泌癌;計算機斷層掃描;磁共振成像
神經內分泌腫瘤好發于胃腸道及胰腺,肝臟是神經內分泌腫瘤常見的轉移部位,但原發于肝臟的病例非常少見[1-3]。本研究收集分析2例肝臟原發性神經內分泌癌(primary hepatic neuroendocrine carcinoma,PHNEC)患者的影像學資料并復習文獻,總結PHNEC患者的影像學表現,以提高對該病的診斷水平。
1 資料和方法
1.1 病例資料
搜集復旦大學附屬腫瘤醫院2008年1月—2013年12月共2例經手術病理證實為PHNEC的患者。資料如下:病例1,患者,女,61歲。無明顯誘因上腹部疼痛1周入院。患者既往無肝硬化及肝炎病史,輔助檢查無明顯異常,腫瘤標記甲胎蛋白(alpha-fetoprotein,AFP)、癌胚抗原(carcinoembryonic antigen,CEA)及CA19-9均在正常范圍。病例2,患者,女,63歲。無明顯誘因右上腹隱痛不適2周入院。患者既往無肝硬化及肝炎病史,肝功能檢查示堿性磷酸酶、谷丙轉氨酶輕度升高,谷氨酰轉肽酶明顯升高,余輔助檢查未見明顯異常,腫瘤標記AFP、CEA及CA19-9均在正常范圍。
1.2 檢查方法
2例患者均行CT增強檢查,其中1例加作MRI檢查。CT設備采用SIEMENS公司Emotion 16層螺旋CT掃描,管電壓120 kV,管電流120 mAs,層厚5 mm。行上腹部Ⅲ期增強掃描,掃描范圍自膈頂至腎臟下極,對比劑為碘海醇(300 mg I/mL)90~100 mL,流速3.0~4.0 mL/s。MRI采用GE公司SIGNA3.0T磁共振掃描儀,行常規平掃和3D LAVA動態增強掃描。層厚5 mm,視野40 cm×40 cm,矩陣272×192。對比劑為釓噴酸葡胺注射液(馬根維顯)20 mL,流速3.5 mL/s,再注入20 mL鹽水沖洗,15 s后開始動態增強序列掃描。
2 結 果
病例1入院后行CT及MRI檢查(圖1)。CT示:肝臟右后葉占位,內見囊變壞死,邊緣尚清;增強后動脈期實性部分中度強化,CT值為95 HU,門靜脈期強化程度減低,CT值為78 HU。MRI示:肝臟右后葉占位,邊界清晰,鄰近肝包膜凹陷,腫塊呈TIWI低信號,T2WI高信號,中心見長T1長T2壞死信號,增強掃描動脈期明顯強化,門靜脈期信號減低,延遲期強化程度持續下降。術中見患者肝門區及肝十二指腸韌帶明顯腫大淋巴結,肝臟右葉Ⅶ段捫及一約5 cm×4 cm×4cm大小腫塊,邊界不清。腫瘤侵犯部分右側膈肌腳。病理結果示:(右肝)神經內分泌腫瘤,核分裂象35/10 HPF,Ki-67(+)25%,符合G3分級。免疫組織化學:AE1/AE3(+),CK19(+),Syn(+),CgA(+),MUC-1(+),Ki-67(+)25%。
病例2入院后行CT檢查(圖2)。CT示:肝右葉及左內葉近肝門處不規則低密度腫塊,邊界不清,最大徑約84 mm×93 mm,增強后動脈期輕度強化,CT值為71 HU,門靜脈期強化程度減退,CT值為53 HU。膽囊壁輕度不規則增厚。術中探查:肝臟右葉Ⅳ、Ⅶ段捫及一約7 cm× 8 cm×7 cm大小腫塊,質硬,邊界不清,周圍有數枚衛星灶,侵犯膽囊。膽囊迂曲,脹大,膽囊壁增厚。膽總管直徑約1.0 cm,其內未捫及明顯腫塊或結節。病理結果示:右中肝、尾狀葉肝、膽囊神經內分泌癌,G3。12p淋巴結見癌轉移(1/1)。免疫組織化學:瘤細胞Syn(+),CgA(+),AFP(+/-),S100(+),CK7(+),Ki-67(+)約50%。
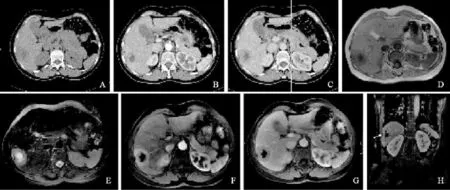
圖1 病例1患者影像學檢查表現
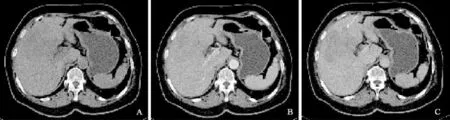
圖2 病例2患者影像學檢查表現
3 討 論
神經內分泌腫瘤過去稱為類癌。2010年世界衛生組織(World Health Organization,WHO)對神經內分泌腫瘤進行了重新分類,分為神經內分泌瘤(neuroendocrine tumor,NET)G1、NET G2、神經內分泌癌(neuroendocrine carcinoma,NEC)[4]。神經內分泌腫瘤一般好發于胃腸道和胰腺,肝臟是神經內分泌腫瘤常見的轉移部位,但原發于肝臟者非常少見[3]。一般認為PHNEC起源于肝內毛細膽管細胞的神經內分泌細胞(Kulchitsky細胞)、腸嗜鉻細胞、肝內異位胰腺或腎上腺組織[1-2]。
臨床表現多種多樣,最常見的臨床癥狀是右上腹脹痛,通常無肝炎或肝硬化病史,AFP、CEA、CA19-9常在正常范圍。由于臨床癥狀不典型,大多數患者常在健康體檢時才發現肝內腫塊[1,3,5]。有報道稱,只有極少數患者會出現類癌綜合征,這種情況可能與神經內分泌產物數量不足或質量缺陷,不能激活靶器官發揮生物學作用有關[6-7]。確診PHNEC要滿足:①病理學證實;②排除肝外其他原發病灶[5]。有文獻報道PHNEC可發生于各年齡段,好發于中年人,女性發生率可能高于男性[8]。本組報道的2例患者均為女性,年齡分別為61及63歲,臨床均表現為無明顯誘因出現上腹部疼痛不適,均未出現類癌綜合征,均無慢性肝炎及肝硬化病史,AFP、CEA及CA19-9均正常,與文獻報道相符。
PHNEC的免疫組織化學檢查主要依據血清5-羥色胺(5-hydroxytryptamine,5-HT)、CgA、 24 h尿5-羥吲哚乙酸(5-hydroxyindole acetic acid,5-HIAA)及Syn指標,其中CgA是檢測神經內分泌癌的特異性指標,也可用來監測腫瘤的復發[9-10]。而AFP、CEA、CA19-9幾乎無診斷價值。本組2例患者CgA、Syn均為陽性,血清5-HT及24 h尿5-HIAA未檢查。
有文獻報道PHNEC常表現為大腫塊伴周圍衛星灶,且腫塊內囊變壞死可能為其特征性表現[2-3]。本組2例患者中,1例為大腫塊伴衛星灶,1例為單發腫塊伴內部囊變壞死,與文獻報道相符。病例2可見肝包膜凹陷征,可能由腫瘤侵及肝組織邊緣,瘤體中央囊變壞死,壞死區纖維細胞增生牽拉肝包膜所致。肝包膜凹陷征是肝臟惡性腫瘤的特異性表現,對判斷腫瘤的良惡性有一定價值。
復習文獻及結合本組2例患者的影像學表現,總結如下:PHNEC的CT平掃常表現為低密度腫塊,可伴有囊變壞死;增強后動脈期輕至中度強化,門靜脈期強化程度減低[11-12]。也有文獻報道某些PHNEC可表現為增強掃描動脈期中高度強化,門靜脈期持續強化[2,13-14]。MRI表現為T1WI低信號,T2WI高信號,可伴有長T1長T2壞死信號,增強掃描動脈期明顯強化,門靜脈期強化程度降低,延遲期強化程度持續下降[3]。敖煒群等[2]報道稱,MRI增強掃描可表現為動脈期不均勻明顯強化,門靜脈期持續強化,延遲期為相對低信號。由此可見,PHNEC的影像學表現有一定的特征性。目前有關PHNEC影像學表現的文獻較少,因此確診還需結合病理學結果及排除肝外其他原發病灶。
由于PHNEC臨床上較罕見,影像學表現不典型,易誤診,因此需與其他肝臟腫瘤進行鑒別診斷。①原發性肝細胞癌:當PHNEC表現為單發腫塊且強化較明顯時,與原發性肝細胞癌較難鑒別。但肝細胞癌患者往往有慢性肝炎或肝硬化病史,AFP水平升高,CT增強掃描動脈期明顯強化,門靜脈期強化程度迅速下降,呈“快進快出”。而PHNEC多無肝硬化或肝炎病史,AFP多正常,增強掃描門靜脈期強化程度下降[3,13]。②原發性膽管細胞性肝癌:當PHNEC表現為輕度強化腫塊伴囊變壞死時,需與原發性膽管細胞性肝癌相鑒別。原發性膽管細胞性肝癌在CT多表現為伴有病灶內外膽管擴張,門靜脈期及延遲期持續強化,與PHNEC表現不同。③肝轉移瘤:當PHNEC表現為肝內多發腫瘤時,應與肝轉移瘤相鑒別。肝轉移瘤多表現為肝內多發病灶,增強掃描呈環形強化,可出現“牛眼征”,且有原發腫瘤病史。
由于PHNEC的臨床表現不典型,且早期易發生肝內和淋巴結轉移,因此早期診斷和治療對提高生存率有較大幫助。手術切除是目前PHNEC的首選療法,其預后與腫瘤的可切除性有關。術前或術后的綜合治療如化療、肝動脈化療栓塞和射頻消融等對提高生存率有一定幫助[5]。
綜上所述,PHNEC比較罕見,臨床表現不典型,影像學表現有一定的特異性,對疾病的診斷和治療有較大幫助。
[1] YALAV O, ULKU A, AKCAM T A, et al. Primary hepatic neuroendocrine tumor: Five cases with different preoperative diagnoses [J]. Turk J Gastroenterol, 2012,23(3): 272-278.
[2] 敖煒群, 吳東, 曾蒙蘇, 等. 原發性肝臟神經內分泌癌的CT和MRI診斷 [J]. 放射學實踐, 2013, 28(10): 1032-1036.
[3] LI R K, ZHAO J, RAO S X, et al. Primary hepatic neuroendocrine carcinoma: MR imaging findings including preliminary observation on diffusion-weighted imaging[J]. Abdom Imaging, 2013, 38(6): 1269-1276.
[4] 趙婧, 楊博, 徐晨, 等. 肝臟原發性神經內分泌腫瘤臨床病理分類及預后分析 [J]. 中華病理學雜志, 2012,41(2): 102-106.
[5] JIA C, ZHANG Y, XU J, et al. Experience in primary hepatic neuroendocrine tumor [J]. Turk J Gastroenterol,2012, 23(5): 546-551.
[6] 張文書, 趙婧, 紀元, 等. 肝原發性與轉移性神經內分泌腫瘤的臨床病理分析 [J]. 中華肝膽外科雜志, 2012,18(3): 161-165.
[7] 李曉, 劉丕. 原發性肝臟神經內分泌腫瘤 [J]. 中華消化雜志, 2012, 32(7): 492-493.
[8] SOTIROPOULOS G C, CHARALAMPOUDIS P,DELLADETSIMA I, et al. Surgery for giant primary neuroendocrine carcinoma of the liver [J]. J Gastrointest Surg, 2014, 18(4): 839-841.
[9] HUANG Y Q, XU F, YANG J M, et al. Primary hepatic neuroendocrine carcinoma: clinical analysis of 11 cases [J]. Hepatobiliary Pancreat Dis Int, 2010, 9(1): 44-48.
[10] 朱正, 趙心明, 周純武. 肝臟原發神經內分泌癌的影像表現 [J]. 中國醫學影像技術, 2010, 26(4): 721-723.
[11] 張京剛, 邢偉, 陳杰, 等. 原發性肝膽神經內分泌癌的影像學表現 [J]. 實用放射學雜志, 2013, 29(2): 322-324, 336.
[12] 朱世華, 張云山, 賀聲, 等. 原發性肝、膽囊神經內分泌癌的影像學表現 [J]. 中華放射學雜志, 2003, 37(12): 1143-1147.
[13] 尚海龍, 沈海林. 3例肝臟原發性神經內分泌癌影像學表現 [J]. 重慶醫學, 2012, 41(25): 2597-2599.
[14] 袁梅, 李桂梅, 吳建偉. 3例肝臟原發性神經內分泌癌的影像學表現 [J]. 臨床腫瘤學雜志, 2012, 17(11): 1054-1056.
CT and MRI findings of primary hepatic neuroendocrine carcinoma FU Mengying, LIU Xiaohang, ZHOU
Liangping (Department of Radiology, Fudan University Shanghai Cancer Center; Department of Oncology,Shanghai Medical College, Fudan University, Shanghai 200032, China)
ZHOU Liang-ping E-mail: zhoulp2003@aliyun.com
Objective: To investigate the CT and MRI fi ndings of primary hepatic neuroendocrine carcinoma (PHNEC)and its differential diagnosis. Methods: The data of CT and MR images of 2 cases with pathologically proved PHNECwere retrospectively analyzed. Results: One case with a single mass in the right hepatic lobe showed heterogeneous hypodense with intratumoral cystic degeneration on CT. The solid component was enhanced moderately in arterial phase and declined in portal venous phase. The mass with hypointensity on T1-weighed imaging (T1WI) and hyperintensity on T2-weighed imaging (T2WI)was shown on MRI. The other case had a dominant mass surrounded by satellite nodules and showed hypodense on non-enhanced CT. The masses were enhanced slightly in arterial phase and declined in portal venous phase. Conclusion: Slight to moderate enhancement in arterial phase and decline in portal venous phase was observed in PHNEC. Intratumoral cystic degeneration and dominant mass with satellite nodules might be the features.
Liver; Neuroendocrine carcinoma;, Computed tomography; Magnetic resonance imaging
R445.3
A
1008-617X(2015)01-0059-04
2014-07-18
修回日期:2014-08-16)
周良平 E-mail:zhoulp2003@aliyun.com

