肌球蛋白輕鏈激酶介導內皮細胞屏障功能變化的研究進展*
吳 潔, 張偉金, 黃巧冰
(南方醫科大學 1第一臨床醫學院, 2基礎醫學院,廣東 廣州 510515)
?
·綜 述·
肌球蛋白輕鏈激酶介導內皮細胞屏障功能變化的研究進展*
吳 潔1, 張偉金1, 黃巧冰2△
(南方醫科大學1第一臨床醫學院,2基礎醫學院,廣東 廣州 510515)
血管內皮細胞是連續被覆于全身血管內膜的一層細胞群,不僅構成一道半選擇通透性屏障,還合成和分泌多種生物活性物質,維持正常的心血管功能。血管內皮細胞的完整和屏障功能完好對于維持心血管穩態有至關重要的作用。內皮細胞受損所致屏障功能下降是血管病變的始動環節,如腦血管內皮連接受損導致的腦水腫[1]。肌球蛋白輕鏈激酶(myosin light chain kinase,MLCK)是第1個被發現的依賴于鈣調蛋白(calmodulin,CaM)的絲/蘇氨酸特異性蛋白激酶,隨著對其結構和功能研究的深入,MLCK在介導內皮細胞通透性改變中所起的重要作用引起了廣泛關注,本文就此做一綜述。
1 MLCK的生化特性
1.1 MLCK家族 MLCK是免疫球蛋白超家族的一員,屬于Ca2+/CaM依賴的蛋白激酶家族,由位于人類3、20、16號染色體上的mylk1~3基因編碼[2]。心肌型MLCK(cardiac myosin light chain kinase,cMLCK)和骨骼肌型MLCK(skeletal myosin light chain kinase,skMLCK)分別由mylk3和mylk2編碼,而平滑肌型MLCK(smooth muscle myosin light chain kinase,smMLCK)和非肌型MLCK(non muscle myosin light chain kinase,nmMLCK)則由mylk1編碼[3]。cMLCK 和skMLCK的表達分別僅限于心肌和骨骼肌組織。與此相反,smMLCK普遍存在于成熟組織,以平滑肌組織含量最多。而nmMLCK又分為MLCK1~4個亞型,其中內皮細胞主要表達MLCK1和MLCK2。
1.2 MLCK的結構及功能 MLCK家族分子結構存在較大差異,但smMLCK與nmMLCK較為相似。smMLCK由1 147個氨基酸組成,分子量約為108 kD,因此又被稱作MLCK108。smMLCK的N端含有1個包含纖連蛋白的結構域、2個免疫球蛋白結構域和多個磷酸化位點。nmMLCK與smMLCK的不同之處在于其N端所特有的922個氨基酸殘基序列,包含 6 個延伸的免疫球蛋白結構域以及2個串聯的肌動蛋白結合區。nmMLCK分子量約為210 kD,4個亞型的不同在于其組成的1 914個氨基酸序列的不同。
MLCK的主要功能是對肌球蛋白輕鏈(myosin light chain,MLC)進行磷酸化,其活性直接影響肌動蛋白與肌球蛋白的相互作用并引起細胞中心張力的改變,因此MLCK在肌肉收縮和細胞遷移等方面發揮重要作用。在平滑肌細胞,Ca2+與CaM的結合激活smMLCK,使得肌球蛋白頭部輕鏈磷酸化,Mg2+-ATP酶被激活并分解ATP產生能量,促進橫橋擺動,進而拖動細肌絲滑行,從而完成一次平滑肌收縮。然而,在內皮細胞和其它非肌細胞,Ca2+與CaM的結合還不足以激活MLCK,仍需要其它信號轉導途徑的參與[4]。
2 MLCK介導內皮細胞通透性改變的信號轉導機制
血管內皮正常屏障功能的維持有賴于緊密連接(tight junction,TJ)、黏附連接(adherence junction,AJ)和細胞骨架收縮之間的動態平衡。細胞間連接提供黏附力,細胞骨架收縮形成向心力,兩種力達到平衡才能維持正常的屏障功能。細胞收縮是各種原因引起屏障通透性增加的共同途徑,主要受肌動蛋白和肌球蛋白的影響,二者相互作用使細胞產生收縮力,當收縮力大于黏附力時,內皮通透性增高。
作為馬達蛋白的肌球蛋白II由2條200 kD的重鏈和4條20 kD的輕鏈組成,重鏈形成2條平行的鏈型結構,其氨基末端頭部與ATP和肌動蛋白作用介導肌絲滑行。輕鏈分為2條基礎性輕鏈和2條調節性輕鏈(regulatory light chain,RLC),前者起穩定重鏈結構的作用,后者調節肌球蛋白的活性,而MLCK激活的正是RLC[5]。肌球蛋白的主要作用是調控細胞骨架結構并參與細胞的多種生理活動,而這些主要通過MLC的磷酸化與去磷酸化實現[6]。MLC 的磷酸化是生物屏障通透性增加的分子基礎[7],磷酸化型 MLC 通過活化肌球蛋白重鏈頭部的 ATP 酶,產生能量介導骨架蛋白微絲滑動,促使細胞收縮和細胞間連接改變,最終細胞間隙形成,通透性增加。研究表明,許多細胞因子、炎癥介質等神經及體液介質均可通過 MLC 磷酸化而引起屏障通透性增加[8-9]。在MLCK介導的內皮通透性增高中,效應分子MLC的磷酸化是關鍵環節,而MLCK的激活依賴于輔助因子Ca2+與CaM的結合、上游激活蛋白Src和蛋白激酶C(protein kinase C, PKC)的作用、一氧化氮(nitric oxide, NO)與環鳥苷酸(cyclin guanosine monophosphate,cGMP)信號分子以及絲裂原活化蛋白激酶(mitogen-activated protein kinases, MAPK)通路的參與。
2.1 MLCK介導MLC磷酸化 MLCK介導內皮細胞通透性增加依賴于MLC的磷酸化,MLCK 通過磷酸化MLC的第18位絲氨酸和第19位蘇氨酸激活肌球蛋白重鏈頭部ATP酶,產生的能量引起內皮細胞肌動蛋白與肌球蛋白II相互作用,使得細胞收縮,細胞間隙形成,通透性增加[10]。MLC 磷酸化除了主要受 MLCK 調控外,還受到肌球蛋白輕鏈磷酸酶(myosin light chain phosphatase,MLCP)的負調控[11]。MLCP 催化MLC 從磷酸化型向非磷酸化型轉變,導致磷酸化型 MLC 減少,而 MLCP 活性則又受到Rho激酶(ROCK)的負調控。因此,ROCK的激活是 MLC 發生磷酸化的又一原因。
2.2 Ca2+通道 Ca2+在血管內皮的功能運行中扮演著十分重要的角色,細胞內游離Ca2+濃度的變化調節著細胞的代謝、基因表達等活動。通過與CaM結合,Ca2+是調節MLCK活性最基本的介質。Ca2+通道的激活對于細胞內Ca2+濃度的調控至關重要,因此在MLCK誘導內皮通透性增高的過程中,Ca2+通道的作用十分重要。研究指出[12],瞬時受體電位Ca2+通道(transient receptor potential channels,TRPC)的激活能夠誘導腦毛細血管內皮通透性增高,而MLCK抑制劑ML-9能夠阻止TRPC的活化以及內皮通透性增高,這就說明MLCK通過TRPC的活化導致內皮通透性增高。MLCK介導的內皮高通透性也可能和鈣池操縱的鈣通道(store-operated Ca2+channels,SOC)的活化有密切關系。研究表明[13],SOC通道的活化依賴于三磷酸肌醇受體(inositol 1,4,5-triphosphate receptor,IP3R)活化所誘導的內質網鈣的釋放,IP3R的活化引發MLC磷酸化以及MLC磷酸化依賴的緊密連接蛋白occludin和claudin-5的磷酸化,而后二者的磷酸化是MLCK依賴性的,這提示在內皮通透性增高中,MLCK處于SOC通道的上游。然而相反的觀點仍然存在,有報道指出TRPC抑制劑SKF96365能夠阻止缺氧造成的鼠腦內皮細胞MLC磷酸化和通透性增高[14]。
2.3 Src Src蛋白激酶參與了內皮細胞TJ和AJ構成的蛋白形態的改變,細胞黏附力降低及應力纖維形成增多,進而導致細胞間收縮力增加和間隙增大,最終血管通透性升高[15]。酪氨酸激酶Src通過磷酸化MLCK的Y464和Y471位點從而激活MLCK,因MLCK2沒有包含這2個位點的剪接變體,所以其活化作用僅限于MLCK1[16]。另有證據表明[17],通過基因沉默、位點突變和藥物抑制等方法抑制Src的表達,都能夠顯著減緩MLCK依賴的內皮屏障功能紊亂。
活性氧(reactive oxygen species,ROS)的產生能夠直接或間接地作用于內皮細胞,使得受損的血管松弛、白細胞黏附增加和內皮通透性升高[18]。p47phox是NADPH氧化酶系統的主要成份,Src能夠介導p47phox和皮層肌動蛋白(cortactin)的酪氨酸位點磷酸化,促進ROS的產生。在肺內皮細胞中,組織內氧過多會以Src依賴的方式激活NADPH氧化酶,產生ROS或超氧化物[19]。最新的研究證明,肺動脈內皮細胞中過表達的野生型MLCK會增強p47phox與cortactin在細胞外圍的共定位和ROS的產生,且使用MLCK siRNA下調MLCK的表達顯著抑制上述現象[20]。這個研究提示,MLCK除了可以介導MLC的磷酸化導致內皮細胞的收縮和通透性的增加,還可通過與cortactin的相互作用,為Src與NADPH等結合形成復合物并介導ROS的生成提供反應平臺,進一步加重內皮細胞的損傷。
2.4 PKC PKC是一類分子量在78~90 kD的同工酶家系,是最早被確認的蛋白激酶之一。PKC被激活后移位到細胞膜對其底物進行酸化作用,其經典亞型PKCα和PKCβ誘導內皮高通透性的作用廣為人知。PKC信號通路涉及細胞骨架重組和細胞收縮、Ca2+通道等多種信號轉導通路。PKC與MLCK二者的活化對于炎癥細胞因子誘導的高通透性缺一不可[21]。
Guntaka等[22]發現,在膽管上皮細胞,MLCK抑制劑ML-7能夠顯著減緩PKC誘導的屏障功能紊亂。另有研究表明[23],ML-7能夠緩解離體冠狀靜脈PKC激活而介導的通透性過高。這些提示PKC介導的內皮細胞通透性增高很有可能與MLCK的活化有關。研究證實,PKC活化與胞內Ca2+增多協同作用能導致人臍靜脈內皮細胞(human umbilical vein endothelial cells,HUVECs)的MLC磷酸化增多和通透性增高。PKCα與MLCK被認為是調控肺微血管內皮細胞(pulmonary microvascular endothelial cells,PMVECs)損傷最關鍵的蛋白質,PKCα被激活后,引起下游骨架蛋白磷酸化,最終激活MLCK,使MLC發生磷酸化,介導肌球-肌動蛋白間相互作用,從而引起內皮細胞的收縮,最終導致細胞旁間隙形成、血管通透性增加[24]。因此認為,PKC處于MLCK上游,通過磷酸化MLCK介導內皮細胞通透性增高。
2.5 NO與cGMP NO在多條信號通路中發揮作用,不僅可與ROS結合生成ONOO-,還能夠亞硝基化很多蛋白質。在導致內皮通透性增高的信號通路中,NO能夠激活鳥苷酸環化酶(guanylate cyclase,GC),使得GC催化GTP轉變為cGMP。 在不同類型的細胞中,cGMP通過不同的調節機制增加或者降低內皮通透性。而在MLCK依賴的內皮細胞通透性增高中,NO與 cGMP處于PKC的下游。活化的PKCα能夠磷酸化內皮細胞一氧化氮合酶(endothelial nitric oxide synthase,eNOS)的S1179位點從而將其激活,促使NO生成增多,并進一步導致cGMP生成增加。cGMP激活蛋白激酶G(protein kinase G,PKG)后,通過其下游MAPK通路激活MLCK,引起MLC磷酸化和通透性增高。除此之外,cAMP也參與了cGMP對內皮細胞通透性的調節。研究顯示[25],患有肺損傷的鼠肺內皮中cGMP的產生增加會導致cAMP的水解增多,而HUVECs中cAMP的增加或減少也受cGMP濃度的影響[26]。在大多數內皮細胞中,cAMP依賴的蛋白激酶PKA能抑制MLCK活性及內皮高通透性。因此,在一些內皮系統,cGMP和PKG依賴的MLCK活化也可能通過減少cAMP和降低蛋白激酶(protein kinase A, PKA)A的活性而實現。
2.6 MAPK通路 MAPK屬于絲/蘇氨酸蛋白激酶,在多種受體信號傳遞途徑中具有關鍵作用。細胞間信號調節蛋白激酶(extracellular regulated protein kinases,ERK)是參與細胞形態維持及細胞骨架構建最主要的MAPK 家族成員之一。研究表明,ERK能夠增強內皮細胞MLCK活性和MLC磷酸化,導致細胞間連接破壞和間隙形成[27]。在人動脈內皮細胞(human aortic endothelial cells,HAECs),MLCK所介導的應力纖維形成也是 ERK依賴性的[28]。另有證據表明[29],在HUVECs中MLCK活性受ERK-MAPK 信號轉導通路調節,而Woody等[30]發現ERK2的抑制劑能有效抑制MLCK磷酸化。因此認為,ERK在MLCK誘導的內皮通透性增高中起到重要作用。
外傷性腦損傷(traumatic brain injury,TBI)所造成的血腦屏障(blood-brain barrier,BBB)功能損傷中,MLCK導致的細胞骨架重組起到關鍵作用。研究顯示[31],TBI發生后白蛋白能夠通過p38MAPK通路激活MLCK,最終導致BBB功能紊亂。由此可見,MAPK通路在MLCK調節血管內皮通透性改變中占據重要地位。
綜上所述,多種信號分子能夠通過不同的通路激活MLCK,從而導致內皮屏障功能紊亂。如圖1所示,MLCK介導內皮通透性增高的關鍵環節在于MLCK介導的MLC磷酸化。MLC同時受MLCP的負調控,ROCK則對MLCP有抑制作用。Ca2+與CaM的結合直接激活MLCK。Src通過磷酸化Y464和Y471位點從而激活MLCK。PKC不僅能夠直接激活MLCK,還可以磷酸化eNOS的S1179位點從而將其激活,并導致NO、cGMP等信號分子增多,通過下游MAPK通路激活MLCK。另外,cGMP對環腺苷酸(cyclic adenosine monophosphate,cAMP)的負調控及PKA對MLCK的負調控最終促進MLCK的激活,p38MAPK通路同樣可以激活MLCK。
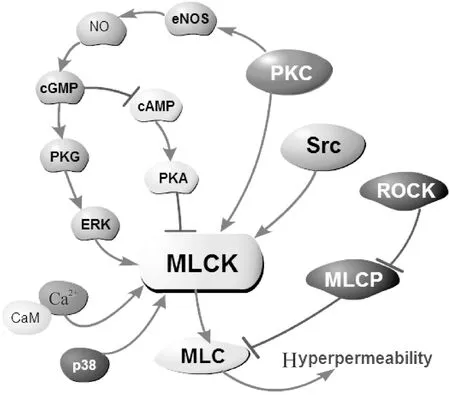
Figure 1.Main signaling pathways of MLCK-mediated endothelial barrier dysfunction.
3 展望
由此可見,MLCK通過復雜的信號轉導機制,提高肌球蛋白活性,使肌動-肌球蛋白交聯增加,導致細胞收縮和細胞間隙擴大,最終血管內皮通透性增加。而在內皮屏障功能紊亂和通透性增加中,MLCK介導的MLC磷酸化是細胞內眾多信號轉導通路的中心環節。目前已有臨床研究發現[32],MLCK可以作為急性肺損傷等疾病的相關藥物作用靶點,MLCK210基因敲除或者MLCK抑制劑的使用都能夠達到保護肺功能的效果。因此,MLCK將會為更多相關疾病的治療提供可能的作用靶點,從而為患者提供更好的幫助。
[1] Castejón OJ. Ultrastructural pathology of endothelial tight junctions in human brain oedema[J]. Folia Neuropathol,2012,50(2):118-129.
[2] Chan JY, Takeda M, Briggs LE, et al. Identification of cardiac-specific myosin light chain kinase[J]. Circ Res,2008,102(5):571-580.
[3] Hong F, Haldeman BD, Jackson D, et al. Biochemistry of smooth muscle myosin light chain kinase[J]. Arch Biochem Biophys,2011,510(2):135-146.
[4] Kaleka KS, Petersen AN, Florence MA, et al. Pull-down of calmodulin-binding proteins[J]. J Vis Exp,2012,(59):e3502.
[5] Ivanov AI, Mccall IC, Parkos CA, et al. Role for actin filament turnover and a myosin II motor in cytoskeleton-driven disassembly of the epithelial apical junctional complex[J]. Mol Biol Cell,2004,15(6):2639-2651.
[6] Chen C, Tao T, Wen C, et al. Myosin light chain kinase (MLCK) regulates cell migration in a myosin regulatory light chain phosphorylation-independent mechanism[J]. J Biol Chem,2014, 289(41):28478-28488.
[7] Birukova AA, Tian X, Cokic I, et al. Endothelial barrier disruption and recovery is controlled by substrate stiffness[J]. Microvasc Res,2013,87:50-57.
[8] Cao M, Wang P, Sun C, et al. Amelioration of IFN-gamma and TNF-alpha-induced intestinal epithelial barrier dysfunction by berberine via suppression of MLCK-MLC phosphorylation signaling pathway[J]. PLoS One,2013,8(5):e61944.
[9] Mu X, Pan C, Zheng S, et al. Protective effects of carbon monoxide-releasing molecule-2 on the barrier function of intestinal epithelial cells[J]. PLoS One,2014,9(8):e104032.
[10]Jia Z, Zhen W, Velayutham ABP, et al. Phytoestrogen genistein protects against endothelial barrier dysfunction in vascular endothelial cells through PKA-mediated suppression of RhoA signaling[J]. Endocrinology,2013,154(2):727-737.
[11]Yuen SL, Ogut O, Brozovich FV. Differential phosphorylation of LZ+/LZ- MYPT1 isoforms regulates MLC phosphatase activity[J]. Arch Biochem Biophys,2014,562:37-42.
[12]Norwood N, Moore TM, Dean DA, et al. Store-operated calcium entry and increased endothelial cell permeability[J]. Am J Physiol Lung Cell Mol Physiol,2000,279(5):L815-L824.
[13]Haorah J, Knipe B, Gorantla S, et al. Alcohol-induced blood-brain barrier dysfunction is mediated via inositol 1,4,5-triphosphate receptor (IP3R)-gated intracellular calcium release[J]. J Neurochem,2007,100(2):324-336.
[14]Hicks K, O’Neil RG, Dubinsky WS, et al. TRPC-mediated actin-myosin contraction is critical for BBB disruption following hypoxic stress[J]. Am J Physiol Cell Physiol,2010,298(6):C1583-C1593.
[15]張偉金,郭曉華. 非受體型酪氨酸蛋白激酶介導內皮細胞通透性改變的研究進展[J]. 微循環學雜志,2014, 24(1):61-64.
[16]Birukov KG, Csortos C, Marzilli L, et al. Differential regulation of alternatively spliced endothelial cell myosin light chain kinase isoforms by p60(Src)[J]. J Biol Chem,2001,276(11):8567-8573.
[17]Sun C, Wu MH, Yuan SY. Nonmuscle myosin light-chain kinase deficiency attenuates atherosclerosis in apolipoprotein E-deficient mice via reduced endothelial barrier dysfunction and monocyte migration[J]. Circulation,2011,124(1):48-57.
[18]Andrisani A, Dona G, Brunati AM, et al. Increased oxidation-related glutathionylation and carbonic anhydrase activity in endometriosis[J]. Reprod Biomed Online,2014,28(6):773-779.
[19]Chowdhury AK, Watkins T, Parinandi NL, et al. Src-mediated tyrosine phosphorylation of p47phox in hyperoxia-induced activation of NADPH oxidase and generation of reactive oxygen species in lung endothelial cells[J].J Biol Chem, 2005, 280(21):20700-20711.
[20]Usatyuk PV, Singleton PA, Pendyala S, et al. Novel role for non-muscle myosin light chain kinase (MLCK) in hyperoxia-induced recruitment of cytoskeletal proteins, NADPH oxidase activation, and reactive oxygen species generation in lung endothelium[J]. J Biol Chem,2012,287(12):9360-9375.
[21]Tinsley JH, Hunter FA, Childs EW. PKC and MLCK-dependent, cytokine-induced rat coronary endothelial dysfunction[J]. J Surg Res,2009,152(1):76-83.
[22]Guntaka SR, Samak G, Seth A, et al. Epidermal growth factor protects the apical junctional complexes from hydrogen peroxide in bile duct epithelium[J]. Lab Invest,2011,91(9):1396-1409.
[23]Yuan Y, Huang Q, Wu HM. Myosin light chain phosphorylation: modulation of basal and agonist-stimulated venular permeability[J]. Am J Physiol,1997,272(3 Pt 2):H1437-H1443.
[24]吳云虎,張 旋,王殿華. 非對稱二甲基精氨酸在大鼠腦缺血再灌注損傷誘導的急性肺損傷發病過程中的作用(英文)[J]. 南方醫科大學學報,2011(8):1289-1294.
[25]Schmidt EP, Damarla M, Rentsendorj O, et al. Soluble guanylyl cyclase contributes to ventilator-induced lung injury in mice[J]. Am J Physiol Lung Cell Mol Physiol,2008,295(6):L1056-L1065.
[26]Surapisitchat J, Jeon KI, Yan C, et al. Differential regulation of endothelial cell permeability by cGMP via phosphodiesterases 2 and 3[J]. Circ Res,2007,101(8):811-818.
[27]Peng YS, Lin YT, Chen Y, et al. Effects of indoxyl sulfate on adherens junctions of endothelial cells and the underlying signaling mechanism[J]. J Cell Biochem,2012,113(3):1034-1043.
[28]Ziegler ME, Jin YP, Young SH, et al. HLA class I-mediated stress fiber formation requires ERK1/2 activation in the absence of an increase in intracellular Ca2+in human aortic endothelial cells[J]. Am J Physiol Cell Physiol,2012,303(8):C872-C882.
[29]Zhu HQ, Cheng XW, Xiao LL, et al. Melatonin prevents oxidized low-density lipoprotein-induced increase of myosin light chain kinase activation and expression in HUVEC through ERK/MAPK signal transduction[J]. J Pineal Res,2008,45(3):328-334.
[30]Woody S, Stall R, Ramos J, et al. Regulation of myosin light chain kinase during insulin-stimulated glucose uptake in 3T3-L1 adipocytes[J]. PLoS One,2013,8(10):e77248.
[31]Rossi JL, Ralay RH, Patel F, et al. Albumin causes increased myosin light chain kinase expression in astrocytes via p38 mitogen-activated protein kinase[J]. J Neurosci Res,2011,89(6):852-861.
[32]Rossi JL, Velentza AV, Steinhorn DM, et al.MLCK210 gene knockout or kinase inhibition preserves lung function following endotoxin-induced lung injury in mice[J]. Am J Physiol Lung Cell Mol Physiol,2007,292(6):L1327-L1334.
Effects of myosin light chain kinase on regulation of endothelial barrier function
WU Jie1, ZHANG Wei-jin1, HUANG Qiao-bing2
(1FirstClinicalCollegeofMedicine,2SchoolofBasicMedicalSciences,SouthernMedicalUniversity,Guangzhou510515,China.E-mail:bing@smu.edu.cn)
Myosin light chain kinase (MLCK) activates the regulatory light chain of myosin II, and the phosphorylated myosin light chain leads to actomyosin contractile activity, as well as the cell contraction and increasing intercellular gap, which finally results in endothelial barrier dysfunction. MLCK-dependent hyperpermeability occurs in response to multiple cell signaling molecules and signaling pathways, including Ca2+, Src, PKC, NO, cGMP and mitogen activated protein kinases (MAPK). In this review, different mechanisms of endothelial hyperpermeability mediated by MLCK are discussed.
肌球蛋白輕鏈激酶; 肌球蛋白; 內皮細胞; 通透性
Myosin light chain kinase; Myosin; Endothelial cells; Permeability
1000- 4718(2015)03- 0572- 05
2014- 10- 22
2014- 12- 03
國家自然科學基金資助項目(No. 81370226);廣東省自然科學基金團隊項目(No. S2013030013217)
△通訊作者 Tel: 020-61648465; E-mail: bing@smu.edu.cn
R363
A
10.3969/j.issn.1000- 4718.2015.03.034

