PJ34對肺腺癌順鉑耐藥細(xì)胞增殖及耐藥性的影響
姚圓圓,郝吉慶
(安徽醫(yī)科大學(xué)第一附屬醫(yī)院腫瘤內(nèi)科,安徽合肥 230022)
?
PJ34對肺腺癌順鉑耐藥細(xì)胞增殖及耐藥性的影響
姚圓圓,郝吉慶
(安徽醫(yī)科大學(xué)第一附屬醫(yī)院腫瘤內(nèi)科,安徽合肥230022)
摘要:目的探討第3代選擇性PARP-1抑制劑PJ34對肺腺癌順鉑耐藥細(xì)胞株A549/DDP生長活性及耐藥性的影響。方法使用不同濃度梯度的順鉑(DDP)、PJ34單藥或聯(lián)合作用于A549/DDP細(xì)胞,MTT法檢測各藥物對細(xì)胞的增殖抑制率;流式細(xì)胞術(shù)檢測細(xì)胞凋亡率; Western blot檢測細(xì)胞內(nèi)PARP-1蛋白、MDR相關(guān)蛋白(LRP、GST-π)的表達(dá)水平。結(jié)果PJ34單藥對A549/DDP細(xì)胞有明顯的抑制作用,無毒劑量的PJ34可明顯增強(qiáng)A549/DDP細(xì)胞對順鉑的敏感性,誘導(dǎo)細(xì)胞凋亡,使細(xì)胞內(nèi)PARP-1蛋白、MDR相關(guān)蛋白(LRP、GST-π)的表達(dá)水平明顯降低。結(jié)論A549/DDP細(xì)胞的順鉑耐藥性與細(xì)胞內(nèi)PARP-1蛋白的過度表達(dá)有關(guān),PJ34有明顯的順鉑增敏作用,能部分逆轉(zhuǎn)A549/DDP細(xì)胞對順鉑的耐藥性,其機(jī)制可能與誘導(dǎo)細(xì)胞凋亡,降低細(xì)胞內(nèi)LRP、GST-π的蛋白表達(dá)水平有關(guān)。
關(guān)鍵詞:肺腺癌;聚腺苷二磷酸核糖聚合酶-1抑制劑;順鉑;耐藥性;凋亡;機(jī)制
聚腺苷二磷酸核糖聚合酶(poly ADP-ribose polymerase,PARP)是一種廣泛存在于真核細(xì)胞核中的蛋白質(zhì)翻譯后修飾酶,PARP-1是其主要成員,發(fā)揮著90%以上的功能,在DNA損傷修復(fù)、基因組完整性的維持、細(xì)胞死亡、有絲分裂中紡錘體的形成等過程中發(fā)揮關(guān)鍵作用[1-3]。國內(nèi)外學(xué)者們對PARP-1抑制劑在惡性腫瘤治療中的作用進(jìn)行了長期大量的探索和研究。目前,PARP-1抑制劑已發(fā)展到第3代,其選擇性、活性更高,并且很多已進(jìn)入臨床試驗(yàn)階段,被認(rèn)為是一種新型有效的抗腫瘤藥物。PARP-1抑制劑在乳腺癌、卵巢癌等惡性腫瘤中的體內(nèi)外Ⅲ期臨床試驗(yàn)中均取得了良好的療效[4-5],但在肺癌中的研究仍較少。目前研究發(fā)現(xiàn),肺癌的發(fā)病率及死亡率均位居全球惡性腫瘤之首,在我國更是威脅人類生命健康的最大殺手。非小細(xì)胞肺癌(non-small cell lung cancer,NSCLC)約占肺癌發(fā)病率的75%~80%,絕大多數(shù)(80%)確診時已屬晚期,失去手術(shù)機(jī)會,化學(xué)治療成為晚期NSCLC的主要治療方法。順鉑(cisplatin,DDP)是臨床上最常用的細(xì)胞周期非特異性抗腫瘤藥物,主要作用靶點(diǎn)是DNA,通過在細(xì)胞內(nèi)形成鉑-DNA加合物抑制DNA的復(fù)制和轉(zhuǎn)錄,目前以DDP為基礎(chǔ)的聯(lián)合化療仍是國際上公認(rèn)的晚期NSCLC的標(biāo)準(zhǔn)一線化療方案。然而,絕大多數(shù)患者在DDP用藥過程中會逐步產(chǎn)生耐藥現(xiàn)象,導(dǎo)致腫瘤復(fù)發(fā)及治療失敗。這成為當(dāng)前困擾肺癌治療的一大難題。肺癌的DDP耐藥機(jī)制是一個多因素參與的復(fù)雜過程[6],至今仍未明確。因此,探索肺癌DDP耐藥機(jī)制的決定因素、尋求耐藥逆轉(zhuǎn)劑來克服耐藥現(xiàn)象成為當(dāng)前臨床治療肺癌急需解決的問題。
本研究擬探討第3代PARP-1抑制劑PJ34對肺癌A549/DDP細(xì)胞耐藥性的影響,初步探究其可能的作用機(jī)制,為PARP-1抑制劑應(yīng)用于肺癌DDP耐藥的臨床治療提供一定的依據(jù)。
1 材料與方法
1.1材料
1.1.1細(xì)胞株A549/DDP細(xì)胞株購自上海瑞鹿生物科技有限公司,A549細(xì)胞株由安徽醫(yī)科大學(xué)第一附屬醫(yī)院中心實(shí)驗(yàn)室惠贈,均培養(yǎng)于37℃、5% CO2的培養(yǎng)箱中,隔天換液,細(xì)胞長滿80%~90%即可傳代。A549/DDP細(xì)胞培養(yǎng)液中加入終濃度為2 mg·L-1的順鉑以維持耐藥表型。
1.1.2藥品與試劑RPMI 1640培養(yǎng)基購自美國Hyclone公司,PJ34、胎牛血清、MTT粉末均購自美國Sigma公司,順鉑注射液購自山東齊魯制藥廠,Annecxin V-FITC/PI細(xì)胞凋亡檢測試劑盒購自上海貝博生物公司,兔抗人PARP-1單克隆抗體購自Abcam公司,鼠抗人LRP單克隆抗體購自Santa Cruz公司,鼠抗人GST-π單克隆抗體購自Bioworld公司,ECL發(fā)光試劑盒購自Thermo公司。
1.1.3主要儀器設(shè)備細(xì)胞培養(yǎng)箱購自美國THERMO公司,倒置顯微鏡購自日本Olympus公司,超凈工作臺購自蘇州凈化,低速離心機(jī)購自德國Eppendorf,流式細(xì)胞儀購自美國Beckman公司,EPS300型電泳儀、VE-186型轉(zhuǎn)膜儀均購自Tanon公司。
1.2方法
1.2.1MTT法檢測DDP及PJ34單藥對A549/DDP細(xì)胞增殖的影響將對數(shù)生長期的細(xì)胞以5 000 個/孔接種于96孔板,分別設(shè)空白對照組、細(xì)胞對照組及藥物處理組,培養(yǎng)于37℃、5% CO2的培養(yǎng)箱中,次日上午分別按DDP(10、20、30、40、50 mg· L-1)、PJ34(3、6、12、24、48、96 mg·L-1)梯度加藥。繼續(xù)培養(yǎng)48 h,每孔加入MTT溶液(5 g·L-1) 20 μL,再繼續(xù)培養(yǎng)4 h,小心棄去孔中液體,加入二甲基亞砜(DMSO) 150 μL,自動酶標(biāo)儀測定490 nm波長處每孔吸光度(A值),并計(jì)算抑制率。抑制率/%=[1-(處理組平均A值-空白對照組平均A值)/(細(xì)胞對照組平均A值-空白對照組平均A 值)]×100%。最后用SPSS 19.0軟件計(jì)算各藥物的半數(shù)抑制濃度IC50。實(shí)驗(yàn)重復(fù)3次。
1.2.2MTT法檢測PJ34聯(lián)合DDP對A549/DDP細(xì)胞增殖的影響將對數(shù)期的細(xì)胞接種于96孔板,37℃、5%CO2的培養(yǎng)箱中繼續(xù)培養(yǎng),次日上午加入無毒劑量的PJ34(3 mg·L-1)與不同濃度DDP(10、20、30、40、50 mg·L-1)聯(lián)合作用48 h,加入MTT溶液20 μL,繼續(xù)培養(yǎng)4 h,棄上清,加入DMSO 150 μL,自動酶標(biāo)儀測定490nm波長處每孔吸光度(A 值),并計(jì)算抑制率。SPSS軟件計(jì)算兩藥聯(lián)合時DDP的IC50,并計(jì)算PJ34對DDP的逆轉(zhuǎn)倍數(shù)(RF)及相對逆轉(zhuǎn)率(RRR%)。
RF>1表示逆轉(zhuǎn)劑PJ34能增強(qiáng)DDP的作用,RF=1表示兩藥無交互作用,RF<1表示拮抗作用,RF越大,說明逆轉(zhuǎn)效果越好。RRR%≥100%,表示完全逆轉(zhuǎn)作用; RRR%<100%,表示部分逆轉(zhuǎn)作用。
1.2.3Annexin V-FITC/PI雙染法檢測細(xì)胞凋亡分別設(shè)對照組、PJ34單藥組(3 mg·L-1)、DDP單藥組(12 mg·L-1)及聯(lián)合用藥組(PJ34 3 mg·L-1+ DDP12 mg·L-1)。藥物處理48 h后,根據(jù)試劑盒說明收集細(xì)胞,用400 μL Annexin V-FITC結(jié)合液重懸,加入5 μL Annexin V染色15 min,再加入10 μL PI染色5 min。1 h內(nèi)流式細(xì)胞儀上機(jī)檢測。散點(diǎn)圖左下象限散點(diǎn)顯示活細(xì)胞,右上象限散點(diǎn)顯示早期凋亡細(xì)胞,右下象限散點(diǎn)顯示晚期凋亡及壞死細(xì)胞,左上象限散點(diǎn)顯示機(jī)械損傷細(xì)胞。
1.2.4Western blot法檢測蛋白表達(dá)取對數(shù)期A549親本株及A549/DDP耐藥株接種于培養(yǎng)瓶內(nèi),分別設(shè)A549組、A549/DDP組、PJ34處理組(3 mg ·L-1)、DDP處理組(12 mg·L-1)及聯(lián)合用藥組(PJ34 3 mg·L-1+ DDP 12 mg·L-1)。藥物處理48 h后,棄上清,裂解細(xì)胞提取蛋白,-80℃保存。反復(fù)凍融3次后,BCA法進(jìn)行蛋白定量。配制SDSPAGE凝膠,取等量的蛋白質(zhì)樣本進(jìn)行上樣分離并轉(zhuǎn)移至PVDF膜上,封閉。加入相應(yīng)一抗,4℃孵育過夜。TBST洗膜,加入二抗室溫孵育2 h,洗膜。ECL試劑盒顯色,X膠片曝光。
1.2.5統(tǒng)計(jì)學(xué)處理采用SPSS 19.0統(tǒng)計(jì)軟件對數(shù)據(jù)進(jìn)行處理。實(shí)驗(yàn)數(shù)據(jù)用±s表示。兩組以上的數(shù)據(jù)比較采用方差分析,兩組間數(shù)據(jù)比較采用t檢驗(yàn)。
2 結(jié)果
2.1A549/DDP耐藥株與A549敏感株對DDP的敏感性A549/DDP細(xì)胞對DDP的耐藥性明顯高于A549細(xì)胞。DDP單藥處理48 h后的IC50分別為: A549敏感株(2.49±0.39) mg·L-1,A549/DDP耐藥細(xì)胞(26.14±0.62) mg·L-1,與敏感株相比,耐藥倍數(shù)為10.5倍(Tab 1)。
Tab 1 Sensitization of A549 and A549/DDP cells to DDP(珋±s,n=3)
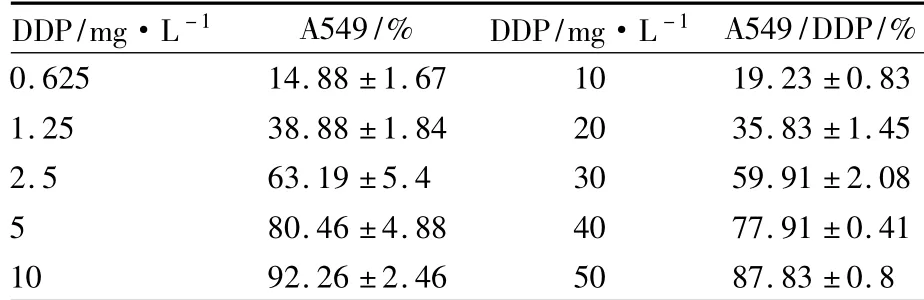
Tab 1 Sensitization of A549 and A549/DDP cells to DDP(珋±s,n=3)
DDP/mg·L-1 A549/% DDP/mg·L-1A549/DDP/% 0.625 14.88±1.67 10 19.23±0.83 1.25 38.88±1.84 20 35.83±1.45 2.5 63.19±5.4 30 59.91±2.08 5 80.46±4.88 40 77.91±0.41 10 92.26±2.46 50 87.83±0.8
2.2不同濃度的PJ34單藥對A549/DDP細(xì)胞增殖的影響PJ34單藥對A549/DDP細(xì)胞的生長也有抑制作用,抑制率隨藥物濃度的增加而增加。用SPSS19.0軟件計(jì)算,PJ34處理A549/DDP細(xì)胞48 h其半數(shù)抑制濃度(IC50)為(22.2±2.09) mg·L-1。并且,3 mg·L-1的PJ34對A549/DDP細(xì)胞的抑制率為4.43%,抑制率<5%,可認(rèn)為是該藥物的無細(xì)胞毒濃度(Fig 1)。
2.3無毒濃度的PJ34聯(lián)合DDP可明顯增強(qiáng)A549/DDP細(xì)胞對DDP的敏感性與DDP單藥組相比,無毒濃度(3 mg·L-1)的PJ34聯(lián)合DDP組A549/DDP細(xì)胞對順鉑的敏感性明顯增加,IC50值由(26.14±0.62) mg·L-1降低為(11.46±0.92) mg ·L-1(P<0.01),逆轉(zhuǎn)倍數(shù)(RF)為2.28倍,相對逆轉(zhuǎn)率(RRR%)為62.7%,提示PJ34具有部分逆轉(zhuǎn)A549/DDP細(xì)胞DDP耐藥的作用(Fig 2)。
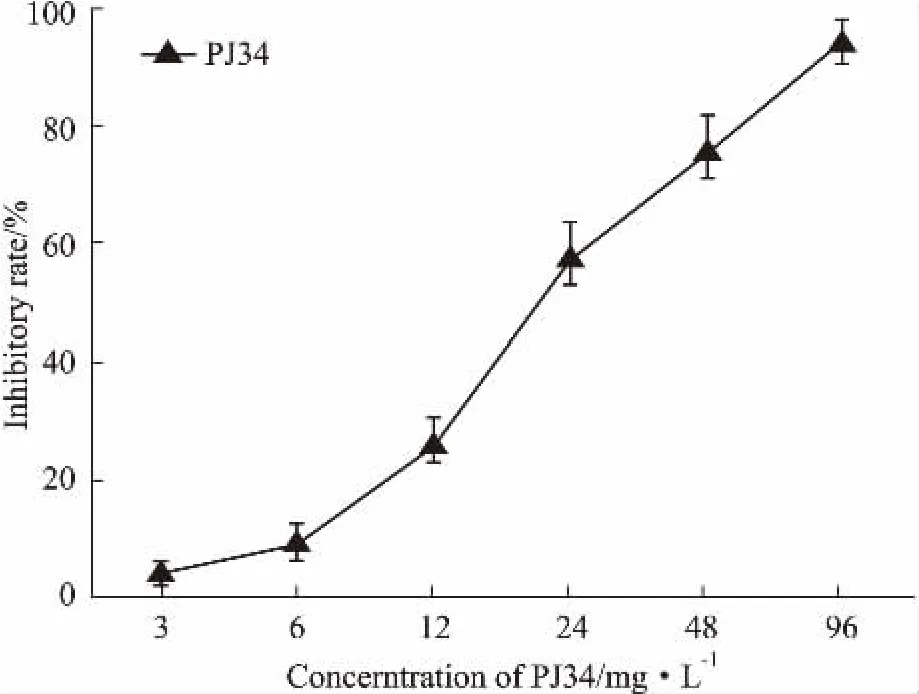
Fig 1 Inhibition ratios of PJ34 on growth of A549/DDP cellss,n=3)
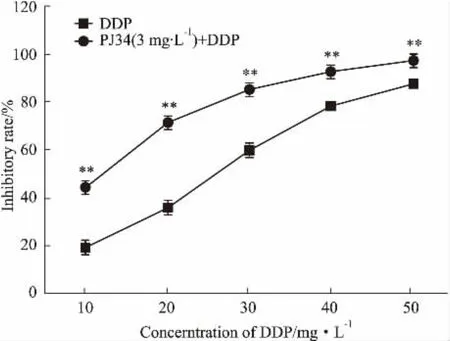
Fig 2 Inhibition ratios of DDP alone or combined with PJ34on growth of A549/DDP cells(珋±s,n=3)
2.4DDP單藥/聯(lián)合PJ34對A549/DDP細(xì)胞凋亡的影響3 mg·L-1(無毒濃度)的PJ34對A549/DDP細(xì)胞無明顯殺傷作用,凋亡率與對照組相比,P >0.05,差異無統(tǒng)計(jì)學(xué)意義。12 mg·L-1(IC50)的DDP單藥對A549/DDP細(xì)胞有一定的細(xì)胞毒作用,凋亡率為17.74%,與對照組相比,P<0.05,差異有統(tǒng)計(jì)意義。而PJ34與DDP聯(lián)合可明顯誘導(dǎo)細(xì)胞凋亡,凋亡率為33.2%,與PJ34單藥及DDP單藥組相比,P<0.05(Fig 3,Tab 2)。
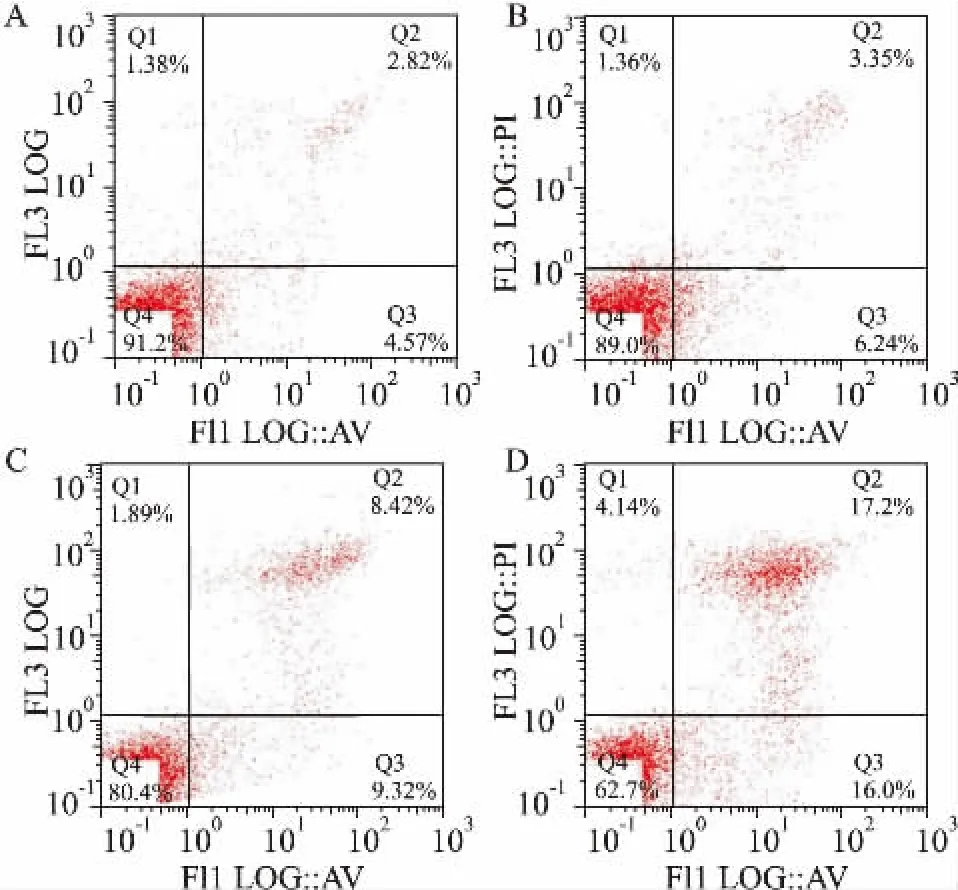
Fig 3 Apoptosis ratios of PJ34 alone or combined withDDP on A549/DDP cells
Tab 2 Apoptosis rate of A549/DDP cells treated with PJ34 alone or combined with DDP±s,n=3)

Tab 2 Apoptosis rate of A549/DDP cells treated with PJ34 alone or combined with DDP±s,n=3)
*P<0.05 vs control;ΔP<0.05 vs PJ34 and DDP.
Group Apoptosis rate/% Control 7.35±2.12 PJ34 9.46±1.8 DDP 18.02±3.57*PJ34+ DDP 34.76±3.81Δ
2.5PJ34單藥及聯(lián)合順鉑對細(xì)胞內(nèi)PARP-1、LRP、GST-π蛋白的調(diào)節(jié)作用采用Image J軟件對條帶進(jìn)行灰度值分析,結(jié)果見Fig 4、5,圖中數(shù)據(jù)均為樣本蛋白表達(dá)/β-actin表達(dá)。A549/DDP耐藥株內(nèi)PARP-1及耐藥相關(guān)蛋白LRP、GST-π的表達(dá)水平均較A549順鉑敏感株明顯升高。PJ34聯(lián)合DDP處理48 h后,A549/DDP耐藥株內(nèi)PARP-1及LRP、GST-π的表達(dá)水平均明顯下降,與A549/DDP細(xì)胞對照組及單藥處理組相比,P<0.05,差異有統(tǒng)計(jì)學(xué)意義。
3 討論
肺癌的順鉑耐藥性是造成化療失敗的主要原因之一,其耐藥機(jī)制至今仍是讓人倍感困惑的問題。目前關(guān)于肺癌耐藥相關(guān)蛋白研究較多的主要有肺耐藥相關(guān)蛋白(lung resistancerelated protein,LRP)和谷胱甘肽-S-轉(zhuǎn)移酶-π(glutathione S-transferase-Pi,GST-π)等。LRP主要通過2種機(jī)制引起多藥耐藥(multidrug resistance,MDR),一是阻止以細(xì)胞核為靶點(diǎn)的藥物通過核孔進(jìn)入核內(nèi),并將進(jìn)入的藥物在藥效發(fā)生前泵出核外;二是使胞質(zhì)中的藥物進(jìn)入囊泡,然后通過胞吐作用排出細(xì)胞[7]。LRP在腫瘤組織中含量明顯增高,可明顯影響抗癌藥物的胞內(nèi)的轉(zhuǎn)運(yùn)和分布,介導(dǎo)鉑類、烷化劑等耐藥。GST是一組具有解毒和抗氧化作用的酶類,其中GST-π的表達(dá)在人類腫瘤細(xì)胞中明顯增高,與耐藥關(guān)系最密切,DDP等抗癌藥物都是通過該系統(tǒng)被運(yùn)送至胞外[8]。Bai等[9]曾經(jīng)報道NSCLC患者組織中GST-π表達(dá)與順鉑的化療有效率呈明顯負(fù)相關(guān),說明了GST-π是介導(dǎo)肺癌DDP耐藥的重要因素之一。在本研究中,我們發(fā)現(xiàn)A549/DDP耐藥株的LRP、GST-π蛋白表達(dá)水平均較A549敏感株明顯升高,與上述文獻(xiàn)報道相符,本研究補(bǔ)充了PARP-1抑制劑聯(lián)合DDP降低A549/DDP耐藥株的LRP、GST-π蛋白表達(dá)水平,從而逆轉(zhuǎn)耐藥的研究。
PARP-1抑制劑的抗腫瘤作用機(jī)制主要是基于PARP-1的DNA損傷修復(fù)功能,如果PARP-1的活性被抑制,DNA單鏈損傷(single strand break,SSBs)不能得到及時修復(fù),將導(dǎo)致DNA單鏈損傷的累積,并轉(zhuǎn)化成持續(xù)的雙鏈損傷(double strand break,DSBs),最終細(xì)胞死亡[10]。最初,PARP-1抑制劑作為化療或放療增敏劑,與細(xì)胞毒性化療藥物或放療聯(lián)合應(yīng)用[11-13]。Nguewa等[14]通過體外實(shí)驗(yàn)觀察到,無毒劑量的PARP-1抑制劑3-AB與DDP聯(lián)合作用于卵巢癌順鉑耐藥細(xì)胞株CH1cisR 24 h,不僅能明顯增加耐藥細(xì)胞對DDP的敏感性,并能將細(xì)胞死亡的方式由壞死轉(zhuǎn)變?yōu)榈蛲觯瑥亩苊庖蚣?xì)胞壞死對機(jī)體產(chǎn)生的不良反應(yīng)。Michels等[15]研究發(fā)現(xiàn)與野生型A549細(xì)胞相比較,DDP耐藥細(xì)胞株對PARP抑制劑更加敏感,當(dāng)給予野生型A549細(xì)胞一定量的DDP后,細(xì)胞內(nèi)PARP-1的表達(dá)水平明顯增加,此現(xiàn)象可被PARP抑制劑完全抑制。本研究同樣觀察到PARP-1抑制劑PJ34能明顯增加肺腺癌A549/DDP耐藥細(xì)胞對DDP的敏感性,誘導(dǎo)細(xì)胞凋亡,提示這可能與其對凋亡通路的調(diào)控有一定的相關(guān)性。

Fig 4 Protein expression of PARP-1 and LRP,GST-π in A549 and A549/DDP cells(珋±s,n=3)
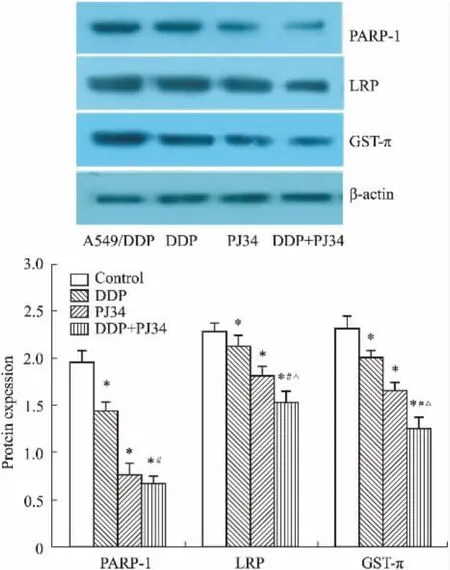
Fig 5 Protein expression level of PJ34 alone or combined withDDP on A549/DDP cells(珋±s,n=3)
PJ34是第3代選擇性PARP-1抑制劑,屬于菲啶酮類化合物,口服和注射給藥生物利用度都很高。其抑酶活性是傳統(tǒng)PARP抑制劑3-AB的10 000倍。Gangopadhyay等[16]研究發(fā)現(xiàn)PJ34單藥即可抑制NSCLC細(xì)胞系Calu-6、A549及H460的增殖與轉(zhuǎn)移,并能通過激活Caspase介導(dǎo)的細(xì)胞凋亡通路促進(jìn)細(xì)胞凋亡。本文研究結(jié)果與其一致,還檢測了PJ34對A549/DDP耐藥細(xì)胞的增殖抑制作用。此外還有文獻(xiàn)[17]顯示: NSCLC細(xì)胞對DDP的敏感性與鉑-DNA加合物的累積正相關(guān),PARP抑制劑PJ34具有放緩鉑-DNA加合物清除速度的能力,從而起到DDP增敏作用。
綜上所述,本研究說明PARP-1抑制劑PJ34單藥可抑制A549/DDP細(xì)胞的增殖,在無細(xì)胞毒作用的低劑量(3 mg·L-1)下,PJ34可明顯增強(qiáng)A549/DDP細(xì)胞對DDP的敏感性,部分逆轉(zhuǎn)耐藥現(xiàn)象,其逆轉(zhuǎn)機(jī)制可能與誘導(dǎo)細(xì)胞凋亡、降低細(xì)胞內(nèi)PARP-1蛋白及多藥耐藥蛋白LRP、GST-π的表達(dá)水平有關(guān),其具體作用機(jī)制有待進(jìn)一步地深入研究,期望能為DDP耐藥的NSCLC患者的治療提供一定的指導(dǎo)意義。
(感謝安徽醫(yī)科大學(xué)第一附屬醫(yī)院中心實(shí)驗(yàn)室的支持與幫助。)
參考文獻(xiàn):
[1]Castiel A,Visochek L,Mittelman L,et al.A phenanthrene derived PARP inhibitor is an extra-centrosomes de-clustering agent exclusively eradicating human cancer cells[J].BMC Cancer,2011,11 (1) :412-26.
[2]Ahmad M,Torky A,Glahn F,et al.PARP-1 expression and activity in primary human lung cells[J].Arch Toxicol,2011,85(6) : 669 -79.
[3]Michels J,Vitale I,Senovilla L,et al.Synergistic interaction between cisplatin and PARP inhibitors in non-small cell lung cancer [J].Cell Cycle,2013,12(6) :877-83.
[4]Zhang J J,Kan Y Y,Tian Y J,et al.Effects of poly(ADP-ribosyl) polymerase(PARP) inhibitor on cisplatin resistance&proliferation of the ovarian cancer C13* cells[J].Indian J Med Res,2013,137 (3) :527-32.
[5]Mirza M R,Monk B J,Ledermann J A,et al.A phase 3 randomized doubleblind trial of maintenance with PARP-inhibitor niraparib versus placebo in patients with platinum-sensitive ovarian cancer [J].Annals Oncol,2014,25(Suppl 4) :305-26.
[6]饒進(jìn)軍,何關(guān)生,毛楠,等.沉默EZH2表達(dá)逆轉(zhuǎn)人非小細(xì)胞肺癌順鉑耐藥性[J].中國藥理學(xué)通報,2014,30(8) :1084-9.
[6]Rao J J,He G S,Mao N,et al.Reverse effect of silencing EZH2 expression on human cisplatin-resistant non small cell lung cancer [J].Chin Pharmacol Bull,2014,30(8) :1084-9.
[7]Scheffer G L,Schroeijers A B,Izquierdo M A,et al.Lung resistance-related protein/major vault protein and vaults in multidrug-resistant cancer[J].Curr Opin Oncol,2000,12(6) :550-6.
[8]Goto S,Ihara Y,Urata Y,et al.Doxorubicin-induced DNA intercalation and scavenging by nuclear glutathione S-transferase pi[J].FASEB J,2001,15(14) :2702-14.
[9]Bai F,Nakanishi Y,Kawasaki M,et al.Immunohistochemical expression of glutathione-S-transferase-Pi can predict chemotherapy response in patients with non small cell lung carcinoma[J].Cancer,1996,78(3) :416-21.
[10]Abd-Elmageed Z Y,Naura A S,Errami Y,et al.The poly(ADP-ribose) polymerases (PARPs) : New roles in intracellular transport [J].Cell Signall,2012,24(1) :1-8.
[11]Fauzee N J,Pan J,Wang Y L.PARP and PARG inhibitors-new therapeutic targets in cancer treatment[J].Pathol Oncol Res,2010,16(4) :469-78.
[12]Cheng H Y,Zhang Z F,Borczuk A,et al.PARP inhibition selectively increases sensitivity to cisplatin in ERCC1-low non-small cell lung cancer cells[J].Carcinogenesis,2013,34(4) :739-49.
[13]Minami D,Taligawa N,Takeda H,et al.Synergistic effect of olaparib with combination of cisplatin on PTEN-deficient lung cancer cells[J].Mol Cancer Res,2013,11(2) :140-8.
[14]Nguewa PA,F(xiàn)uertes MA,Cepeda V,et al.Poly(ADP-ribose) polymerase-1 inhibitor 3-Aminobenzamide enhances apoptosis induction by platinum complexes in cisplatin-resistant tumor cells[J].Med Chem,2006,2(1) :47-53.
[15]Michels J,Vitale L,Galluzzi L,et al.Cisplatin resistance associated with PARP hyperactivation[J].Cancer Res,2013,73(7) : 2271-80.
[16]Gangopadhyay N N,Luketich J D,Opest A,et al.Inhibition of poly (ADP-Ribose) polymerase (PARP) induces apoptosis in lung cancer cell lines[J].Cancer Investing,2011,29(9) :608-11.
[17]Olaussen K A,Adam J,Vanhecke E,et al.PARP1 impact on DNA repair of platinum adducts: Preclinical and clinical read-outs[J].Lung Cancer,2013,80(2) :216-22.
Study of reversal effect of PARP-1 inhibitor PJ34 on cisplatin-resistance in human lung adenocarcinoma cells
YAO Yuan-yuan,HAO Ji-qing
(The First Affiliated Hospital of Anhui Medical University,Hefei 230022,China)
Abstract:AimTo investigate the reversal effect of PARP-1 inhibitor PJ34 on cisplatin-resistance in human lung adenocarcinoma A549/DDP cells and the mechanism.Methods A549/DDP cells were treated with PJ34 alone or combined with cisplatin.The effects of proliferation inhibition were assayed by MTT method.The apoptosis ratios of cells were analyzed by flow cytometry.The protein expression of PARP-1 and LRP,GST-π were measured by Western blot assay.Results
PJ34 could inhibit the proliferation of A549/DDP cells alone.The non-toxic dose of PJ34 could significantly resensitize A549/DDPcellstocisplatin,induceapoptotic,lower the expression of PARP-1 and resistance-associated protein LRP and GST-π.Conclusion
PJ34 could inhibit the proliferation of A549/DDP cells and resensitize A549/DDP cells,partially reverse cisplatin-resistance in A549/DDP cells,with a probable mechanism relating to increased apoptotic rate,and lowered expression of PARP-1 and resistance-associated protein LRP and GST-π.
Key words:lung adenocarcinoma; PARP-1 inhibitors; cisplatin; drug resistance; apoptosis; mechanism
作者簡介:姚圓圓(1988-),女,碩士生,研究方向:胸部腫瘤的個體化治療,E-mail: yao18955179781@163.com;郝吉慶(1969-),女,博士,副教授,主任醫(yī)師,碩士生導(dǎo)師,研究方向:胸部腫瘤的個體化治療,E-mail: ayfy_hjq@ 163.com
基金項(xiàng)目:安徽省自然科學(xué)基金計(jì)劃項(xiàng)目(No 1308085MH142) ;安徽省對外科技合作計(jì)劃項(xiàng)目(No 1503062023)
收稿日期:2015-01-14,修回日期:2015-03-19
文獻(xiàn)標(biāo)志碼:A
文章編號:1001-1978(2015) 06-0865-06中國圖書分類號: R329.24; R730.53; R734.202.2; R979.1
doi:10.3969/j.issn.1001-1978.2015.06.025

