手性胺拆分法制備雷美替胺*
劉發明,蘇佳鵬,范為正,馮柏年
(江南大學 藥學院,江蘇無錫 214122)
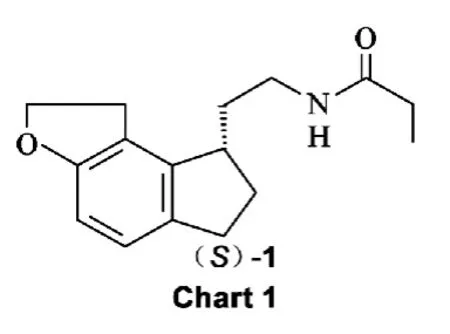
雷美替胺{(S)-N-[2-(1,6,7,8-四氫-2H-茚并[5,4-b]呋喃-8-基)]丙酰胺[(S)-1,Chart 1]}[1]是由日本武田公司研發,于2005年7月通過美國FDA批準上市的口服催眠藥物。是第一個應用于臨床治療失眠的褪黑激素受體激動劑,主要用于治療難以入睡型失眠癥,對慢性失眠和短期失眠也有確切療效,是首個不作為特殊管制的非成癮性失眠癥治療藥物。
目前,對于(S)-1的合成,主要有不對稱催化氫化[2]、生物酶拆分[3]及手性柱色譜分離等。但以上方法都存在一些缺陷,如不對稱催化合成需要制備手性催化劑,如 Ru2Cl4[(R)-BINAP]2NEt3,Ru(OAc)2[(S)-BINAP]等。由于這些手性催化劑中過渡金屬和手性配體的昂貴,加之反應中需絕對無水無氧和操作繁瑣,不易大規模工業化生產,使其應用受到限制。生物酶拆分法的酶催化條件要求較高,酶的穩定性較差,也限制了該方法的應用[4-5]。手性色譜柱分離方法要用到手性柱,手性柱價格昂貴,且不適用于工業化大生產,只適合實驗室少量規模的拆分。
化學拆分法是制備手性藥物的有效方法。對于1的拆分研究,文獻[6]方法采用(R)-苯乙胺[(R)-Ⅰ]為拆分劑對其進行拆分研究。但該方法需經多次重結晶才能得到較高ee值的(S)-1,實驗重現性不好,產率不高。
本文以(S)-Ⅰ為拆分劑,對合成雷美替胺(1)的中間體(R,S)-2-{1,6,7,8-四氫-2H-茚并[5,4-b]呋喃-8-基}乙酸[(R,S)-2]進行拆分得(S)-2;(S)-2再經3步反應合成了(S)-1(Scheme 1),ee值為97%。以L-(-)-二苯甲酰酒石酸(Ⅱ)為拆分劑,對(R,S)-2-{1,6,7,8-四氫-2H-茚并[5,4-b]呋喃-8-基}乙胺[(R,S)-3]進行拆分得(S)-3;(S)-3再與丙酰氯反應合成了(S)-1(Scheme 2),ee值為99%。1的結構經1H NMR確證。并對(R,S)-2和(R,S)-3的拆分條件進行了優化。

Scheme 1
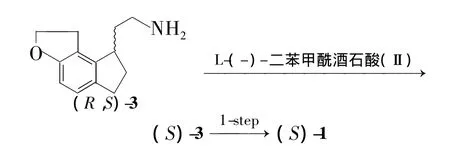
Scheme 2
1 實驗部分
1.1 儀器與試劑
BRUKER AVⅢ-400型核磁共振儀(CDCl3為溶劑,TMS為內標);Grace自動過柱機;Waters型高效液相色譜儀(手性OJ柱)。
(R,S)-2[7]和(R,S)-3[6]按文獻方法制備;其余所用試劑均為化學純。
1.2 拆分
(1)(R,S)-2的拆分
在反應瓶中加入(R,S)-2 3 g(10 mmol),異丙醇15 mL和水10 mL,攪拌使其溶解;攪拌下于60 ℃ ~65 ℃慢慢滴加(S)-Ⅰ.2.5 g(20 mmol),滴畢,于60℃ ~65℃反應1 h;于5℃ ~10℃反應至逐漸有固體析出。過濾,濾餅用稀鹽酸溶解,用乙酸乙酯(2×20 mL)萃取,合并萃取液,用飽和食鹽水洗滌,無水硫酸鈉干燥;旋蒸除溶后真空干燥得白色固體(S)-2 1.3 g。
濾液旋蒸除溶得白色固體,攪拌下用混合溶劑[V(丙酮)∶V(水)=15 ∶1]20 mL加熱使其溶解;于5℃~10℃慢慢攪拌至逐漸有固體析出。過濾,濾餅用稀鹽酸溶解,用乙酸乙酯(2×20 mL)萃取,合并萃取液,用飽和食鹽水洗滌,無水硫酸鈉干燥;旋蒸除溶后真空干燥得白色固體(S)-2 0.8 g。
合并兩次(S)-2,按上述方法進行第二次拆分得白色固體(S)-2 0.8 g 和0.5 g(即1.3 g)。
(2)(R,S)-3的拆分
在反應瓶中加入Ⅱ 11 g(1.2 eq.)和乙腈300 mL,于室溫攪拌使其溶解;滴加(R,S)-3 5 g(1.0 eq.)的乙腈(50 mL)溶液(有固體析出),滴畢,于55℃ ~60℃反應3 h。冷卻至室溫,過濾,濾餅用混合溶劑A[V(乙腈)∶V(甲醇)=10∶3]結晶[先于65℃(浴溫)中用A將其溶解,自然冷卻至室溫,再置冰箱中冷藏結晶過夜]。過濾,濾餅再用A進行重復結晶四次(操作過程同前)。
過濾,濾餅用乙腈洗滌,用二氯甲烷30 mL和1 mol·L-1NaOH溶液20 mL溶解,攪拌2 h。用混合溶劑[V(二氯甲烷)∶V(甲醇)=5∶1]萃取(2×20 mL),合并萃取液,用無水硫酸鈉干燥;旋蒸除溶得(S)-3 600 mg,產率12%。
按文獻[6]方法制得白色固體(S)-1 0.5 g,收率 78.4%,純度 99%(HPLC);1H NMR δ:1.14(t,J=7.6 Hz,3H),1.55 ~2.05(m,3H),2.18(q,J=7.6 Hz,2H),2.20 ~ 2.35(m,1H),2.70~ 2.99(m,2H),3.05 ~ 3.50(m,5H),4.48 ~4.60(m,2H),5.46(br,1H),6.61(d,J=8.0 Hz,1H),6.95(d,J=8.0 Hz,1H)。
2 結果與討論
2.1 2 的拆分
實驗中發現,重結晶溶劑對拆分效果有較大影響。考察了溶劑(乙酸乙酯、二氯甲烷、四氫呋喃、異丙醇和丙酮及其與水的混合溶劑)對拆分效果的影響,結果發現混合溶劑對拆分效果最好。為此進一步考察其比例對拆分效果的影響,結果見表1。
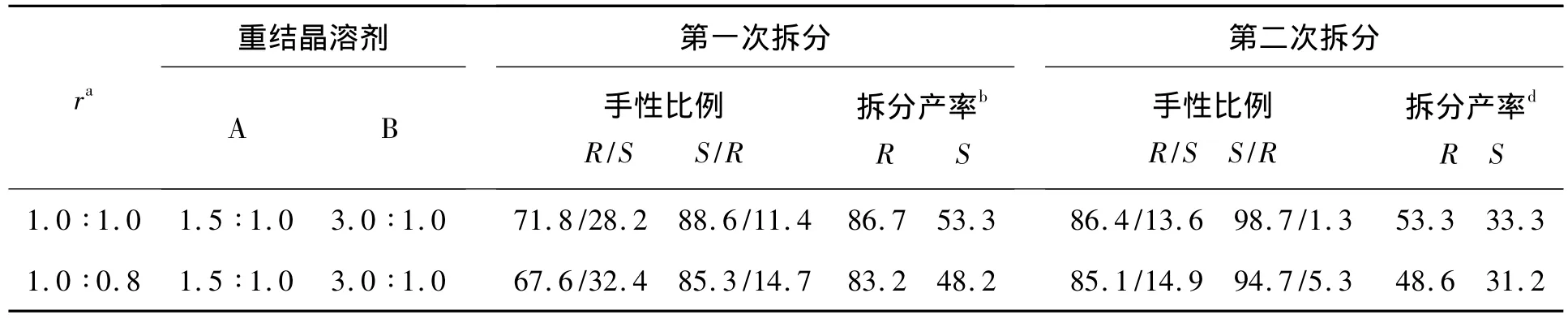
表1 重結晶溶劑和拆分劑用量對2拆分效果的影響*Table 1 Effect of recrystallization solvent and resolution agent amount on resolution efficient of 2
實驗中還考察了拆分劑種類對拆分效果的影響,如(S)-或(R)-對甲基苯乙胺,(S)-或(R)-鄰甲氧基苯乙胺,(S)-或(R)-間甲氧基苯乙胺,(S)-或(R)-對甲氧基苯乙胺,(S)-或(R)-對氯苯乙胺,(S)-或(R)-間氯苯乙胺以及(S)-或(R)-對溴苯乙胺等等拆分劑對(R,S)-2拆分效果的影響。實驗結果表明:以(S)-Ⅰ為拆分劑時,拆分效果最佳。為此,進一步考察了(S)-Ⅰ的用量[r(當量比)=(S)-Ⅰ ∶(R,S)-2]對拆分效果的影響,結果見表1。從表1 可見,當 r=1.0 ∶1.0,重結晶溶劑為 A=V(異丙醇)∶V(水)=1.5 ∶1.0,B=V(丙酮)∶V(水)=3.0 ∶1.0 時,拆分效果最佳。
實驗中還發現,(S)-構型的手性胺的拆分效果要比(R)-構型的拆分效果好,且結構越簡單,重結晶越容易。在以(S)-Ⅰ為拆分劑拆分時,(R)-構型的雷美替胺中間體較易析出,在對其過濾后,剩下的母液進行二次拆分后即獲得 ee值高達97%的光學構型。有效解決了文獻[7]方法中以(R)-Ⅰ為拆分劑時需要多次重結晶,拆分產率低下等缺點。
2.2 (R,S)-3 的拆分
以Ⅱ為拆分劑,對(R,S)-3的拆分條件進行優化,結果見表2。從表2可見,以C[V(乙腈)∶V(甲醇)10∶3]為重結晶溶劑時,經過四次重結晶制得的(S)-3;(S)-3再與丙酰氯反應合成的(S)-1,其ee值達98%。與文獻[6]方法相比,要想達到同樣的ee值,需要四次重結晶,但是,合成路線較短,共11步,而(S)-Ⅰ拆分路線則需要.14步。該拆分方法具有一定的優勢。
3 結論
(R,S)-2-{1,6,7,8-四氫-2H-茚并[5,4-b]呋喃-8-基}乙酸[(R,S)-2]的最佳拆分條件為:以(S)-苯乙胺為手性拆分劑,r=1.0 ∶1.0,重結晶溶劑 A=V(異丙醇)∶V(水)=1.5 ∶1.0,B=V(丙酮)∶V(水)=3.0 ∶1.0 時,拆分效果最佳。經過兩次重結晶后經3步反應合成的雷美替胺的ee值達97%,而文獻[7]方法則需要多次重結晶才能得到同樣的ee值的雷美替胺。
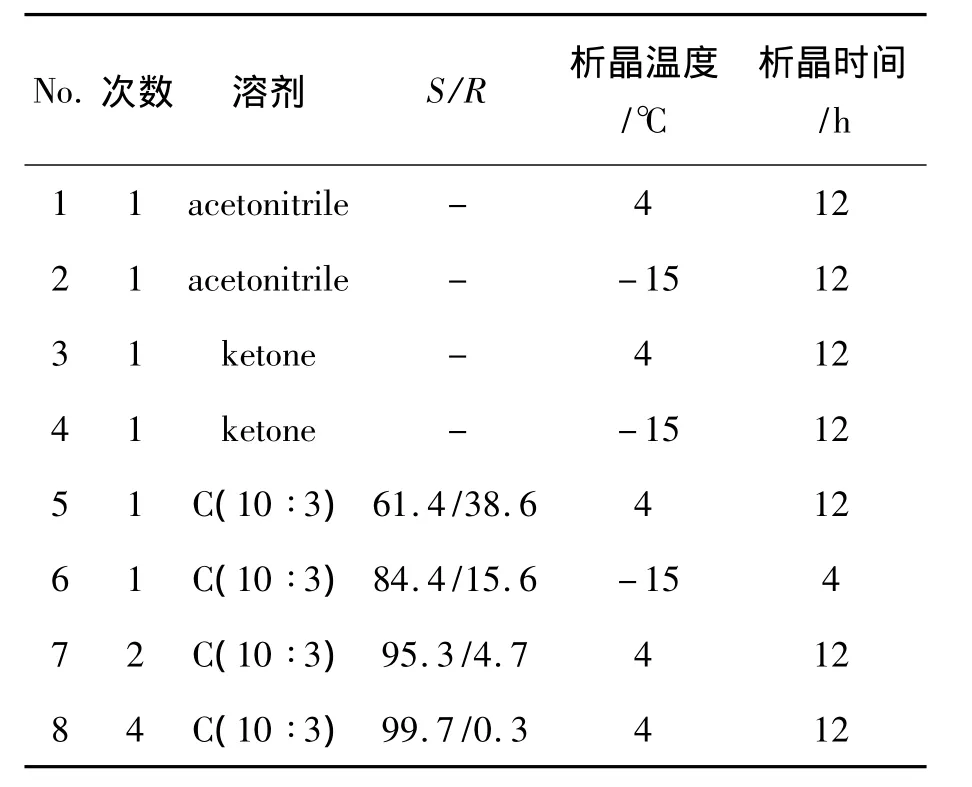
表2 重結晶溶劑對3拆分效果的影響*Table 2 Effect of recrystallization solvent on resolution efficient of 3
(R,S)-2-{1,6,7,8-四氫-2H-茚并[5,4-b]呋喃-8-基}乙胺[(R,S)-3]的最佳拆分條件為:以L-(-)-二苯甲酰酒石酸為手性拆分劑,重結晶溶劑為C=V(乙腈)∶V(甲醇)10∶3。經過四次重結晶后與丙酰氯縮合得到雷美替胺,ee值為99%。
本文報道的化學拆分法避免了昂貴的手性催化劑的使用,具有高效簡便、價格低廉、綠色環保等優點。適合工業化大生產。
[1]黃玉鳳,唐麗娜.新型催眠藥瑞美替昂及其臨床研究[J].世界臨床藥物,2006,27(9):556 -559.
[2]Noyori R.Asymmetric Catalysis in Organic Synthesis[M].John Wiley & Sons:New York,1993.
[3]Wong C H,Whitesides G M.Enzymes in Synthetic Organic Chemistry[M].Pergamon:Oxford,1994.
[4]Judit K,Johan V D E,Antal P,et al.Enzymatic resolution of bicyclic 1,3-amino alcohols in organic media[J].Tetrahedron:Asymmetry,2001,12(4):625 -631.
[5]Kansal V,Mistry D,Vasoya S.Process for the synthesisof ramelteon and its intermediates[P].WO 2 008 151 170,2008.
[6]蔣龍,夏正君,陳再新,等.雷美替胺的合成[J].中國醫藥工業雜志,2009,40(3):161 -164.
[7]毛化,鐘靜芬,時惠麟.雷美替胺合成路線圖解[J].中國醫藥工業雜志,2010,41(10):783-785.

